Anno Accademico 2011-12
A. CERIOTTI
Complesso
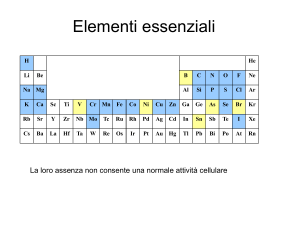
Definizione: è una specie chimica (neutra o carica) in cui un atomo centrale
(metallo di transizione o elemento non di transizione) è circondato da altri
atomi o gruppi di atomi, detti leganti, in numero superiore allo stato di
ossidazione formale dell’atomo centrale.
Es. [CoIIICl(NH3)5]2+
Composto di coordinazione
Definizione: è un composto di tipo molecolare o ionico in cui è presente
almeno un complesso.
Es. [NiCl2(PPh3)2]
;
[CoCl(NH3)5]Cl2
;
[Cu(CH3CN)4][PF6]
Il numero di atomi o gruppi di atomi legati direttamente all’atomo centrale
costituisce il numero di coordinazione (N.C.) dell’atomo centrale.
La sfera interna del complesso è l’insieme dei leganti direttamente legati
all’atomo centrale. Es.
[Mn(H2O)5(SO4)]
(SO42- nella sfera interna)
La sfera esterna del complesso è l’insieme dei leganti non direttamente
legati all’atomo centrale, ma che interagiscono in qualche modo con il
complesso. Es:
[Mn(H2O)6](SO4)
(SO42- nella sfera esterna – controione)
Un complesso polimetallico contiene più atomi di metallo non legati
direttamente,
es.
[Be4O(CH3CO2)6]) acetato basico di berillio
es. [V10O28]6- ione decavanadato (poliossoanione)
I complessi polimetallici possono essere polimerici (MOF : Metal Organic
Frameworks)
es. [RhCl(CO)(t-dppethe)]
(t-dppethe : trans-difenilfosfinoetene)
Un complesso a cluster metallico contiene più atomi di metallo legati
direttamente tra loro,
es.
[Rh6C(CO)15]2-
anione pentadecacarbonilcarbonesarodio
il complesso deve essere evidenziabile come entità distinta,
Es.
[AlF6]3-
in
(NH4)3[AlF6] (s)
il numero di coordinazione può essere individuato anche nelle strutture
condensate in stato solido,
Es.
NaCl(s)
N.C.Na = 6
L’atomo centrale è un acido di Lewis, i leganti sono basi di Lewis.
I leganti possono essere specie già pronte per la formazione del
complesso (NH3, H-), oppure specie che si modificano per la
formazione del complesso (H+), oppure specie che si formano durante
la formazione del complesso (cyclam).
Il legante interagisce con l’atomo centrale mediante legami covalenti
(più o meno polarizzati) con formale donazione di coppie di elettroni.
Il numero di coordinazione (N.C.):
può essere uguale al numero di coppie elettroniche donate,
Es. [CoCl(NH3)5]2+
N.C.Co = 6
coppie el. = 6
oppure minore del numero di coppie elettroniche donate,
Es. [VO(acac)2]
N.C.V = 5
coppie el. = 6
Un complesso “classico” è formato da un atomo centrale in medio-alto
stato di ossidazione ( +2) e contiene prevalentemente leganti -donatori
o anche - e -donatori,
es.
[SiF6]2-
,
[NiCl4]2-
Un complesso “non classico” è formato da un atomo centrale in
medio-basso stato di ossidazione ( +2) e contiene prevalentemente
leganti -donatori e -accettori,
es.
[Fe(C5H5)2]
,
[Ni(CO)4]
,
[Cr(NO)4]
Un complesso organometallico contiene almeno un’interazione di
legame metallo-carbonio,
es.
[PtCl3(C2H4)]-
,
[Al(CH3)4]-
Un complesso organometallico di tipo
contiene leganti organici
donatori di elettroni presenti in sistemi di orbitali di tipo ,
es.
[PtCl3(C2H4)]-
,
[Fe(C5H5)2]
Principio di elettroneutralità (Pauling)
Un complesso classico è stabile quando ogni atomo porta su di sé una carica
elettrica piccola (-1
+1) e, grazie alle differenze di elettronegatività tra i
vari atomi, l’eventuale carica libera viene in delocalizzata sugli atomi periferici
dei leganti, tramite legami covalenti polarizzati.
complessi cationici sono stabili con atomi periferici (es. H ;
legati ad atomi più elettronegativi (es. N ;
metallo (
Co
N
H
= 2,20)
= 3,04), a loro volta legati al
= 1,88). Es. [CoCl(NH3)5]2+ .
complessi anionici sono stabili con atomi periferici elettronegativi (es. F ;
F
= 3,98) legati al metallo (
Fe
= 1,83). Es. [FeF6]3- .
Pauling ha sviluppato un metodo semiquantitativo per calcolare la carica
residua sull’atomo centrale e sugli atomi dei leganti e quindi trarre una
previsione sulla stabilità del complesso,
Es:
[Be(H2O)4]2+
+2 = (-0,08) (Be) + (4 x -0,06) (O) + (8 x +0,29) (H)
[Be(H2O)6]2+
+2 = (-1,12) (Be) + (6 x -0,06) (O) + (12 x +0,29) (H)
[Al(H2O)6]3+
+3 = (-0,12) (Al) + (6 x -0,06) (O) + (12 x +0,29) (H)
[Al(NH3)6]3+
+3 = (-1,08) (Al) + (6 x +0,20) (O) + (18 x +0,16) (H)
Un complesso non classico (organometallico) è stabile quando la carica
negativa portata dai leganti sull’atomo metallico centrale (donazione) viene
in gran parte delocalizzata sugli atomi periferici dei leganti, tramite
retrodonazione.
Sia la donazione che la retrodonazione avvengono mediante interazione di
legame covalente:
Cr(-)
C O (+)
Cr C O
i complessi con il metallo in alto stato di ossidazione (+4, +5, +6, +7)
sono stabili quando i leganti sono in grado di abbassare la carica
positiva sul metallo mediante legami covalenti polarizzati
(
L
M)
(
L
M)
+
di donazione,
(leganti tipici : F, Cl, O ; composti tipici : [VOCl3] , [MnO4]- , [CrF6])
i complessi con il metallo in basso stato di ossidazione (-1, 0, +1)
sono stabili quando i leganti sono in grado di abbassare la carica
negativa sul metallo mediante legami covalenti
donazione e
(
M
L)
(
M)
L
di
di retro donazione,
(leganti tipici : CO, PR3, areni ; composti tipici : [Ni(CO)4] , [Cr(C6H6)2])
i complessi con il metallo in stato di ossidazione intermedio (+2, +3)
sono stabili quando i leganti sono in grado di abbassare la carica netta
sul metallo mediante legami covalenti polarizzati
(
L
M)
di
donazione,
(leganti tipici : H2O, NH3 ; composti tipici : [Fe(H2O)6]2+ , [Co(NH3)6]3+)
Sviluppo storico della chimica di coordinazione
Prime scoperte casuali
(Diesbach – Berlino, 1700)
KCN Fe(CN)2 Fe(CN)3 (blu di Prussia)
(formulazione corretta KFe[Fe(CN)6]).
(Tassaert – Parigi, 1798)
CoCl3·6 NH3
(formulazione corretta [Co(NH3)6]Cl3).
come potevano interagire specie, es. CoCl3 e NH3 , aventi valenze già sature ?
perché CoCl3·6 NH3 non veniva distrutto immediatamente dagli acidi concentrati ?
Il metallo può dare un numero di legami superiore a quello previsto
dalla sua valenza.
Primi studi
(Jorgensen, Werner)
sintesi di composti di Co(III), Cr(III), Pt(IV), Pt(II) tramite reazioni
tra sali metallici e molecole neutre o ioni (leganti),
isolamento allo stato solido dei prodotti,
analisi dei prodotti per la loro formulazione:
analisi elementare,
analisi chimica con reazioni di precipitazione,
es.
CoCl3 . 6 NH3
3 ioni Cl- (AgCl)/mole
CoCl3 . 4 NH3
1ione Cl- (AgCl)/mole
[Co(NH3)6]Cl3
[CoCl2(NH3)4]Cl
misure di conducibilità molare,
es.
PtCl4 . 6 NH3
M
= 523 Scm2/mole
PtCl4 . 2 NH3
M
= 0 Scm2/mole
[Pt(NH3)6]Cl4
[PtCl4(NH3)2]
separazione degli isomeri di un composto,
misura del potere rotatorio in composti otticamente attivi,
Teoria della coordinazione (Werner – Zurigo, 1893)
La teoria si basa su tre postulati:
I.
II.
gli elementi hanno due tipi di valenza:
valenza primaria (
valenza secondaria (
stato di ossidazione),
numero di coordinazione),
gli elementi tendono a soddisfare entrambi i tipi di valenza; nei
complessi:
i leganti anionici o cationici possono soddisfare sia la valenza
primaria che quella secondaria,
III.
i leganti neutri possono soddisfare solo la valenza secondaria,
la valenza secondaria è diretta verso posizioni fisse nello spazio
(stereochimica).
dalle analisi chimiche Werner stabilì che i complessi di Co(III) hanno
una valenza primaria di 3 e una valenza secondaria di 6.
dal conteggio degli isomeri isolati Werner stabilì che i complessi
esacoordinati di Co(III) hanno geometria ottaedrica.
N.B. occorreva ammettere che tutti gli isomeri possibili per un certo complesso fossero
stati isolati
N.B. la prova definitiva venne dalla scoperta di 2 isomeri ottici per il complesso [Co(en)3]3+
(en: 1,2-etandiammina , H2N-CH2-CH2-NH2), giustificati solo dalla geometria ottaedrica
Teoria del legame di coordinazione (Lewis – Berkeley, 1916)
La teoria si basa sul postulato che il legame tra due atomi avviene tramite la
condivisione di una coppia di elettroni (legame covalente).
Nel caso in cui uno solo dei due atomi fornisca la coppia elettronica, si parla
di legame covalente dativo.
il legame dativo consente di spiegare la formazione dei complessi e
l’interazione presente per saturare la valenza secondaria, es:
Ag+ + 2 NH3
[Ag(NH3)2]+
la reazione di formazione di un complesso è una reazione tra un acido
di Lewis (metallo) e una base di Lewis (legante),
[H3N Ag+ NH3]
un legante viene definito come una qualunque molecola o ione che
possiede almeno una coppia di elettroni da donare,
Regola del numero atomico effettivo (EAN) (Sidgwick – Oxford, 1927)
(è un’estensione, ai complessi metallici, della regola dell’ottetto di Lewis)
La regola dice che l’atomo centrale tende ad acquistare elettroni dai leganti
fino a che il numero complessivo di elettroni intorno a sé (numero atomico
effettivo) è pari a quello del gas raro successivo.
es:
Co3+
[Co(NH3)6]3+
= 27 – 3 = 24 e-
6 NH3 = 6 x 2
= 12 e36 e- (rispetta la EAN)
es:
[Ni(NH3)6]2+
Ni2+
= 28 – 2
= 26 e-
6 NH3 = 6 x 2
= 12 e38 e- (non rispetta la EAN)
es:
Cr2+
[Cr(OOCCH3)2H2O]2
= 24 – 2 =
22 e-
2 CH3COO- = 2 x 4 =
8 e-
H2O
2 e-
= 2
=
32 e- (rispetta la EAN - legame quadruplo Cr-Cr)