caricato da
common.user7231
Geometrie Molecolari VSEPR e Concetti Chimici
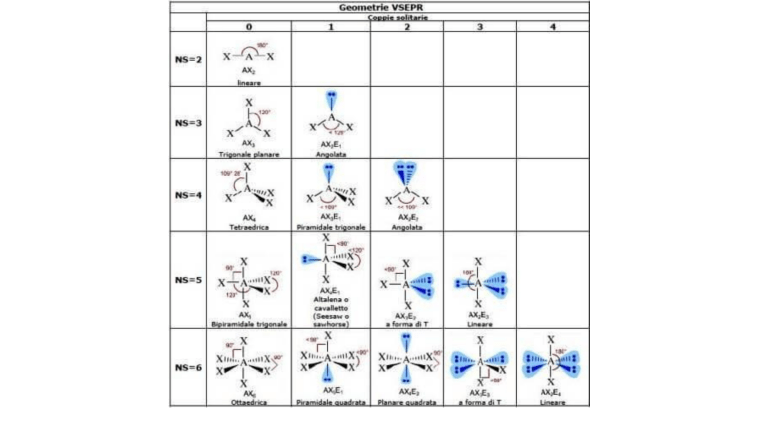
L’OSSIGENO NON PUO’ FARE ESPANSIONE DI VALENZA perché APPARTIENE AL SECONDO PERIODO CONFIGURAZIONE DELL’ELEMENTO CON N.A 21 Lo scandio è l'elemento chimico di numero atomico 21 e il suo simbolo è Sc. IIIB 1s2 2s2 2p6 3s2 3p6 4s2 3d1 Acetilene C2H2 acido ELEMENTO H C 10 ELETTRONI 1 4 ATOMI 2 2 TOT 2 8 La molecola dell'acetilene è una molecola lineare; Ciascun atomo di carbonio dell'acetilene è ibridato sp e presenta quindi due orbitali 2p non ibridati resi disponibili per i legami π. Il risultato è una molecola cilindrica nella quale gli atomi di carbonio del triplo legame sono "seppelliti" dai due sistemi di elettroni π. H2O ACQUA 1: 1S 8: 1S2 2S2 2P4 Geometria tetraedrica Ibridazione sp3 Legame covalente con h Poichè l'atomo di Ossigeno è molto più elettronegativo degli atomi di idrogeno, risulterà una delocalizzazione parziale di carica negativa sull'ossigeno, e positiva sui protoni, con risultato di una molecola molto polare e che potrà facilmente sviluppare legami a idrogeno intermolecolari. Questa polarità responsabile: il forte potere solvente dell'acquaspecialmente nei confronti di sostanze ioniche; il fenomeno della tensione superficiale dell'acqua. I forti legami a idrogeno sono responsabili anche dell'elevato punto di ebollizione (100°C) e punto di congelamento (0°C). Legame idrogeno dipolare. Il legame a idrogeno o ponte a idrogeno è un caso particolare di forza intermolecolare in cui è implicato un atomo di idrogeno coinvolto in un legame covalente con elementi molto elettronegativi (come fluoro (F), ossigeno (O), azoto (N)),[1] i quali attraggono a sé gli elettroni di valenza, acquisendo una parziale carica negativa (δ-) lasciando l'idrogeno con una parziale carica positiva (δ+).[2] Contemporaneamente l'idrogeno viene attratto da un atomo elettronegativo di una molecola vicina. BENZENE, C6H6 Il benzene è un idrocarburo, è il capostipite dei composti aromatici a. debole tutti i legami carbonio - carbonio sono equivalenti ed hanno una lunghezza che è superiore a quella di un doppio legame ma inferiore a quella di un singolo legame. La risonanza è quel fenomeno secondo cui una molecola può essere rappresentata solo attraverso diverse strutture che differiscano tra loro per una diversa distribuzione degli elettroni. ogni legame C-C è un ibrido tra un singolo e un doppio legame, pertanto la sua lunghezza sarà intermedia tra quella di un singolo e quella di un doppio legame. Ogni atomo di carbonio del benzene è ibridato sp2 con geometria trigonale planare e angoli di 120°: I restanti sei orbitali di tipo p, uno su ciascun atomo di carbonio, sono disposti perpendicolarmente al piano della molecola, sono paralleli fra loro e si sovrappongono lateralmente. Tale sovrapposizione interessa contemporaneamente tutti e sei gli orbitali p con formazione di un unico orbitale a forma di ANELLO. La teoria degli orbitali molecolari (teoria MO) dà una rappresentazione più corretta. I sei orbitali atomici 2p, paralleli tra loro e perpendicolari al piano dell'anello, si combinano tra loro per formare altrettanti orbitali molecolari p di cui tre sono orbitali molecolari di legame (p1, p2, p3) e i tre sono orbitali molecolari di antilegame (p4*, p5*, p6*). I sei elettroni del sistema p sono collocati nei tre orbitali molecolari di legame (p1, p2, p3). teoria OM benzene La particolare stabilità del benzene è dovuta proprio al fatto che tutti gli orbitali molecolari di legame sono pieni, mentre tutti gli orbitali molecolari diantilegame (p4*, p5*, p6*) sono vuoti. Tale configurazione è detta a guscio chiuso. C6H5COOH CONFIGURAZIONE CARBONIO 1s2 2s2 2p2 il numero atomico del carbonio è Z = 6, quindi l'atomo di carbonio ha 6 protoni e 6 elettroni. il carbonio ha solo due orbitali 2p semipieni e, pertanto, dovrebbe dare origine solamente a due legami covalenti. In realtà il carbonio è prevalentemente tetravalente, cioè in grado di formare 4 legami con altri atomi. Si suppone pertanto la promozione di un elettrone dall'orbitale 2s all'orbitale 2p vuoto e la successiva ibridazione orbitalica. Il C, elemento del quarto gruppo e del secondo periodo, possiede 6 protoni e 6 elettroni disposti negli orbitali. ha cioè 2 elettroni spaiati nel livello più esterno. Poiché nei composti organici il C forma 4 legami covalenti, significa che un elettrone dell'orbitale 2s è promosso nell'orbitale 2p e poi si verifica l'ibridazione. Ibridazione sp3 Si ottiene dal rimescolamento dell'orbitale s con 3 orbitali p. I 4 orbitali ibridi si dispongono ai vertici di un tetraedro, con angoli di 109.5°. I legami che formano con gli altri elementi sono di tipo σ, perciò molto forti. sp2 Dopo la promozione dell'elettrone, un orbitale s si ibrida con 2 orbitali p. I 3 orbitali ibridi si dispongono sullo stesso piano con angoli di 120°, mentre l'orbitale p non ibridato si pone perpendicolarmente agli altri 3. Quando si sovrappone un orbitale p non ibridato di un C con quello di un altro C si ha un legame π, più debole del legame σ; quindi, tra due atomi di C si ha un doppio legame: uno σ e uno π. sp Un orbitale s si sovrappone ad un solo orbitale p. I 2 orbitali ibridi ottenuti si dispongono lungo un asse con un angolo di 180°. Gli orbitali p non ibridati si pongono perpendicolari tra loro e agli orbitali ibridi. Gli orbitali ibridi formano due legami σ con altri elementi, mentre tra i due C si ha un triplo legame: uno σ e due π. ACIDO ACETICO CH3COOH, debole ELEMENTO C H O ELETTRONI 4 1 6 ATOMO 2 4 2 TOTALE 8 4 12 24 1s2 2s2 2p2 1s CH3COOH: ibridazione sp3 (CH3); ibridazione sp2 (COOH); ACIDO ARSENICO, H3AsO4, debole ACIDO ARSENIOSO, H3AsO3, debole AS 5 L'arsenico è ibridato sp3 ed è legato a tre gruppi -OH e a un atomo di ossigeno tramite doppio legame. La geometria molecolare è tetraedrica con una distribuzione di carica asimmetrica pertanto la molecola è polare. ACIDO BORICO,H3BO3, debole B3 ibridazione sp3). Ha una struttura planare in cui il boro forma angoli di 120° con tre gruppi –OH e l’acido borico cristallino è costituito da strati di molecole legate tra loro da legami a idrogeno. ACIDO BRONIDRICO, HBr, forte BR 7 Legame covalente polare Sp lineare ACIDO IPOBROMOSO, HBrO, debole Angolata sp3 ACIDO CARBONICO, H2CO3, deb trigonale planare con angolo di 120 gradi, ibridazione sp2 ACIDO CIANIDRICO HCN, DEBOLE un legame σ H—C, un legame σ e due legami π che formano il triplo legame C≡N; inoltre è presente un doppietto elettronico non impegnato sull'azoto. Molecola lineare Carbonio sp ACIDO CLORICO HCLO3 forte ELEMENTO H CL O 26 ELETTRONI 1 7 6 ATOMO 1 1 3 TOTALE 1 1: 1S 7 17: 1S2 2S2 2P6 3S2 3P5 18 8: 1S2 2S2 2P4 geom piramid a base triang ibr cloro sp3 Cloro pentavalente Anidride: ossido non metallico che dà con l'acqua una reazione acida. ACIDO CLORIDRICO, HCL forte lineare ELEMENTO ELETTRONI ATOMI TOT H 1 1 1 Cl 7 7 7 8 ACIDO CLOROSO, HCLO2 DEBOLE ELEMENTO H CL O 20 ELETTRONI 1 7 6 ATOMO 1 1 2 TOTALE 1 7 12 ACIDO IPOCLOROSO, DEBOLE, HClO ELEMENTO H CL O 14 ELETTRONI 1 7 6 ATOMO 1 1 1 TOTALE 1 7 6 ACIDO PERCLORICO HCLO4 FORTE Elemento H Cl O elettroni esterni 1 7 6 atomi 1 1 4 totale 1 7 24 1: 1s 17: 1s2 2s 2p6 3s2 3p5 8: 1S2 2S2 2P4 30 3 legami dativi Geometria tetraedrica Ibridazione sp3 CONFIGURAZIONE ELETTRONICA DEL CLORO indica la disposizione degli elettroni negli orbitali di questo elemento chimico. Il cloro (Cl) ha numero atomico Z = 17, ciò significa che ha 17 protoni e quindi 17 elettroni. Seguendo la regola della diagonale e ricordando che nell'orbitale s possono essere collocati al massimo 2 elettroni, nell'orbitale p possono essere collocati al massimo 6 elettroni, è possibile scrivere la configurazione elettronica del cloro, che è la seguente: 1s2 2s2 2p6 3s2 3p5 Il livello di energia esterno, parzialmente o completamente occupato dagli elettroni è il terzo, infatti il Cl appartiene al 3° periodo. Inoltre il cloro ha 7 elettroni di valenza (gli elettroni di valenza sono quelli presenti nell'ultimo livello di energia cioè questi: 3s2 3p5); il Cl infatti appartiene al gruppo VII. (gruppo degli alogeni). ACIDO FLUORIDRICO, HF, DEBOLE F7 ACIDO FORMICO HCOOH, DEBOLE ELEMENTO ELETTRONI ATOMI TOTALE H 1 2 2 C 4 1 4 O 6 2 12 Il carbonio avrà una ibridazione sp2.Dalla sovrapposizione di un orbitale sp2 del carbonio con un orbitale sp2 dell'ossigeno si forma un legame sigma e dalla sovrapposizione dell'orbitale p del carbonio e dell'orbitale p dell'ossigeno si forma un legame pi-greco. Dunque il carbonio forma angoli di legame di 120 gradi,e tutta la molecola ha una geometria planare.Gli altri orbitali sp2 del carbonio poi vengono utilizzati per formare altri legami sigma con altri carboni. 18 ACIDO IODIDRICO, HI, FORTE I7 ACIDO NITRICO HNO3 FORTE ELEMENTO ELETTRONE ATOMO TOT H 1 1 1 N 5 1 5 O 6 3 18 Struttura planare della molecola. I legami covalenti N-O, disposti tra loro secondo un angolo di 130°, sono asimmetrici rispetto al legame NOH. sp2 24 ACIDO NITROSO, HNO2 DEBOLE ibrid sp2 , geometria angolata: e.Trigonale planare Legame di tipo s ELEMENTO ELETTRONI ATOMI TOTALE H 1 1 1 N 5 1 5 O 6 2 12 18 ACIDO SOLFORICO: H2SO4 forte HSO424:4=6 16: 1s^2 2s^2 2p^6 3s^2 3p^4 1: 1s 8: 1s^2 2s^2 2p^4 Geometria tetraedrica Zolfo ibridato sp3 Legame pgreco Ossigeno ibridato sp2 quattro legami σ ACIDO SOLFIDRICO, H2S, FORTE Il solfuro di idrogeno a geometria tetraedrica con angolo di legame H-S-H di 92.1°. SP3 ACIDO SOLFOROSO, DEBOLE, H2SO3 ELEMENTO H S O 26 ELETTRONI 1 6 6 ATOMO 2 1 3 S tetravalente, geometria piramide a base triangolare, S ibridizzato sp3 : tre legami σ ed un doppietto g.e. tetraedrica TOTALE 2 6 18 NITRATO DI SODIO,SALE, NANO3 MONOSSIDO DI CARBONIO,CO2 TRIGONALE PLANARE MONOSSIDO DI AZOTO, NO DIFLUORURO DI SODIO, SF2 Pentafluoruro di fosfato, pf5 ANIDRIDE SOLFORICA, SO3 CARBONATO DI SODIO, Na2CO3 BROMATO, BrO3 Formaldeide,CH2O Trifluoruro di bromo,BrF3 CLO2, DIOSSIDO DI CLORO Trifluoruro di boro, BF3 Anidride solforosa, SO2 ACIDO FOSFORICO, H2PO4 Tetrafluoruro di zolfo,SF4 Tricloruro di fosforo,PCl3 UREA CH4N2O ACRILONITRILE CH2CHCN









