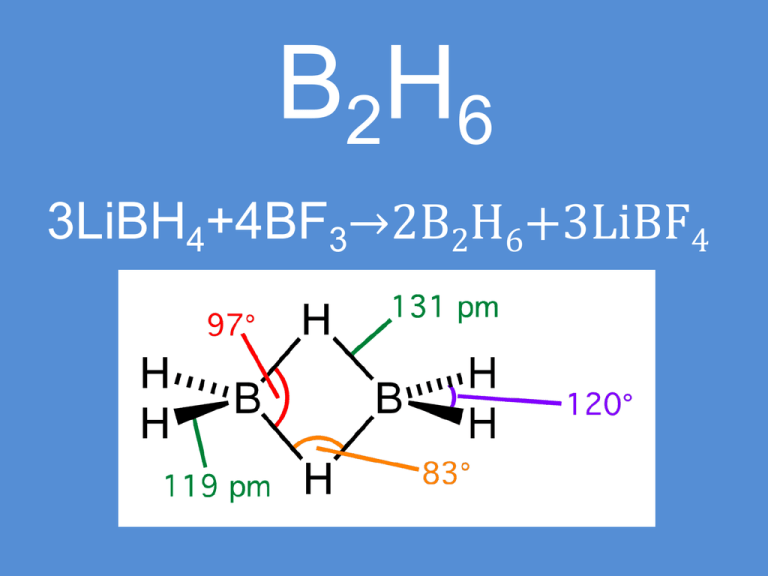
B2H6
3LiBH4+4BF3→2B2H6+3LiBF4
Teoria degli orbitali molecolari (MO)
Gli orbitali molecolari si estendono su tutta la molecola
Legame nelle molecole biatomiche eteronucleari
= c A A+ c B B
• In un legame covalente apolare cA = cB e la
coppia degli elettroni risulta condivisa
egualmente dai due atomi
• In un legame ionico il coefficiente relativo
ad uno degli ioni è quasi zero, perché
l’altro ione ha catturato pressocchè tutta
la densità elettronica
• In un legame covalente polare l’orbitale
atomico appartenente all’atomo più
elettronegativo ha energia minore, quindi
contribuisce in maggior misura a
costituire l’orbitale molecolare di minima
energia
4*
C2p
2*
O2p
3
C2s
1
2*
O2s
1
H 2O
Non Legante
Legante
Legante
Legante
Benzene
SF6
Molecole grandi coniugate
Legame Metallico
I metalli costituiscono circa i 2/3 degli elementi della tavola periodica.
Sono caratterizzati da bassi valori delle energie di ionizzazione e bassa
elettronegatività.
Allo stato elementare esistono principalmente allo stato solido cristallino
ed hanno le seguenti proprietà:
a) Elevata conducibilità elettrica e termica;
b) Buona duttilità e malleabilità, ossia la capacità di lasciarsi ridurre in fili
ed in lamine per via meccanica. Proprietà indicative sia della mancanza di
legami orientati, sia dalla presenza di piani atomici ad alta densità che
possono slittare facilmente gli uni rispetto gli altri;
c) Struttura compatta
Il legame nei metalli non è facilmente
interpretabile e la sua migliore descrizione
viene data dalla teoria delle bande, basata
sulla teoria degli orbitali molecolari
Per avere conduzione elettrica occorre che la banda di valenza,
oppure la banda che si sovrappone a quella di valenza satura, sia
vuota o solo parzialmente occupata da elettroni in modo da costituire
una banda di conduzione.
Infatti la presenza di una banda di orbitali molecolari non
completamente occupati permette la conducibilità elettrica e termica












