Asma: impostazione del trattamento “a step”
nelle più recenti versioni delle Linee Guida
il paziente deve essere asintomatico con normale funzione
respiratoria e senza risvegli notturni. Per la maggior parte
dei pazienti, come trattamento sintomatico si raccomanda un
β2-agonista a breve durata d’azione (SABA, Short-Acting Beta
Agonist). Gli step di trattamento successivi, dal 2 al 5, combinano un farmaco sintomatico con un farmaco di controllo.
Nello step 2, si raccomanda l’impiego di una terapia regolare con corticosteroidi inalatori (ICS) a basse dosi come trattamento iniziale di fondo nei pazienti con asma lieve persistente. È
stato dimostrato che il trattamento con ICS a basse dosi riduce
i sintomi di asma, aumenta la funzionalità polmonare, migliora
la qualità della vita e riduce il rischio di riacutizzazioni e di
ospedalizzazioni legate all’asma o di morte. Farmaci di controllo
alternativi comprendono gli antileucotrienici che, tuttavia, sono
meno efficaci degli ICS. Gli antileucotrienici possono essere
indicati nei pazienti incapaci o non disposti ad assumere ICS,
nei pazienti che soffrono di intollerabili effetti collaterali da ICS
o nei soggetti con rinite allergica concomitante. La teofillina
a lento rilascio ha un’efficacia limitata nell’asma, mentre gli
effetti collaterali sono comuni e possono essere anche gravi. I
cromoni (sodio nedocromile e sodio cromoglicato) hanno un
profilo di sicurezza favorevole, ma scarsa efficacia.
Lo step 3 prevede l’uso di una combinazione di ICS a
basse dosi con un β2-agonista a lunga durata d’azione (LABA,
Long-Acting Beta Agonist) (somministrati in un unico erogatore o assunti separatamente) come trattamento di fondo, con
aggiunta di un SABA al bisogno. A causa dell’effetto additivo
di queste associazioni è in genere sufficiente una bassa dose di
steroidi inalatori, che può essere aumentata se il controllo non
viene raggiunto entro 3-4 mesi. Un’altra opzione è l’impiego di
un’associazione di ICS (budesonide o beclometasone) a basse
Diagnosi
Controllo dei sintomi e fattori di rischio (incluso funzionalità polmonare)
Tecnica inalatoria e aderenza
Preferenza del paziente
Re
per vision
iod i
ich
e
Aggiustamento
trattamento
e
ion
taz
u
Val
Sintomi
Riacutizzazioni
Effetti collaterali
Soddisfazione del paziente
Funzionalità polmonare
Farmaci per asma
Strategie non farmacologiche
Trattamento dei fattori di rischio modificabili
Figura 3.1 Ciclo di trattamento dell’asma basato sul controllo (Global Initiative for Asthma. Pocket Guide, 2015).
MALATTIE ALLERGICHE
Gli obiettivi a lungo termine nella gestione dell’asma
sono controllare i sintomi e ridurre al minimo il rischio di
riacutizzazioni, danni alle vie aeree ed effetti collaterali dovuti
all’assunzione di farmaci. L’approccio alla gestione dell’asma
è basato sul controllo della malattia e viene regolato in un
ciclo continuo di valutazione, aggiustamento del trattamento
e rivalutazione della risposta terapeutica (Figura 3.1)
(Global Initiative for Asthma, 2015). Le attuali Linee Guida
GINA raccomandano un approccio progressivo a “step” per
il trattamento dell’asma (Global Initiative for Asthma, 2015).
Le opzioni terapeutiche per i diversi livelli di gravità dell’asma
sono simili sia negli adulti sia nei bambini di età superiore ai
6 anni e sono elencate nella Figura 3.2. Il concetto è quello
di un progressivo incremento del livello di terapia dallo “step
1“ allo “step 5”, con la possibilità di scegliere ad ogni livello
tra l’opzione principale (quella che ha mostrato la maggiore
efficacia comparativa negli studi clinici controllati) e le opzioni
secondarie o alternative.
La decisione di iniziare un trattamento regolare alla prima
osservazione del paziente dipende dalla gravità dell’asma al
momento della prima osservazione e dalla frequenza e dalla
gravità delle riacutizzazioni. La scelta della terapia dovrà essere
orientata dalla gravità dell’asma, da considerazioni relative
all’efficacia e agli effetti collaterali dei farmaci da utilizzare,
dall’aderenza del paziente allo schema di trattamento, nonché
dalla valutazione e dalla gestione delle comorbidità e/o dei fattori aggravanti. In ogni caso, bisogna cercare di raggiungere gli
obiettivi terapeutici con la minore quantità possibile di farmaci
e con gli schemi terapeutici più semplici.
Lo step 1 prevede il trattamento con un farmaco sintomatico nel paziente con asma intermittente lieve. Tra gli episodi,
23
STEP 1
Farmaci di controllo
di prima scelta
STEP 2
STEP 3
STEP 4
STEP 5
Bassa dose ICS
Bassa dose
ICS/LABA*
Dose medio-alta
ICS/LABA
Trattamento add-on
per es.: Anti-IgE
Antileucotrieni
(LTRA)
Bassa dose di
Teofillina*
Dose medio-alta ICS
Bassa dose ICS+LTRA
(o + Teofillina*)
Aggiungere
Tiotropio#
Alta dose ICS+LTRA
(o + Teofillina*)
Aggiungere Tiotropio#
Aggiungere bassa dose
steroide orale
Altre opzioni
Considerare
bassa dose
ICS
Farmaci al bisogno
SABA secondo necessità
SABA secondo necessità o Bassa dose ICS/formoterolo**
*Per bambini fra 6 e 11 anni la teofillina non è raccomandata e il trattamento di step 3 consigliato è la dose media di ICS. **Nei pazienti in terapia
con bassa dose di budesonide/formoterolo o bassa dose di beclometasone/formoterolo il trattamento al bisogno è rappresentato da ICS a bassa dose/
formoterolo. #Il tiotropio, somministrato mediante inalatore Soft Mist, è un trattamento aggiuntivo per i pazienti con una storia di riacutizzazioni; non è
indicato nei pazienti di età <18 anni.
MALATTIE ALLERGICHE
Figura 3.2 Approccio graduale al trattamento dell’asma (Global Initiative for Asthma. Pocket Guide, 2015).
24
dosi con formoterolo come strategia terapeutica sia di mantenimento che al bisogno. Le associazioni ICS/LABA approvate
per il trattamento della malattia includono: fluticasone/formoterolo, fluticasone/salmeterolo, beclometasone/formoterolo,
budesonide/formoterolo e mometasone/formoterolo. Un’altra
opzione negli adulti e negli adolescenti è quella di incrementare
il dosaggio degli ICS (dosi medie), ma questa strategia è meno
efficace dell’aggiunta di un LABA. Altre opzioni meno efficaci
includono l’aggiunta di un antileucotrienico agli ICS a basse dosi
o la somministrazione di basse dosi di teofillina a lento rilascio.
Nello step 4, la prima scelta è rappresentata dalla combinazione di ICS a basso dosaggio con formoterolo come terapia di
mantenimento e al bisogno, oppure dalla combinazione di ICS
a medio dosaggio con un LABA come terapia di mantenimento
più un SABA al bisogno. Le alternative includono l’aggiunta
di tiotropio negli adulti con esacerbazioni, l’impiego di una
combinazione ICS/LABA con dosaggio alto di ICS, oppure
l’aggiunta di un antileucotrienico o teofillina a lento rilascio.
Nello step 5, che riguarda i pazienti con asma grave di difficile controllo, si raccomanda l’invio del paziente a specialisti
con esperienza nella gestione dell’asma. Le opzioni di trattamento includono l’impiego di anticorpi monoclonali anti-IgE
(omalizumab) che possono essere utilizzati nei pazienti con
asma allergico grave. Il trattamento guidato dallo sputo indotto,
se disponibile, migliora gli outcome. Un’opzione alternativa,
recentemente introdotta, è la termoplastica bronchiale (TB) che
può essere utilizzata in alcuni pazienti adulti con asma grave;
tuttavia, le evidenze attuali sono limitate e gli effetti a lungo
termine non sono noti. Alcuni pazienti possono trarre beneficio
dal trattamento con corticosteroidi orali (OCS) a basse dosi
(prednisone ≤7.5 mg/die o equivalente), ma possono osservarsi
effetti collaterali sistemici a lungo termine.
Dopo l’impostazione della terapia e la scelta del livello
di trattamento consigliato, i pazienti devono essere visitati
periodicamente, preferibilmente entro 1-3 mesi dopo l’inizio
del trattamento e ogni 3-12 mesi dopo tale visita (escluse
le donne in gravidanza che devono essere visitate ogni 4-6
settimane) al fine di valutare la risposta al trattamento. Dopo
una riacutizzazione, la visita di controllo deve essere effettuata
entro una settimana. La frequenza delle visite dipende dal
livello iniziale di controllo ottenuto dal paziente, dalla risposta
ai trattamenti precedenti e dalla capacità e collaborazione del
paziente nell’iniziare un trattamento autogestito seguendo un
piano terapeutico. In occasione di ogni visita di controllo, si
dovrà verificare il livello di controllo, vale a dire se il paziente
risulta controllato, parzialmente controllato o non controllato.
I sintomi diurni e notturni, l’uso di farmaci sintomatici e le
limitazioni delle attività sono gli indici clinici da valutare.
La rivalutazione periodica dell’ottenuto controllo permette di
adeguare la terapia sia in step-up che in step-down (Global
Initiative for Asthma, 2015).
L’incremento della terapia può essere a breve termine, per
esempio durante le infezioni virali o l’esposizione ad allergeni.
Prima di considerare un incremento sostenuto della terapia, è
necessario valutare la presenza dei seguenti problemi:
• tecnica inalatoria non corretta
• aderenza terapeutica inadeguata
• fattori di rischio modificabili (es. fumo)
• presenza di sintomi dovuti a comorbidità (es. rinite allergica).
Tali problemi dovranno essere affrontati e trattati prima
di procedere ad un eventuale step-up terapeutico. Una volta
ottenuto e mantenuto per 3 mesi un buon controllo dell’asma,
si può prendere in considerazione una riduzione del trattamento,
cercando il più basso livello di trattamento in grado di controllare sia i sintomi che le riacutizzazioni e con minimi effetti
collaterali. Per lo step-down della terapia, è importante scegliere
un momento appropriato (es. assenza di infezioni respiratorie,
pazienti non in viaggio, donne non gravide). Lo step-down
terapeutico va effettuato cercando di ridurre il dosaggio di ICS
del 25-50% a intervalli di 2-3 mesi. Gli ICS non devono essere
sospesi completamente (negli adulti o adolescenti) a meno che
ciò non sia necessario temporaneamente per confermare la
diagnosi di asma (Global Initiative for Asthma, 2015).
Bibliografia
•Global Initiative for Asthma. Global Strategy for Asthma Management
and Prevention. Updated 2015. http://www.ginasthma.org/local/
uploads/files/GINA_Report_2015_Aug11.pdf
•Global Initiative for Asthma. A Pocket Guide for Physicians and
Nurses. Updated 2015. http://www.ginasthma.org/local/uploads/files/
GINA_Pocket_2015.pdf
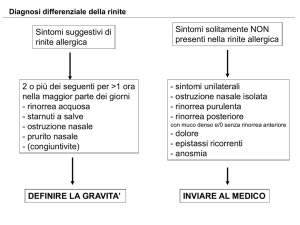
La rinite allergica: aspetti diagnostici
e moderni approcci terapeutici
La rinite o rinocongiuntivite allergica è una patologia della
mucosa nasale sostenuta da un’infiammazione IgE-mediata,
conseguente all’esposizione allergenica. È caratterizzata
clinicamente da rinorrea acquosa, starnuti a salve, prurito
nasale, ostruzione nasale e congiuntivite concomitante, reversibili spontaneamente o in seguito a terapia. Se lo stimolo
allergenico è protratto nel tempo, l’infiammazione allergica
può diventare cronica.
La rinite allergica rappresenta un problema sanitario
globale. È infatti diffusa in tutto il mondo e colpisce almeno
il 10-25% della popolazione e la sua prevalenza è in aumento.
Pur non essendo una patologia solitamente grave, la rinite
allergica condiziona pesantemente la vita sociale dei pazienti
ed influisce negativamente sul rendimento sia scolastico che
lavorativo. Inoltre, i costi economici diretti e indiretti ad essa
associati sono rilevanti.
In passato, la rinite allergica veniva classificata in perenne,
stagionale e occupazionale, in base alla durata e al tipo di
esposizione. Attualmente si utilizza la classificazione ARIA,
che si basa sulla durata e sulla gravità dei sintomi. Secondo
tale classificazione, la rinite è definita “intermittente” se la
durata dei sintomi è <4 giorni/settimana o <4 settimane, o
DIAGNOSI DI RINITE ALLERGICA
(storia +/- SPT* o IgE specifiche nel siero)
ALLONTANAMENTO DELL’ALLERGENE
lievi
Non in ordine
preferenziale:
• H1 bloccanti orali
• H1 bloccanti intranasali
• e/o
decongestionanti
SINTOMI PERSISTENTI
moderati/lievi
severi
Non in ordine
preferenziale:
• H1 bloccanti orali
•H1 bloccanti intranasali
• e/o decongestionanti
• corticosteroidi intranasali
•(cromoni)
nelle riniti persistenti rivedere il
paziente dopo 2-4 settimane
se fallimento:
step-up
se miglioramento:
continuare per 1 mese
moderati/severi
corticosteroidi intranasali
rivedere il paziente dopo 2-4 settimane
migliorato
step-down e
continuare la
terapia per 1 mese
non migliorato
rivedere la diagnosi
rivedere la terapia
indagare infezioni
o altre cause
aumentare
rinorrea
le dosi di
aggiungere
corticosteroidi
ipratropio
inalatori
prevalenza
di starnuti
aggiungere
H1 bloccanti
SE CONGIUNTIVITE aggiungere: H1 bloccanti orali, H1 bloccanti intraoculari, cromoni intraoculari, salina
CONSIDERARE L’IMMUNOTERAPIA SPECIFICA
In caso di miglioramento: step-down. In caso di peggioramento: step-up.
decongestionante
o corticosteroide
orale (a breve
termine)
fallimento
consultare
il chirurgo
MALATTIE ALLERGICHE
SINTOMI INTERMITTENTI
*SPT= skin prick test
Figura 3.3 Algoritmo diagnostico della rinite allergica (ARIA, 2014).
25
“persistente” se la durata dei sintomi è >4 giorni/settimana e
>4 settimane. In termini di gravità, la rinite può essere classificata in “lieve” (sonno conservato, nessuna limitazione nelle
attività quotidiane, normale attività lavorativa o scolastica,
assenza di sintomi fastidiosi) o “moderata/grave” (presenza di
almeno una delle seguenti condizioni: alterazioni del sonno,
limitazioni delle attività quotidiane, riduzione delle prestazioni
lavorative o scolastiche, sintomi gravi) (ARIA, 2014).
La rinite allergica è più frequente in età scolare, mentre
è rara prima dei 2 anni di vita. Sebbene possa verificarsi a
qualsiasi età, l’esordio più comune è nel periodo puberale.
Insieme alla dermatite atopica, è parte della cosiddetta “marcia atopica o allergica” (ossia lo sviluppo progressivo delle
malattie allergiche durante l’infanzia, dalla dermatite atopica,
alla rinite allergica, all’asma bronchiale).
Inoltre, l’asma e la rinite sono comunemente associate
(comorbidità) e la rinite rappresenta un fattore di rischio
per l’insorgenza di asma. Tale osservazione ha suggerito il
concetto di “una via aerea, una malattia”, secondo il quale
l’asma e la rinite allergica sarebbero espressione di un’unica
malattia infiammatoria delle alte e basse vie respiratorie
(Progetto-ARIA, 2014).
La diagnosi di rinite allergica si basa innanzitutto sull’anamnesi personale che deve indagare la presenza dei sintomi
LIEVE
INTERMITTENTE
MOD/GRAVE
tipici (rinorrea acquosa, starnuti, prurito) e sull’anamnesi
familiare positiva per allergia.
Per la conferma sono disponibili diversi test diagnostici,
che includono il prick test (che è l’esame di prima scelta), il
dosaggio delle IgE allergene-specifiche nel siero e il test di
provocazione nasale specifico (utilizzato soprattutto a scopi
di ricerca e, raramente, nella pratica clinica). Le indagini di
secondo livello comprendono la citologia nasale e dell’escreato, la rinoscopia posteriore, l’endoscopia e la tomografia
computerizzata (TC) (Figura 3.3) (ARIA, 2014).
Nei pazienti con rinite persistente è necessario valutare
la possibile coesistenza di asma mediante anamnesi, esame
obiettivo e, se opportuno, spirometria con test di provocazione
bronchiale aspecifica.
Analogamente, nei pazienti asmatici si dovrebbe indagare
l’eventuale presenza di rinite tramite anamnesi ed esame
obiettivo (Progetto-ARIA, 2014).
Per quanto concerne l’approccio terapeutico, i 4 cardini
sono rappresentati da: allontanamento dell’allergene, ove
possibile; educazione del paziente, sempre indicata; farmacoterapia, che deve essere caratterizzata da efficacia, sicurezza
e facilità di somministrazione; ed immunoterapia specifica,
che è l’unica terapia in grado di modificare la storia naturale
della malattia.
LIEVE
Antistaminico orale o nasale
e/o decongestionante nasale* o
steroide nasale (o cromone)
Antistaminico orale o
nasale
e/o decongestionante
nasale*, LTRA§
MALATTIE ALLERGICHE
RIVEDERE DOPO 2-4 SETTIMANE
Migliora: ridurre e continuare
il trattamento per 1 mese
Non migliora: aumentare terapia
Steroide nasale, antistaminico o LTRA
RIVEDERE DOPO
2-4 SETTIMANE
Non migliora:
Rivedere diagnosi
Compliance?
Altre cause?
Migliora:
continuare 1
mese
Aggiunge
Aggiungere
Rinorrea
decongest.,
Aggiungere decongestionante*,
steroide
steroide orale
orale
ipratropio
Aumentare
steroide
topico
Aggiungere
antistaminico
Misure di prevenzione/allontanamento dell’allergene
Se congiuntivite aggiungere: antistaminico orale o topico o cromone topico
CONSIDERARE IMMUNOTERAPIA SPECIFICA
*Solo nei soggetti di età >12 anni.
§
LTRA (antileucotrienici)
26
PERSISTENTE
MOD/GRAVE
Figura 3.4 Trattamento della rinite allergica (Progetto-ARIA, 2014).
Non migliora:
CONSIDERARE
CHIRURGIA
La tollerabilità è stata buona per entrambi gli antistaminici
(Day et al, 1998).
Gli steroidi nasali sono i farmaci più efficaci nella rinite
allergica e agiscono efficacemente anche sull’ostruzione
nasale e sull’iposmia.
Cominciano ad agire dopo 6-12 ore, ma l’effetto è massimo in alcuni giorni. Ciò nonostante, occorre tenere presente
i possibili effetti avversi di tali farmaci sulla crescita nei
bambini, anche se alcuni studi hanno dimostrato che, alle
dosi usuali, mometasone e fluticasone non producono effetti
negativi sulla crescita (Progetto-ARIA, 2014). In ogni caso,
gli steroidi sistemici non devono essere utilizzati per lunghi
periodi di tempo per ragioni di sicurezza.
I cromoni possono essere impiegati per il trattamento
della rinite e della congiuntivite allergica, ma la loro efficacia
è modesta. L’ipratropio può essere utilizzato per trattare la
rinorrea, se questa è importante.
I decongestionanti topici possono essere utilizzati negli
adulti e nei bambini sopra i 12 anni, ma solo per brevi periodi
di tempo, se l’ostruzione nasale è molto severa. I decongestionanti orali non devono essere impiegati nei pazienti
pediatrici (ARIA, 2014).
La terapia farmacologica delle congiuntiviti prevede l’utilizzo di antistaminici, vasocostrittori, FANS e steroidi topici,
oltre all’impiego di antistaminici orali in presenza di rinite ed
il ricorso alla immunoterapia specifica che trova indicazione
se sono presenti rinite e/o asma (ARIA, 2014).
L’immunoterapia specifica è efficace se correttamente
prescritta e somministrata. Di solito, non è raccomandata
nei bambini al di sotto dei 5 anni, a meno che non vi siano
indicazioni specifiche.
L’immunoterapia specifica è tuttavia l’unico trattamento
potenzialmente in grado di modificare il corso naturale della
malattia e può prevenire l’insorgenza di asma (Progetto-ARIA,
2014).
Bibliografia
•Allergic Rhinitis and its Impact on Asthma (ARIA). Progetto mondiale
ARIA 2014. Linee-Guida Italiane. Modena, Marzo 2014. www.progettoaria.it/materiale/2014/ARIA-LIBRA-2014-final.pdf
•Day JH, Briscoe M, Widlitz MD. Cetirizine, loratadine, or placebo in
subjects with seasonal allergic rhinitis: effects after controlled ragweed
pollen challenge in an environmental exposure unit. J Allergy Clin
Immunol 1998; 101(5):638-45.
•Progetto ARIA - Gestione della rinite allergica e del suo impatto
sull’asma. Guida Tascabile 2014. www.progetto-aria.it/materiale/
guida_tascabile.pdf.
MALATTIE ALLERGICHE
Come per l’asma, anche la strategia terapeutica per la
rinite allergica prevede un approccio “a gradini o step” in
base alla durata e alla gravità della malattia (Figura 3.4)
(Progetto-ARIA, 2014).
In generale, i principi di trattamento sono gli stessi nei
bambini e negli adulti, ma occorre una particolare attenzione
per evitare l’insorgenza di effetti collaterali nei pazienti in età
pediatrica.
Le dosi dei farmaci devono essere adattate e devono
essere rispettate le speciali avvertenze. Tuttavia, pochissimi
farmaci sono testati clinicamente nei bambini al di sotto dei
2 anni di età. Inoltre, è importante ricordare che nei bambini
la rinite allergica può alterare le funzioni cognitive riducendo il rendimento scolastico, che può essere ulteriormente
peggiorato dall’uso di antistaminici orali con effetto sedativo
(Progetto-ARIA, 2014).
Gli antistaminici orali o topici di seconda generazione
(cetirizina, levocetirizina, loratadina, desloratadina e fexofenadina) sono raccomandati per il trattamento della rinite e della
congiuntivite negli adulti e nei bambini, e sono efficaci sui
sintomi mediati dall’istamina quali rinorrea, starnuti e prurito.
Inoltre, hanno meno effetti sedativi rispetto agli antistaminici di prima generazione; in particolare, studi clinici hanno
mostrato che la cetirizina al dosaggio raccomandato ha effetti
indesiderati minori a livello del SNC in termini di sonnolenza,
affaticamento, capogiri e cefalea.
Cetirizina si è dimostrata efficace nel trattamento di rinite
allergica stagionale e perenne, in adulti e bambini con rinite
allergica stagionale (SAR) e rinite allergica persistente/perenne (PAR). Ad esempio, per quanto riguarda la SAR, uno
studio randomizzato, in doppio cieco, a gruppi paralleli ha
confrontato cetirizina vs un altro antistaminico (loratadina)
o placebo, in monosomministrazione giornaliera, nel trattamento di pazienti adolescenti e adulti. I pazienti sono stati
esposti al polline allergizzante per 2 giorni consecutivi e successivamente trattati con cetirizina 10 mg (n=67), loratadina
10 mg (n=67) o placebo (n=68). Cetirizina è stata più efficace
rispetto a loratadina e placebo per quanto riguarda i due principali endpoint di efficacia dello studio, ossia la variazione
rispetto al basale del MSC (punteggi individuali compositi dei
principali sintomi) e la variazione rispetto al basale del TSC
(punteggio totale dei sintomi) dopo esposizione naturale al
polline. Per entrambi gli endpoint di efficacia, la differenza a
favore di cetirizina vs loratadina e placebo è stata significativa
(p≤0.01). La rapidità di insorgenza dell’azione sui sintomi è
stata migliore per cetirizina vs loratadina (2 ore vs 3 ore).
27
MALATTIE NEUROLOGICHE
L’emicrania, una condizione dai molteplici
aspetti clinici: approccio razionale
al trattamento sintomatologico
28
L’emicrania è una cefalea primaria caratterizzata da attacchi
ricorrenti di cefalea di tipo pulsante a localizzazione generalmente unilaterale, di intensità moderata o forte, aggravata dai
movimenti e associata a nausea, vomito, fonofobia e/o fotofobia. La durata di un attacco può variare dalle 4 alle 72 ore.
L’attuale classificazione dell’International Headache
Society (IHS), l’International Classification of Headache
Disorders (ICHD-II, 2004) (Olesen J, 2005) elenca diversi
tipi e sottotipi di emicrania. In generale, esistono due forme
principali di emicrania: l’emicrania senza aura e l’emicrania
con aura, che si distinguono in base all’assenza o alla presenza di particolari sintomi neurologici transitori e reversibili
che precedono la fase dolorosa, definiti nel loro complesso
aura emicranica (Figura 4.1).
L’emicrania è una delle malattie neurologiche più comuni
e invalidanti, e ha un notevole impatto sulla vita familiare, sociale e lavorativa dei pazienti, soprattutto quando gli attacchi
sono molto frequenti o addirittura quotidiani.
In Europa, la prevalenza media di emicrania nella popolazione adulta è pari al 14.7% (17% nel sesso femminile e 8%
nel sesso maschile), con un picco tra i 25 e i 55 anni, ovvero
nel periodo di maggiore produttività (Stovner LJ, Andrée C,
2010). Per la sua diffusione e il suo carattere disabilitante,
l’emicrania può essere considerata una vera e propria malattia
sociale con elevati costi economici, diretti (spese mediche,
farmaci, ricoveri) e indiretti (perdita di produttività lavorativa,
assenteismo). In Italia, i costi complessivi, sia diretti che
indiretti, dell’emicrania ammontano a circa 3,5 miliardi di
euro l’anno (Andlin-Sobocki P et al, 2005).
Se si considera che i pazienti emicranici sono costretti,
a causa degli attacchi emicranici, a limitare gli impegni lavorativi e scolastici, come pure le attività sociali e familiari,
si può facilmente comprendere come i costi indiretti (es.
perdita di produttività) siano notevolmente superiori rispetto
a quelli diretti.
A tutto ciò va aggiunto l’impatto dei cosiddetti costi
intangibili, che non possono essere misurati direttamente
(come il dolore, l’ansia, ecc.) e che incidono sulla qualità di
vita del paziente. Inoltre, rispetto ad altre patologie croniche,
i soggetti emicranici presentano una maggiore incidenza di
comorbidità (es. ansia e depressione), per cui consultano
più spesso il medico e richiedono un maggior numero di
esami diagnostici.
La diagnosi di emicrania è fondamentalmente clinica.
Un’anamnesi accurata è essenziale per formulare una diagnosi
corretta utilizzando i criteri diagnostici dell’IHS. In particolare,
l’anamnesi deve includere tutte le caratteristiche della cefalea,
quali frequenza e durata degli attacchi, tipo di dolore, intensità
della cefalea, ecc.
L’esame obiettivo deve servire a confermare o confutare
il sospetto diagnostico di una forma di cefalea secondaria e
dovrebbe includere la misurazione della pressione arteriosa, della frequenza cardiaca e della temperatura corporea,
oltre all’esame di alcune strutture come i seni paranasali,
le carotidi, lo scalpo, i muscoli paravertebrali cervicali e le
articolazioni temporo-mandibolari (Linee Guida SISC, 2011).
Va, inoltre, effettuato un esame neurologico completo, con
particolare attenzione alla presenza di segni di irritazione
meningea, segni neurologici focali, alterazioni del fondo
oculare e dello stato di coscienza (Linee Guida SISC, 2011).
EMICRANIA SENZA AURA
A. Almeno 5 attacchi che soddisfino i criteri B-D
B. Gli attacchi durano dalle 4 alle 72 ore (senza trattamento
o con trattamento inefficace)
C. La cefalea presenta almeno due delle seguenti
caratteristiche:
• Unilateralità
• Dolore pulsante
• Intensità media o severa
• Aggravamento indotto dallo sforzo fisico
D. La cefalea è accompagnata da almeno uno dei seguenti
sintomi:
• Nausea e/o vomito
• Foto e fonofobia
E. Non attribuibile ad altra patologia
EMICRANIA CON AURA
A. Almeno due attacchi che soddisfino i criteri B-D
B. L’aura è caratterizzata da almeno uno dei seguenti
sintomi ma non da debolezza muscolare:
• Sintomi visivi completamente reversibili rappresentati
sia da sintomi positivi (spot e linee luminose, luci
scintillanti) e/o sintomi negativi (perdita del visus)
• Sintomi sensitivi completamente reversibili
rappresentati sia da sintomi positivi (parestesie a
tipo formicolio) e/o sintomi negativi (sensazione di
intorpidimento)
• Disturbo dell’eloquio completamente reversibile
C. Almeno 2 delle seguenti caratteristiche:
• Sintomi visivi omonimi e/o sintomi sensitivi unilaterali
• Almeno un sintomo dell’aura si sviluppa
progressivamente in almeno 5 minuti e/o sintomi di
aura differenti compaiono in successione oltre i 5
minuti
• Ciascun sintomo dura almeno 5 minuti e non supera i
60 minuti
D. Cefalea che soddisfa i criteri B-D per l’emicrania senza
aura, inizia durante l’aura o entro i 60 minuti successivi
E. Non attribuibile ad altra patologia
Figura 4.1 Criteri diagnostici per l’emicrania senza aura
e per l’emicrania con aura.
Gli esami strumentali e di laboratorio non sono generalmente indicati; tuttavia, l’esecuzione di indagini mirate è
necessaria nel caso in cui l’anamnesi e/o l’esame obiettivo
pongano il sospetto di una possibile origine secondaria
della cefalea.
La terapia farmacologica dell’emicrania si basa su due cardini fondamentali: la terapia sintomatica o abortiva; e la terapia
di profilassi o preventiva. La prima ha come scopo primario
l’interruzione dell’attacco quando esso sopraggiunge, mentre
la seconda si propone di ridurre la frequenza, l’intensità e la
durata degli attacchi.
In generale, la terapia sintomatica è necessaria in tutti
i pazienti emicranici. Il suo obiettivo è quello di ridurre
l’intensità del dolore e dei sintomi associati e, se possibile,
bloccare completamente l’attacco in tempi brevi in modo da
permettere la ripresa delle attività quotidiane.
Per il trattamento sintomatico sono disponibili numerosi
presidi terapeutici sia specifici (triptani ed ergotaminici) che
non specifici (FANS/analgesici, antiemetici).
La terapia sintomatica può essere “graduale” (stepped
care) o “stratificata” (stratified care).
L’approccio graduale prevede l’utilizzo di farmaci non specifici come prima scelta e di farmaci specifici come seconda
scelta in caso di inefficacia dei primi. L’approccio stratificato si
basa sulla preliminare valutazione della gravità degli attacchi
in un dato paziente; ciò consente di scegliere, fin dall’inizio,
la terapia più adatta per il singolo attacco. Esso prevede la
somministrazione di analgesici o FANS nelle crisi medio/
lievi e di triptani in quelle medio/forti. L’approccio stratificato
permette di trattare in modo adeguato i pazienti con forme
emicraniche più gravi fin dalla prima visita, evitando “ritardi”
dovuti alla necessità di effettuare visite ripetute per valutare
l’efficacia della terapia.
Attualmente l’approccio graduale è stato abbandonato a
favore dell’approccio stratificato. Un valido ausilio per l’uso
della “terapia stratificata” nella pratica clinica è rappresentato
dal questionario MIDAS che consente una rapida valutazione
del grado di disabilità determinato dall’emicrania.
RISCHIO CUMULATIVO DI RECIDIVA NELLE 48 H
Frovatriptan vs. Rizatriptan
Rischio cumulativo di recidiva (%)
50
40
p<0.05
30
10
0
0
5
10
15
20
25
30
35
40
45
50
Tempo (ore)
80
70
*p<0.05
60
50
40
30
20
10
0
*
2-4
*
*
4-8 9-12 12-16 16-20 20-24 24-36 36-48
Tempo (ore)
Frovatriptan vs. Almotriptan
Rischio cumulativo di recidiva (%)
Rischio cumulativo di recidiva (%)
Frovatriptan vs. Zolmitriptan
50
40
p<0.05
30
20
10
0
0
10
20
30
40
50
MALATTIE NEUROLOGICHE
20
Tempo (ore)
Figura 4.2 Rischio cumulativo di recidiva negli studi di preferenza italiani tra triptani (Cortelli P et al, 2011).
29
TOLLERABILITÀ
% di attacchi di emicrania con eventi
avversi farmaco-correlati
10
Frovatriptan
Altri 3 triptani
8
5
5
0
p<0.05
MALATTIE NEUROLOGICHE
Figura 4.3 Percentuale di attacchi di emicrania con eventi
avversi farmaco-correlati (Cortelli P et al, 2011).
30
I FANS sono indicati per il trattamento degli attacchi di
intensità lieve o moderata e in caso di controindicazioni dei
triptani. In ogni caso, è importante ricordare che i FANS non
sono privi di effetti collaterali anche gravi e di controindicazioni che ne limitano l’uso in sottogruppi di pazienti. Alcuni
FANS si trovano in commercio in associazione con caffeina,
butalbital o codeina: tali associazioni sono sconsigliate per
il rischio di maggiori effetti collaterali e per l’alta probabilità
di indurre assuefazione/cronicizzazione.
Gli ergotaminici sono una classe di farmaci ormai in disuso che è stata ampiamente soppiantata dai triptani. Anche
se si tratta di farmaci ad azione antiemicranica specifica, le
caratteristiche farmacologiche, gli effetti collaterali e i potenziali rischi collegati al loro uso cronico ne sconsigliano l’uso.
Essi vanno riservati solo ai pazienti resistenti a tutti gli altri
farmaci sintomatici, che non presentano controindicazioni
note e che hanno una bassa frequenza di episodi di cefalea.
I triptani (o agonisti dei recettori per la serotonina di tipo
5-HT1B/D) costituiscono la classe più importante di farmaci
specifici per l’emicrania e sono indicati come farmaci di prima
scelta per il trattamento degli attacchi emicranici di intensità
forte o moderata.
Sono caratterizzati da un meccanismo d’azione in grado
di interferire con i meccanismi fisiopatogenetici dell’emicrania, e il loro profilo rischio/beneficio è il più favorevole tra i
sintomatici disponibili.
Tutti i triptani si sono dimostrati efficaci nel ridurre non
solo il dolore, ma anche i sintomi di accompagnamento (foto
e fonofobia, nausea e vomito) e la disabilità correlata all’attacco. L’efficacia dei triptani è stata confermata in numerosi
studi nel trattamento di più attacchi (costanza dell’effetto),
nel trattamento a lungo termine (assenza di tachifilassi) e
nel trattamento sintomatico degli attacchi correlati al ciclo
mestruale (Ferrari MD et al, 2002), (Pascual J et al, 2007).
I diversi triptani sono molto simili tra loro per efficacia e
profilo di tollerabilità.
D’altra parte, alcune differenze di tipo farmacocinetico e
la disponibilità di varie vie di somministrazione offrono la
possibilità di scegliere un prodotto rispetto ad un altro in
particolari situazioni cliniche.
Ad esempio, frovatriptan ha l’emivita più lunga (26 ore)
rispetto a tutti gli altri triptani; in virtù di ciò, può essere
considerato farmaco di prima scelta nel trattamento dei pazienti con attacchi di lunga durata (es. episodi perimestruali
di emicrania).
Questa caratteristica può inoltre spiegare la minore incidenza di recidiva osservata nei pazienti trattati con frovatriptan
rispetto ai pazienti trattati con altri triptani.
A tal proposito, gli studi di preferenza italiani (Cortelli P et
al, 2011) hanno dimostrato che l’assunzione di frovatriptan si
associa ad un rischio significativamente più basso di recidiva
rispetto a rizatriptan, zolmitriptan e almotriptan (Figura 4.2).
Inoltre, il trattamento con frovatriptan è risultato associato,
in questi studi, ad un’incidenza significativamente inferiore
di eventi avversi farmaco-correlati rispetto agli altri triptani
(Figura 4.3); in particolare, è stata riportata una minore incidenza di sintomi sia toracici (costrizione, peso retrosternale)
che sistemici (parestesie, astenia).
Bibliografia
•Stovner LJ, Andrée C. Prevalence of headache in Europe: a review for
the Eurolight project. J Headache Pain. 2010;11:289-99.
•Andlin-Sobocki P, Jönsson B, Wittchen HU, Olesen J. Cost of disorders
of the brain in Europe. Eur J Neurol. 2005;12 Suppl 1:1-27.
•Olesen J. The International Classification of Headache Disorders, 2nd
edition: application to practice. Funct Neurol 2005;20:61-8.
•Linee Guida SISC. Società Italiana per lo Studio delle Cefalee (SISC).
Linee Guida per la diagnosi e la terapia delle cefalee primarie. 2011.
•Ferrari MD, Goadsby PJ, Roon KI, Lipton RB. Triptans (serotonin,
5-HT1B/1D agonists) in migraine: detailed results and methods of a
meta-analysis of 53 trials. Cephalalgia 2002;22:633-658.
•Pascual J, Mateos V, Roig C, et al. Marketed oral triptans in the acute
treatment of migraine: a systematic review on efficacy and tolerability.
Headache 2007;47:1152-1168.
•Cortelli P, Allais G, Tullo V, Benedetto C, Zava D, Omboni S, Bussone
G. Frovatriptan versus other triptans in the acute treatment of migraine:
pooled analysis of three double-blind, randomized, cross-over,
multicenter, Italian studies. Neurol Sci 2011;32(Suppl 1):S95-S98.
I disturbi depressivi sono caratterizzati da una riduzione
persistente del tono dell’umore, associata a perdita di interesse o piacere e diminuzione dell’energia. Spesso determinano
compromissione del funzionamento sociale e della qualità
di vita del paziente, con conseguenti notevoli costi diretti e
indiretti per l’individuo e per l’intera società.
La depressione maggiore (DM) è una condizione di
comune riscontro in Medicina Generale. Di conseguenza, i
Medici di Medicina Generale (MMG) devono essere in grado
di riconoscerla e trattarla. Diversi studi hanno mostrato che
i disturbi depressivi possono essere adeguatamente gestiti
dal MMG.
Recentemente, l’Institute for Clinical Systems Improvement (ICSI) ha pubblicato le nuove Linee Guida per la
gestione della depressione dell’adulto nel setting delle cure
primarie (Mitchell J et al, 2013). Tali Linee Guida forniscono
un approccio operativo e pragmatico alla diagnosi e al trattamento dei pazienti con disturbi depressivi che afferiscono
agli ambulatori di Medicina Generale. In particolare, è stato
proposto un algoritmo diagnostico-terapeutico per assistere
il MMG nel percorso assistenziale (Figura 4.4) (Mitchell J
et al, 2013).
Secondo le Linee Guida ICSI, la depressione deve essere
sospettata nei pazienti che lamentano sintomi quali affaticamento, disturbi del sonno, disturbi cognitivi (es. perdita di
memoria, difficoltà di concentrazione), variazioni del peso
(perdita o incremento ponderale), sintomi somatici non
giustificati da condizione medica (es. dolori cronici, disturbi
gastrointestinali quali colon irritabile), visite frequenti (>5
anno), nonché nei pazienti che presentano alcuni fattori di
rischio per la DM quali storia familiare o personale di DM
e/o abuso di sostanze, perdita recente, presenza di patologie
croniche, esposizione ad eventi molto stressanti (morte di una
persona cara, divorzio), eventi traumatici (incidente stradale),
importanti cambiamenti di vita (cambiamento di lavoro, difficoltà finanziarie), violenza o abusi domestici (Figura 4.4)
(Mitchell J et al, 2013).
Se si sospetta un disturbo depressivo, le Linee Guida
ICSI consigliano di utilizzare uno strumento di screening
standardizzato per identificare i pazienti con DM. Lo strumento
più semplice è il PHQ-2 (Patient Health Questionnaire) che
include due domande specifiche sull’umore depresso e sulla
perdita di interesse o piacere (vedi Box 1a, Figura 4.4).
Se il paziente risponde affermativamente ad una delle 2
domande, si somministra il questionario PHQ-9 completo per
valutare la presenza di altri sintomi depressivi (Figura 4.5).
Il PHQ-9 è composto da 9 item che corrispondono ai sintomi della DM secondo il DSM-IV, con un punteggio totale che
può variare da 0 a 27. I punteggi compresi tra 0 e 9 indicano
la presenza di una depressione sottosoglia, mentre i punteggi
superiori a 9 indicano una depressione clinicamente rilevante.
Il livello di gravità della depressione può essere valutato
in base al punteggio ottenuto (5-9 = depressione sottosoglia;
10-14 = depressione minore/DM lieve; 15-19 = DM moderata;
≥20 = DM severa). PHQ-9 è stato validato come strumento
sia per la diagnosi che per il monitoraggio della depressione
nel setting delle cure primarie; può essere somministrato
telefonicamente come pure al letto al paziente (Mitchell J et
al, 2013).
Per la diagnosi di depressione maggiore, le Linee Guida
ICSI raccomandano di utilizzare i criteri stabiliti dal DSM-5
(Tabella 4.1). La diagnosi clinica si basa sull’anamnesi,
sulla sintomatologia, sul decorso clinico e sulla risposta
al trattamento. L’anamnesi e l’esame obiettivo sono generalmente sufficienti per escludere la presenza di patologie
che possono essere associate a depressione (es. demenza,
delirio, ipotiroidismo, morbo di Parkinson, ictus, malattie del
tessuto connettivo, ecc.). In alcuni casi, l’uso e/o l’abuso di
determinate sostanze o farmaci può spiegare la sintomatologia
depressiva.
Il MMG deve sempre valutare il rischio suicidario nel
paziente con sintomi depressivi, indagando in maniera diretta
la presenza di ideazioni suicidarie, intenzioni o piani di suicidio e precedenti tentativi. In caso di riscontro di un rischio
significativo di autolesionismo o di suicidio, è indicato l’invio
a consulenza specialistica.
Per quanto concerne il trattamento, le Linee Guida ICSI
raccomandano di adottare un modello di cura collaborativa,
con un piano terapeutico condiviso e concordato dal paziente,
che coinvolga il paziente e la sua famiglia nei processi decisionali. In questo modello di cura, il paziente viene assistito
da un’équipe che include specialisti psichiatri e psicologi,
oltre al MMG. Tale approccio si è dimostrato efficace nel
migliorare l’aderenza terapeutica, gli esiti clinici e la qualità
di vita dei pazienti.
Gli obiettivi del trattamento includono:
• remissione completa o miglioramento dei sintomi
• recupero del funzionamento psico-sociale e della qualità
di vita
• prevenzione delle ricadute e recidive.
Le principali opzioni terapeutiche consigliate nei pazienti
con DM sono la farmacoterapia, la psicoterapia o una combinazione dei due trattamenti. La scelta dell’intervento deve
essere guidata dalla gravità della malattia, dalle preferenze
del paziente, dalla probabilità di aderenza al trattamento e dal
rischio di effetti indesiderati, nonché dalla disponibilità e dal
costo dei trattamenti (Mitchell J et al, 2013).
La psicoterapia individuale o di gruppo è efficace nel
trattamento dei disturbi depressivi. Anche se una discussione
completa di questi approcci terapeutici esula dagli scopi
della presente trattazione, gli interventi di terapia cognitivo-comportamentale, interpersonale e psicodinamica si sono
dimostrati efficaci da soli o in combinazione con la terapia
farmacologica nei pazienti con DM lieve o moderata.
In particolare, la terapia cognitivo-comportamentale
(CBT), la terapia interpersonale (IPT), la psicoterapia psicodinamica a breve termine (STPP, Short-Term Psychodynamic
Psychotherapy) e il problem-solving (PST, Problem-Solving
Treatment) sono tutte opzioni di documentata efficacia. Nei
MALATTIE NEUROLOGICHE
La depressione e il suo trattamento
nella pratica della Medicina Generale
31
classi di farmaci indicate nel trattamento della depressione.
Gli antidepressivi possono essere suddivisi nelle seguenti
categorie: 1) antidepressivi triciclici (TCA), che comprendono amitriptilina, nortriptilina, protriptilina, imipramina,
desipramina, doxepina e trimipramina; 2) inibitori selettivi
della ricaptazione della serotonina (SSRI), che includono
fluoxetina, sertralina, paroxetina, fluvoxamina, citalopram ed
pazienti con depressione severa, la combinazione con la farmacoterapia è generalmente più efficace dei singoli interventi
(Mitchell J et al, 2013).
La farmacoterapia, in combinazione o meno con la psicoterapia, è il trattamento di prima scelta per la DM da moderata
a severa, mentre la DM lieve può anche essere trattata con
la sola psicoterapia. Gli antidepressivi includono diverse
1
Sospetta depressione (vedi Box 1a)
• Presentazione (in aggiunta ad evidente tristezza)
• Fattori di rischio
• Strumenti di screening
2
Diagnosticare e caratterizzare la depressione maggiore con l’intervista clinica includendo:
•Criteri DSM-5 (vedi Box 2a)
•Diagnosi alternative
•Storia della presente malattia (esordio e gravità dei sintomi, compromissione funzionale,
precedenti episodi e fattori di stress psicosociale)
4
Utilizzare un protocollo istituzionale se disponibile
per valutare e minimizzare il rischio di suicidio/
coinvolgere specialisti di salute mentale
3
SÌ Il paziente è pericoloso
per sé o per gli altri?
NO
5
Valutare la presenza di abuso di sostanze o di
comorbidità psichiatrica se sospettata
6
7
Ulteriori considerazioni (comorbidità mediche, SÌ
considerazioni culturali, popolazioni speciali)?
Individuare cause secondarie e/o adattare
un piano per le speciali popolazioni
NO
MALATTIE NEUROLOGICHE
8
32
Piano di trattamento esaustivo con processo decisionale
condiviso
• Modello di cura collaborativa
• Educare e coinvolgere il paziente
• Discutere le opzioni di trattamento: Psicoterapia, Farmacoterapia,
Medicina integrata
9
Il paziente risponde adeguatamente?
Box 1a
Screening con due domande:
Durante le ultime due settimane, è stato disturbato da:
1.Scarso interesse o piacere nel fare le cose?
2.Sentirsi giù, depresso o disperato?
Box 2a
Criteri DSM-5 per episodio depressivo maggiore:
Deve essere presente un totale di 5 sintomi per almeno
2 settimane. Uno dei sintomi deve essere umore
depresso o perdita di interesse.
1. Umore depresso
2. Marcata diminuzione di interesse o piacere per tutte,
o quasi tutte, le attività
3. Perdita di peso o aumento di peso significativo (>5%
del peso corporeo), oppure diminuzione o aumento
dell’appetito
4. Insonnia o ipersonnia
5. Agitazione o rallentamento psicomotorio
6. Affaticabilità o mancanza di energia
7. Sentimenti di autosvalutazione o di colpa eccessivi
8. Riduzione della concentrazione o indecisione
9. Pensieri ricorrenti di morte o di suicidio
SÌ
NO
10
Durata del trattamento di continuazione
e di mantenimento in base all’episodio
11
Valutare dose, durata, tipo e aderenza ai farmaci e/o
alla psicoterapia. Riconsiderare accuratezza della
diagnosi o impatto delle comorbidità
12
Considerare altre strategie:
• Augmentation
• Ospedalizzazione
• Trattamento elettroconvulsivante (TEC)
• Fototerapia
Figura 4.4 Linee Guida ICSI per la gestione della depressione dell’adulto: Algoritmo diagnostico-terapeutico (Mitchell J et al, 2013).
Durante le ultime 2 settimane, con quale frequenza è stato disturbato
da uno dei seguenti problemi?
Mai
Molti
giorni
Più della metà
dei giorni
Quasi tutti i
giorni
1. Scarso interesse o piacere nel fare le cose
0
1
2
3
2. Sentirsi giù, depresso o disperato
0
1
2
3
3. Difficoltà ad addormentarsi o mantenere il sonno, o dormire troppo
0
1
2
3
4. Sentirsi stanco o avere poca energia
0
1
2
3
5. Scarso appetito o mangiare troppo
0
1
2
3
6. Sentirsi in colpa o di essere un fallito o di aver danneggiato se
stesso o la sua famiglia
0
1
2
3
7. Difficoltà a concentrarsi sulle cose, come leggere il giornale o
guardare la televisione
0
1
2
3
8. Muoversi o parlare così lentamente tanto che anche gli altri se ne
accorgevano o, al contrario, essere così irrequieto o agitato da doversi
muovere da ogni parte molto più del solito
0
1
2
3
9. Pensare che sarebbe meglio essere morto o di farsi del male in
qualche modo
0
1
2
3
0
Codice interno
_______ + _________ + __________ + _______
= Totale __________
Se ha riscontrato la presenza di qualcuno dei problemi indicati nel presente questionario, in che misura questi problemi Le
hanno creato difficoltà nel Suo lavoro, nel prendersi cura delle cose a casa o nello stare insieme agli altri?
Nessuna
difficoltà
Qualche
difficoltà
Notevole
difficoltà
Estrema
difficoltà
Mitchell J et al, 2013
escitalopram; 3) inibitori della ricaptazione della serotonina
e della noradrenalina (SNRI), che comprendono venlafaxina,
desvenlafaxina e duloxetina; 4) inibitori delle monoamino
ossidasi (IMAO), che includono fenelzina, tranilcipromina,
isocarbossazide e selegilina; 5) altri farmaci, che includono
bupropione, nefazodone, trazodone e mirtazapina (Linee
Guida APA, 2010).
Anche se alcuni studi hanno suggerito la superiorità di
alcune categorie di farmaci rispetto ad altre, gli antidepressivi
appaiono comparabili per efficacia, sia in termini di classi
diverse che di principi attivi di una stessa classe.
Le percentuali di risposta negli studi clinici variano in
genere dal 50% al 75%, con alcuni studi che suggeriscono
una maggiore efficacia nei pazienti con sintomi depressivi
gravi rispetto a quelli con sintomi lievi o moderati (Linee
Guida APA, 2010).
L’efficacia degli SSRI è sostenuta da un gran numero di
evidenze cliniche e sperimentali. I dati degli studi clinici e
delle meta-analisi dimostrano che gli SSRI hanno un’efficacia
comparabile a quella degli altri antidepressivi. Ciò nonostante, gli SSRI sono generalmente preferiti come farmaci di prima
scelta rispetto alle altre classi per la loro maggiore tollerabilità
e sicurezza, anche in caso di sovradosaggio, per la possibilità
di monosomministrazione giornaliera con necessità minima
di titolazione e per l’ampio spettro di efficacia nel trattamento
dei disturbi depressivi.
I TCA sono efficaci nel trattamento della DM e hanno
un’efficacia comparabile a quella delle altre classi di antidepressivi, compresi SSRI, SNRI e IMAO. I TCA possono essere
particolarmente efficaci in certe popolazioni di pazienti come
quelli ospedalizzati. Questo effetto si spiega con la superiorità
dei TCA nel sottogruppo di pazienti con depressione più
grave, dal momento che tale effetto non è stato costantemente
documentato negli studi condotti su pazienti ambulatoriali con
malattia meno grave (Linee Guida APA, 2010).
Per quanto riguarda gli SNRI, alcune analisi hanno suggerito un piccolo vantaggio degli SNRI rispetto agli SSRI.
Tuttavia, altre meta-analisi hanno dimostrato un’efficacia
comparabile tra SSRI e SNRI, mentre alcuni studi hanno
documentato la superiorità di singoli farmaci.
Gli IMAO hanno un’efficacia paragonabile agli altri antidepressivi nei pazienti ambulatoriali con disturbo depressivo
maggiore.
Oggi, tuttavia, vengono impiegati esclusivamente nei
pazienti che non rispondono agli altri farmaci o in quelli con
depressione atipica, a causa del rischio di effetti indesiderati
gravi (crisi ipertensive, sindrome serotoninergica) e di interazioni farmacologiche e dietetiche.
MALATTIE NEUROLOGICHE
Figura 4.5 Patient Health Questionnaire (PHQ)-9©.
33
Gli altri farmaci antidepressivi vengono solitamente
utilizzati come seconda scelta; tra questi il bupropione può
essere una valida opzione nei pazienti che devono smettere
di fumare, dato che è approvato per questa indicazione (Linee
Guida APA, 2010).
Anche se si ritiene che gli antidepressivi abbiano un
effetto terapeutico simile, le diverse molecole differiscono
in termini di risposta terapeutica, tollerabilità e possibilità
di interazioni farmacologiche. Pertanto, la scelta iniziale del
farmaco sarà in gran parte basata su alcune caratteristiche
quali sicurezza, tollerabilità e costo del farmaco, precedente
risposta alla terapia con antidepressivi nello stesso paziente
o nei suoi familiari, schema di somministrazione, possibilità
di interazione con altri farmaci, e presenza di altre malattie
che possono interferire con il trattamento. Di conseguenza, la
presenza di condizioni mediche o psichiatriche concomitanti
può essere un fattore significativo nella scelta del farmaco
antidepressivo.
Ad esempio, i TCA sono generalmente sconsigliati nei
pazienti con patologie cardiovascolari, difetti di conduzione
cardiaca, glaucoma ad angolo chiuso, ritenzione urinaria e
ipertrofia prostatica.
Gli SSRI e gli SNRI possono essere inadeguati nei pazienti
che soffrono di disfunzione sessuale.
A causa della necessità di restrizioni dietetiche e del rischio di gravi effetti collaterali e di interazioni farmacologiche,
l’impiego degli IMAO è generalmente limitato ai pazienti che
non rispondono ad altre terapie (Mitchell J et al, 2013).
Il trattamento della DM prevede tre fasi fondamentali: la
fase acuta, la fase di continuazione e la fase di mantenimento. La fase acuta o iniziale ha una durata di 6-12 settimane
circa e si propone di ottenere la risoluzione completa della
sintomatologia, ovvero la remissione.
La fase di continuazione, che segue quella iniziale, ha
una durata di 4-9 mesi circa e ha come obiettivo principale
la prevenzione delle ricadute. In queste fasi iniziali del trat-
Tabella 4.1. Criteri diagnostici del DSM-5 per l’episodio depressivo maggiore nell’adulto.
Secondo il DSM-5, i criteri diagnostici per l’episodio depressivo maggiore sono i seguenti:
A. Cinque o più dei seguenti sintomi sono stati contemporaneamente presenti durante un periodo di 2 settimane e
rappresentano un cambiamento rispetto al precedente livello di funzionamento; almeno uno dei sintomi è costituito da
1) umore depresso o 2) perdita di interesse o piacere.
Nota: Non includere sintomi chiaramente attribuibili ad un’altra condizione medica generale.
1) Umore depresso per la maggior parte del giorno, quasi ogni giorno, come riportato dal soggetto (es., si sente triste,
vuoto) o come osservato dagli altri (es., appare lamentoso).
2) Marcata diminuzione di interesse o piacere per tutte, o quasi tutte, le attività per la maggior parte del giorno, quasi
ogni giorno (come riportato dal soggetto o come osservato dagli altri).
3) Significativa perdita di peso, senza essere a dieta, o aumento di peso (es., cambiamento superiore al 5% del peso
corporeo in un mese) oppure diminuzione o aumento dell’appetito quasi ogni giorno.
MALATTIE NEUROLOGICHE
4) Insonnia o ipersonnia quasi ogni giorno.
5) Agitazione o rallentamento psicomotorio quasi ogni giorno (osservabile dagli altri, non semplicemente sentimenti
soggettivi di essere irrequieto o rallentato).
6) Affaticabilità o mancanza di energia quasi ogni giorno.
7) Sentimenti di autosvalutazione o di colpa eccessivi o inappropriati (che possono essere deliranti), quasi ogni giorno
(non semplicemente autoaccusa o sentimenti di colpa per essere ammalato).
8) Ridotta capacità di pensare o di concentrarsi, o indecisione, quasi ogni giorno (come impressione soggettiva o
osservata dagli altri).
9) Pensieri ricorrenti di morte (non solo paura di morire), ricorrente ideazione suicidaria senza un piano specifico, o un
tentativo di suicidio, o l’ideazione di un piano specifico per commettere suicidio.
B. I sintomi non soddisfano i criteri per un episodio misto.
C. L’episodio non è attribuibile agli effetti fisiologici diretti di una sostanza o un’altra condizione medica.
Nota: Le risposte ad una perdita significativa (es. lutto, rovina finanziaria, perdite derivanti da un disastro naturale, una
grave patologia medica o disabilità) possono comprendere sentimenti di intensa tristezza, ruminazione sulla perdita,
insonnia, mancanza di appetito e perdita di peso, come riportati nel Criterio A, i quali possono ricordare un episodio
depressivo. Sebbene tali sintomi possano essere comprensibili oppure considerati appropriati alla perdita, la presenza
di un episodio depressivo maggiore in aggiunta alla normale risposta a una perdita significativa, dovrebbe essere
considerata attentamente. Questa decisione richiede inevitabilmente l’esercizio del giudizio clinico [una valutazione
clinica] basato sulla storia dell’individuo e sulle norme culturali per l’espressione del disagio nel contesto della
perdita.
D. La presenza di un episodio depressivo maggiore non è meglio spiegata da un disturbo schizoaffettivo, schizofrenia,
disturbo schizofreniforme, disturbo delirante o altro disturbo dello spettro schizofrenico oppure altri disturbi psicotici.
E. Non si sono mai verificati episodi maniacali o ipomaniacali.
34
Nota: I criteri A-C costituiscono un episodio depressivo maggiore.
Nota: Questa esclusione non si applica se gli episodi simil-maniacali o simil-ipomaniacali sono indotti da sostanze o
sono attribuibili agli effetti fisiologici di un’altra condizione medica.
Nei pazienti con 2 episodi depressivi maggiori, il trattamento farmacologico deve essere continuato per 3 anni e poi
può essere sospeso gradualmente. La terapia farmacologica
deve essere continuata a tempo indeterminato nei pazienti con
3 o più episodi di DM, oppure con 2 episodi di DM e almeno
una delle seguenti complicanze:
• esordio dopo i 60 anni
• episodi gravi o familiarità
• episodi ricorrenti rapidi.
La decisione di sospendere il trattamento deve essere
sempre effettuata valutando i possibili rischi di una recidiva.
La terapia con antidepressivi deve essere sospesa gradualmente per evitare il rischio di reazioni da sospensione.La
lentezza della sospensione è inversamente proporzionale
all’emivita plasmatica del farmaco.
La dose del farmaco deve essere ridotta gradualmente nel
corso di un periodo di diverse settimane o mesi (Mitchell J
et al, 2013).
Bibliografia
•Linee Guida APA: American Psychiatric Association (APA). Practice
guideline for the treatment of patients with major depressive disorder.
3rd ed. Arlington (VA): American Psychiatric Association (APA); 2010.
Disponibile all’indirizzo: http://psychiatryonline.org/pb/assets/raw/
sitewide/practice_guidelines/guidelines/mdd.pdf
•Mitchell J, Trangle M, Degnan B, et al. Institute for Clinical Systems
Improvement. Adult Depression in Primary Care. Updated September
2013. Disponibile all’indirizzo: https://www.icsi.org/_asset/fnhdm3/
Depr-Interactive0512b.pdf
MALATTIE NEUROLOGICHE
tamento, la remissione può essere solo parziale; in tal caso,
è necessario rivedere la gestione terapeutica con particolare
riferimento all’aderenza al trattamento prescritto (tempi e
dosi) e al raggiungimento della dose massima del farmaco.
In caso di mancata risposta al trattamento, sono consigliate le seguenti strategie:
• sostituzione del farmaco utilizzato con un altro antidepressivo (switching)
• aggiunta di un altro farmaco antidepressivo
• augmentation (aggiunta all’antidepressivo di un farmaco
non antidepressivo come il litio)
• aggiunta della psicoterapia
• invio a consulenza specialistica (terapia con IMAO, terapia
elettroconvulsiva).
Nei pazienti con mancata risposta o con risposta solo
parziale, è necessario verificare l’idoneità del trattamento in
termini di dosaggio e/o aderenza, prima di procedere ad una
modifica della terapia.
L’importanza del corretto dosaggio è evidenziata, ad
esempio, dai risultati di uno studio controllato che ha dimostrato che l’aumento della dose di fluoxetina (da 20 mg a 40
o 60 mg) in pazienti con risposta parziale è stato più efficace
dell’aggiunta di desipramina (25-50 mg/die) o di litio (300600 mg/die) (Mitchell J et al, 2013).
Una volta raggiunta la remissione, la fase di mantenimento
si propone di prevenire le recidive. Ha una durata variabile,
in rapporto alla storia clinica, al numero e alla gravità degli
episodi, nonché alla risposta clinica ottenuta nell’ultimo
episodio.
35
RESPONSABILITÀ LEGALE
Tipi di responsabilità:
penale, civile, disciplinare
36
Nell’esercizio della sua professione il Medico può incorrere in varie fattispecie di responsabilità penale, civile e
disciplinare. La responsabilità penale si concretizza in tutti
i casi in cui venga compiuto un reato previsto dal Codice
Penale o da altra legge dello Stato.
I reati possono essere classificati secondo tre diversi
criteri: l’intenzione, l’azione e la procedibilità. La classificazione “per intenzione” suddivide i reati in: dolosi, ovvero
commessi secondo l’intenzione; preterintenzionali, anche
detti oltre l’intenzione; colposi, ovvero non voluti o contro
l’intenzione dell’agente.
Questi ultimi rappresentano indubbiamente la categoria
di reati più frequentemente contestati in ambito sanitario e
trovano la propria origine nel comportamento negligente,
imprudente o imperito del professionista (colpa generica)
(Tabella 5.1) ovvero nella inosservanza di leggi, regolamenti, ordini o discipline (colpa specifica).
La classificazione “per azione” suddivide poi i reati in
commissivi ed omissivi. Si parla di reato commissivo quando
questo consiste nel compimento di un’azione prevista dalla
legge come reato, mentre l’omissione si concretizza nella
mancata esecuzione di un atto dovuto. Infine, la classificazione
“per procedibilità” suddivide i reati in procedibili d’ufficio e
procedibili a querela della persona offesa.
Nel primo caso, si tratta di avvenimenti di gravità tale
da richiedere che l’Autorità giudiziaria venga informata del
fatto indipendentemente dalla volontà della vittima del reato,
mentre nel secondo caso questo avviene esclusivamente se la
persona offesa procede a querela, avviando pertanto un’azione
penale nei confronti dell’autore del reato.
In materia di procedibilità d’ufficio, è opportuno ricordare
che il Medico di Medicina Generale (MMG) e il Pediatra di
Libera Scelta, in quanto incaricati di pubblico servizio, sottostanno all’obbligo di denuncia di un reato di cui abbiano
avuto notizia nell’esercizio o a causa delle loro funzioni, a
meno che il delitto in oggetto non sia punibile a querela della
persona offesa (art. 362 c.p.).
In materia di responsabilità civile, la conseguenza giuridica di un comportamento illecito si traduce nell’obbligo di
risarcire i danni derivanti da tale condotta. Essi comprendono
sia la perdita economica patita dal paziente (perdita o riduzione della capacità di guadagno, c.d. lucro cessante e le spese
sostenute, c.d. danno emergente), sia il risarcimento per la
riduzione dell’integrità psicofisica (c.d. danno biologico), sia
per le sofferenze patite sul piano morale e infine per la lesione
dei diritti di terzi (congiunti) costituzionalmente garantiti
(Cassazione Civile Sez. unite sentenza 11-11-2008 n. 26972).
Nell’ambito del diritto civile, la responsabilità può essere distinta in responsabilità contrattuale e responsabilità
extracontrattuale.
La responsabilità contrattuale è conseguente al mancato
adempimento di un’obbligazione assunta nei confronti del
creditore (paziente), e presuppone l’esistenza di patti sanciti
da un contratto e violati per l’inadempimento del rapporto spe-
cifico nato dall’obbligazione (art. 1218 c.c.). La responsabilità
extracontrattuale o aquiliana deriva, genericamente, dall’aver
cagionato ad altri un danno ingiusto, più specificatamente
quando il danno sia originato da un comportamento colposo
tenuto dal sanitario (art. 2043 c.c.).
La distinzione tra responsabilità contrattuale ed extracontrattuale ha importanza anche in relazione al c.d. onere della
prova. Nella responsabilità contrattuale l’onere della prova
grava sul debitore (il Medico), che deve dimostrare di avere
fatto tutto ciò che poteva e doveva per evitare il danno. Nella
responsabilità extracontrattuale l’onere della prova ricade sul
danneggiato che deve perciò dimostrare il fondamento della
propria pretesa.
Un’ulteriore differenza tra responsabilità contrattuale ed
extracontrattuale riguarda i termini di prescrizione del diritto
al risarcimento del danno, che sono di 10 anni nel caso della
responsabilità contrattuale e di 5 anni per la responsabilità
extracontrattuale.
La responsabilità disciplinare deriva dalla inosservanza
dei doveri di ufficio o di servizio propri del medico dipendente di enti pubblici o privati. Tale responsabilità è regolata
da disposizioni e norme speciali, la cui violazione comporta
sanzioni di carattere amministrativo.
Tabella 5.1 Elementi costitutivi della colpa generica.
NEGLIGENZA
Si concretizza nei casi in cui vengono trascurate le comuni
regole di diligenza richieste nello svolgimento della
professione. È tra tutte la condotta meno scusabile, in
quanto l’attenzione posta dal sanitario nello svolgimento dei
propri compiti deve essere sempre tale da evitare di causare
danno all’assistito.
IMPRUDENZA
Si parla di imprudenza nei casi in cui il sanitario agisce con
avventatezza o eccessiva precipitazione, senza adottare le
cautele consigliate dalla ordinaria prudenza. È imprudente il
sanitario che non si attiene alle regole dell’arte dell’eseguire
il proprio intervento e che non tiene in adeguata
considerazione le possibili conseguenze del proprio operato.
IMPERIZIA
L’imperizia presenta un carattere strettamente tecnico e
consegue alla mancanza di nozioni scientifiche o pratiche
ovvero alla insufficiente esperienza professionale. Viene
considerato imperito il sanitario che non è in grado di
fare quello che altri colleghi di pari livello professionale
avrebbero saputo svolgere.
Per il MMG è previsto un sistema sanzionatorio dei
comportamenti scorretti e degli inadempimenti degli obblighi
convenzionali di cui potrebbe rendersi responsabile nello
svolgimento della sua attività.
Le norme per valutare le violazioni contrattuali del MMG
sono fissate dall’art. 30 dell’Accordo Collettivo Nazionale.
A tale proposito, la Giurisprudenza ha puntualizzato che al
MMG non può essere revocata la convenzione se non per
gravi e accertati motivi.
Un ulteriore tipo di responsabilità disciplinare è quella
deontologica, che riguarda tutti i Medici iscritti all’Albo professionale, i quali sono tenuti ad agire rispettando le norme
stabilite dal Codice di Deontologia Medica.
In caso di violazione alle norme del Codice, la sanzione
disciplinare viene applicata dal Consiglio dell’Ordine Provinciale d’iscrizione del Medico e prevede diversi gradi, a
seconda della gravità del fatto contestato: avvertimento,
censura, sospensione e radiazione dall’Albo.
Presupposti della responsabilità professionale sono
ovviamente la prova del danno e l’accertamento del nesso
di causalità fra la condotta del sanitario e l’evento dannoso.
Ne consegue che chiunque per imperizia, imprudenza,
negligenza ovvero per inosservanza di norme nello svolgimento della professione medica cagioni ad altri lesioni, danni
fisici o la morte, soggiace in sede penale a sanzioni restrittive
della libertà personale e in sede civile ad obblighi risarcitori.
Nell’ambito del diritto civile, il modello principale di riferimento per la valutazione della responsabilità professionale
è quello del rapporto contrattuale.
La norma che regolamenta la responsabilità contrattuale
è quella enunciata dall’art. 1218 c.c., secondo il quale «il
debitore che non esegue esattamente la prestazione dovuta
è tenuto al risarcimento del danno, se non prova che l’inadempimento o il ritardo è stato determinato da impossibilità
della prestazione derivante da causa a lui non imputabile». La
giurisprudenza ha affermato la sussistenza di un’obbligazione
contrattuale del Medico nei confronti del proprio assistito,
che viene descritta come obbligazione “di mezzi” e non “di
risultato,” con l’eccezione di alcuni casi specifici in cui il
risultato desiderato dal paziente può essere considerato il
vero e proprio oggetto del contratto (es. interventi di chirurgia
estetica).
L’obbligazione del sanitario consiste, quindi, nel mettere
a disposizione del proprio paziente tutti i mezzi disponibili
e conformi alla leges artis al fine di raggiungere l’obiettivo
sperato, il cui raggiungimento non può, però, essere considerato un obbligo.
Secondo tale orientamento, si è ritenuto in passato che
l’onere della prova dell’inadempimento contrattuale incombesse sul creditore (paziente), che era perciò tenuto a provare
l’inesatto adempimento del debitore (sanitario).
In seguito, la Cassazione Civile a Sezioni Unite ha stabilito, con la sentenza n. 13533/2001, che il paziente che chiama
in causa il Medico per ottenere il risarcimento di un danno
conseguente ad un inadempimento del professionista è tenuto
esclusivamente a dimostrare la fonte negoziale o legale del
suo diritto (ovvero l’esistenza di un rapporto contrattuale con
il sanitario), allegando solamente la circostanza del mancato
adempimento.
Grava invece sul Medico convenuto l’onere di provare
l’avvenuto adempimento; pertanto, il Medico deve provare
che l’adempimento è stato, diversamente da quanto lamentato,
correttamente compiuto.
Tale sentenza ha segnato un punto di svolta fondamentale nella valutazione della responsabilità civile del Medico,
affermando un principio che rappresenta in pratica una vera
e propria inversione dell’onere della prova nell’ambito del
processo civile.
In estrema sintesi, l’attuale impostazione giurisprudenziale
prevede che, in ambito di responsabilità professionale sanitaria, al creditore (paziente o suoi eredi) spetta la prova del
contratto (o del c.d. contratto “da contatto sociale”) e dell’aggravamento della condizione di salute (per l’aggravamento
della patologia preesistente, la comparsa di una nuova patologia o il decesso), oltre all’allegazione dell’inadempimento
del sanitario (ovvero la dichiarazione, non necessariamente
argomentata nel dettaglio, della circostanza in cui il sanitario
avrebbe commesso l’errore causativo del danno).
Spetta invece al debitore (il sanitario convenuto in giudizio) dimostrare che la prestazione sanitaria è stata diligentemente eseguita (o che la lamentata omissione non è stata
conseguente a negligenza ma era giustificata nell’ambito del
percorso diagnostico-terapeutico) e che gli esiti lamentati dal
paziente sono stati determinati da un evento imprevisto ed
imprevedibile oppure che, sebbene vi sia stato da parte sua un
comportamento negligente, questo non è stato responsabile
del verificarsi del danno.
L’inversione dell’onere probatorio in ambito civile rende
ancora più importante il tema della corretta tenuta della documentazione sanitaria (tra cui anche la cartella clinica o il
fascicolo sanitario, in formato sia cartaceo che elettronico) che
acquisisce valore non solo per le finalità di tutela della salute
dell’assistito, ma anche in quanto insieme di informazioni
relative alle prestazioni fornite dal Medico che consentono di
ricostruire l’iter diagnostico-terapeutico effettuato.
Quanto finora illustrato non trova ovviamente applicazione
in ambito penale, dove l’intero impianto giurisprudenziale si
caratterizza per una maggiore tutela dell’imputato che viene
considerato non colpevole fino alla condanna definitiva
(principio della “presunzione di innocenza”). L’onere della
dimostrazione della colpa è in questo caso in capo all’accusa.
La sussistenza del nesso di causalità tra il comportamento
astrattamente idoneo a provocare il danno e il danno stesso è
la condizione necessaria per l’individuazione della responsa-
RESPONSABILITÀ LEGALE
La colpa e l’errore medico:
onere della prova e nesso di causalità
37
RESPONSABILITÀ LEGALE
38
bilità in ambito sia civile che penale e il conseguente obbligo
al risarcimento. In penale, la valutazione del nesso di causalità
si basa principalmente sulla previsione dell’articolo 40 c.p.
secondo cui «nessuno può essere punito per un fatto preveduto dalla legge come reato, se l’evento dannoso o pericoloso,
da cui dipende l’esistenza del reato, non è conseguenza della
sua azione od omissione».
Per la valutazione delle eventuali concause, il riferimento
è quello dell’articolo 41 c.p. che afferma che i fattori causali
concorrenti, siano essi preesistenti, simultanei o sopravvenuti, non escludono il rapporto di causalità tra condotta ed
evento, anche se sono indipendenti dalla condotta, mentre i
fattori causali sopravvenuti escludono il rapporto di causalità
se da soli sono stati sufficienti a determinare l’evento. Da ciò
si evince che è causa penalmente rilevante qualsiasi condotta
(commissiva o omissiva) che si pone come condizione necessaria affinché si verifichi l’evento dannoso (principio della
“conditio sine qua non”) e senza la quale tale evento non si
sarebbe verificato.
La verifica della causalità avviene infatti tramite il cosiddetto “giudizio controfattuale”, procedimento mentale attraverso il quale si elimina ipoteticamente la condotta ritenuta
responsabile del danno e ci si chiede se, in queste nuove
condizioni, il fatto dannoso si sarebbe comunque verificato.
Va da sé che tale procedimento, seppur teoricamente ineccepibile, trova una evidente limitazione nella reale possibilità di
ricostruire con elevata verosimiglianza un diverso andamento
degli eventi, in ragione della complessità e pluralità di ipotesi
che ciascun caso oggetto di giudizio consente di sviluppare.
L’attuale orientamento, ampiamente condiviso in ambito penale, relativo alla valutazione del nesso di causa ed
all’accertamento della responsabilità è stato sancito in tempi
relativamente recenti dalla Corte di Cassazione con sentenza
30328/2002 (cosiddetta sentenza Franzese).
Con tale pronuncia, i giudici di legittimità hanno innanzitutto chiarito i principi su cui si basa la regola della
“sussunzione sotto leggi scientifiche”, criterio secondo il
quale il giudizio controfattuale può essere considerato valido
solamente nei casi in cui è noto con certezza che una determinata condotta è in grado (o non è in grado) di provocare un
determinato risultato. Tale certezza non può che derivare dalla
comune esperienza ovvero da un modello scientifico generale
che fornisca l’insieme di regole alla cui luce reinterpretare i
fatti che caratterizzano l’evento.
Più semplicemente, un evento può essere considerato
condizione necessaria al verificarsi del danno solamente se
questo rientra nel novero degli effetti che possono essere
considerati una normale conseguenza dell’evento stesso sulla
base di regole di esperienza o di provata validità scientifica
(c.d. criterio di “probabilità logica”).
In ambito di responsabilità civile, la valutazione del nesso
causale segue principi differenti, benché molti criteri siano
mutuati dalla giurisprudenza e dottrina penale, quali il ricorso
a criteri di probabilità scientifica ovvero, qualora questi non
siano applicabili, a criteri di logica. Pertanto, anche in ambito
civile è fondamentale procedere all’accertamento di un duplice
nesso di causa, ovvero quello tra la condotta illecita e la lesione (causalità materiale) e quello tra la lesione e il danno che
ne è derivato (causalità giuridica). Tuttavia, un significativo
scostamento dalla impostazione adottata dalla giurisprudenza
e dalla dottrina penale è stato chiaramente evidenziato dalla
sentenza della Cassazione Civile n. 581/2008 nella quale si
è affermato che, ai fini del risarcimento del danno, il nesso
causale tra la condotta e l’evento deve ritenersi sussistente
ogni volta che, in base alle leggi scientifiche ed alle specifiche circostanze del caso in esame, si può affermare che una
diversa condotta del sanitario avrebbe impedito il verificarsi
del danno con una probabilità superiore al 50% (“più probabile che non”). Va notato che la probabilità del 50% non
deve essere considerata una soglia di probabilità fissa, in
quanto l’analisi del nesso deve essere effettuata anche sulla
base delle specifiche circostanze dell’evento.
In sintesi, in materia civile, vige la regola della preponderanza dell’evidenza o del “più probabile che non,” mentre nel
processo penale vige la regola della prova “oltre il ragionevole
dubbio.”
Problematiche connesse alla sostituibilità
dei farmaci: farmaci LASA, “biocreep”,
“zapping brand-generico e generico-generico”,
intolleranza agli eccipienti
I farmaci generici rappresentano certamente un’opportunità di risparmio per il Servizio Sanitario Nazionale, se
rispondono a criteri di efficacia e tollerabilità paragonabili
a quelli dei farmaci originali. Tuttavia, la bioequivalenza tra
il prodotto di riferimento e il generico non garantisce automaticamente l’equivalenza terapeutica, soprattutto nel caso
di alcune sottopopolazioni di pazienti e per certe categorie
di farmaci.
La sostituibilità tra brand e generico deve essere quindi
attentamente valutata dal Medico che dovrebbe monitorare
gli effetti del nuovo trattamento, in particolare nei pazienti
anziani, fragili o politrattati che sono maggiormente esposti
al rischio di eventi avversi.
Gli eccipienti utilizzati nelle formulazioni generiche
possono essere diversi rispetto al prodotto di riferimento,
in quanto non vi è alcun obbligo di legge che ne imponga
l’uguaglianza. Questo fatto può comportare non solo un problema in termini di differenze nel rilascio del principio attivo
(e nel profilo farmacocinetico), ma anche in termini di effetti
indesiderati quali reazioni di tipo allergico o di intolleranza. In
con lo stesso prodotto di riferimento, siano per proprietà
transitiva bioequivalenti tra di loro. Ad esempio, supponendo
che un generico abbia una biodisponibilità (AUC)+15% ed
un secondo generico una biodisponibilità -15%, entrambi
sono bioequivalenti rispetto allo standard di riferimento, ma
non sono tra loro bioequivalenti in quanto la differenza tra di
loro è superiore al 20%. Pertanto, la sostituibilità dovrebbe
avvenire solo tra il farmaco “brand” e un generico e non
tra due generici. Infatti, lo switch da un generico all’altro,
soprattutto nel caso di generici con una biodisponibilità ai
limiti del range tra -20% e +20% rispetto al prodotto originale, può comportare notevoli rischi in termini di tollerabilità,
soprattutto nel caso di farmaci con indice terapeutico ristretto
(Dong-Seok Yim, 2009).
La sostituzione tra un generico e l’altro dovrebbe essere
quindi evitata, in quanto non vi è alcuna certezza che due
o più equivalenti dello stesso “brand ” siano tra loro bioequivalenti. In pratica, lo switch da un generico all’altro può
comportare notevoli rischi in termini di fallimento terapeutico
o di aumento dell’incidenza di effetti indesiderati, soprattutto
nel caso dei farmaci con indice terapeutico ristretto. Da evitare
in ogni caso è il cosiddetto “zapping farmaceutico”, ovvero il
continuo passaggio da “brand ” a generico e da generico ad
altro generico, soprattutto nel paziente anziano. Tale pratica,
oltre a ridurre l’aderenza terapeutica, può comportare rischi
da sovra o sottodosaggio.
A tale proposito, è opportuno ricordare che, dal punto
di vista giuridico, la responsabilità di eventuali effetti avversi conseguenti alla sostituzione di un medicinale ricade
sempre sul Medico prescrittore, anche se la sostituzione del
medicinale è stata effettuata dal Farmacista ad insaputa dello
stesso Medico. Pertanto, il MMG dovrebbe apporre sulla
ricetta la dicitura “non sostituibile” quando ritiene che, per
varie ragioni, la sostituzione del medicinale prescritto possa
recare danni al paziente.
Responsabilità prescrittiva del Medico:
definizione e possibili conseguenze
degli eventi indesiderati
I profili di responsabilità connessi alla prescrizione
farmacologica sono molteplici, sia in ambito penale che in
ambito civile.
Per quanto concerne il penale, si ricordano in particolare
le ipotesi di reato per falsità ideologica e omissione o rifiuto
di atti d’ufficio da parte del Medico convenzionato con il
SSN che esplica la sua attività nell’ambito della convenzione
e riveste pertanto, nella sua attività certificativa, il ruolo di
pubblico ufficiale.
Al di là di tali ipotesi di reato, il Medico può essere
chiamato a rispondere in sede penale per qualsiasi ipotesi di
responsabilità colposa connessa alla prescrizione farmacologica (es. morte per shock anafilattico di un paziente al quale
era stato somministrato un antibiotico a cui era allergico,
senza che il Medico avesse accertato eventuali allergie allo
stesso farmaco).
In ambito civile, i possibili profili di responsabilità del
Medico a seguito della prescrizione farmacologica sono
molteplici, potendosi riferire a qualsiasi danno conseguente
ad una prescrizione (o mancata prescrizione) effettuata dal
Medico. Un aspetto peculiare di responsabilità professionale
in ambito civile, ma che presenta anche notevoli implicazioni
etiche, è quello relativo all’acquisizione del consenso informato del paziente alla terapia proposta.
A tale proposito, il Codice di Deontologia Medica ricorda
che «il medico non deve intraprendere attività diagnostica
e/o terapeutica senza l’acquisizione del consenso esplicito e
informato del paziente» (art. 35).
RESPONSABILITÀ LEGALE
particolare, occorre prestare particolare attenzione ad alcune
categorie di pazienti come i soggetti intolleranti al lattosio, i
celiaci, i diabetici ed i soggetti allergici.
Ad esempio, un farmaco generico potrebbe contenere
come eccipiente il saccarosio o altri zuccheri potenzialmente
pericolosi per un paziente diabetico, a differenza della formulazione originale che è priva di questi ingredienti. Anche
altri dolcificanti possono essere controindicati: ad esempio,
la saccarina può indurre allergia crociata con i sulfamidici,
mentre l’aspartame è controindicato nei soggetti affetti da
fenilchetonuria. L’amido di grano, un eccipiente spesso utilizzato in compresse e capsule, è controindicato nei soggetti
celiaci. Vi è infine il rischio di reazioni allergiche anche gravi,
non sospettabili con il farmaco originale (Dueñas-Laita A, et
al, 2009).
Una problematica strettamente correlata a quella dell’aderenza terapeutica riguarda i cosiddetti farmaci LASA, acronimo
di “Look-Alike/Sound-Alike”. Per LASA si intendono quei
medicinali che possono essere scambiati per altri a causa
della somiglianza grafica della confezione (Look Alike, LA)
e/o fonetica del nome (Sound Alike, SA).
Come è noto, le possibilità di errore aumentano in modo
direttamente proporzionale al numero di farmaci assunti e
all’età dei pazienti. Tali errori possono derivare dalla sostituzione di un farmaco “brand” nei confronti del quale il
paziente ha una certa familiarità con un prodotto di diverso
nome e con differenti caratteristiche fisiche (es. colore, forma,
dimensioni).
Un altro problema, che riguarda la sostituibilità tra due o
più generici dello stesso prodotto originale, è rappresentato
dal cosiddetto fenomeno del “biocreep”. Tale fenomeno è
dovuto al fatto che gli studi di bioequivalenza prevedono un
confronto tra un singolo generico e il suo corrispondente prodotto originale, ma non confrontano tra loro i diversi generici.
Di conseguenza, in assenza di un confronto diretto, è errato
supporre che due o più generici, ciascuno bioequivalente
39
RESPONSABILITÀ LEGALE
Il problema dell’appropriatezza della prescrizione farmacologica non è però limitato agli aspetti etici del rapporto
medico-paziente. Dall’attività prescrittiva del Medico convenzionato con il SSN derivano infatti anche implicazioni in
ambito amministrativo: in particolare, l’Accordo collettivo
nazionale (D.P.R. 270/2000) afferma che il MMG ha, fra i suoi
doveri, quello di assicurare «l’appropriatezza nell’utilizzo delle
risorse messe a disposizione dall’Azienda per l’erogazione dei
livelli essenziali ed appropriati di assistenza» (art. 15-bis) e di
ricercare «la sistematica riduzione degli sprechi nell’uso delle
risorse disponibili mediante adozione di principi di qualità
e di medicina basata sulle evidenze scientifiche» (art. 31).
La normativa attualmente in vigore riconosce la sussistenza di una responsabilità amministrativo-contabile esclusivamente nei casi in cui il fatto contestato sia stato compiuto con
dolo o colpa grave ed abbia prodotto un danno finanziario
ad un ente pubblico che acquisisce, pertanto, il diritto al
risarcimento del danno. Inoltre, è importante ricordare che,
accanto agli effetti terapeutici desiderati, la somministrazione
di un farmaco può determinare una serie di effetti collaterali o
indesiderati di diversa gravità che devono essere prontamente
riconosciuti e trattati. La pericolosità o tossicità di un farmaco
è tanto maggiore quanto più ristretto è l’indice terapeutico
40
(rapporto tra dose tossica e dose efficace) (es. antiepilettici,
teofillina, warfarin, ecc.).
Gli effetti collaterali di questi farmaci sono quindi prevedibili, e possono essere evitati rispettando le indicazioni e i
dosaggi terapeutici consigliati.
Vi sono poi le reazioni avverse non prevedibili che non
dipendono direttamente dalla quantità di farmaco assunta
(dose-indipendenti), ma piuttosto dalla risposta individuale
del singolo soggetto: di questa categoria fanno parte le intolleranze e le reazioni allergiche.
Per tale motivo, prima di prescrivere o somministrare
un farmaco, il Medico dovrebbe sempre informarsi sulla
presenza di eventuali allergie o intolleranze ai farmaci. Infine,
in aggiunta alle indicazioni sul regime posologico, il Medico
dovrebbe informare adeguatamente il paziente sugli eventuali
effetti indesiderati che si potrebbero presentare durante il
trattamento.
Bibliografia
•Dueñas-Laita A, Pineda F, Armentia A. Hypersensitivity to generic
drugs with soybean oil. N Engl J Med. 2009; 361:1317-1318.
•Dong-Seok Yim. Simulation of the AUC changes after generic
substitution in patients. J Korean Med Sci 2009; 24:7-12.