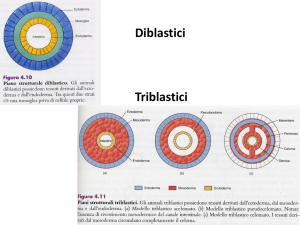
BEXAROTENE (01-04-2008)
Specialità: Targretin®(Sigmatau spa)
Forma farmaceutica:
• 100 CPS 75mg - Prezzo: euro 1638.44
ATC: L01XX25
Categoria terapeutica: Altri antineoplastici
Fascia di rimborsabilità: H OSP-2
Indicazioni ministeriali:
Trattamento delle manifestazioni cutanee nei pazienti con linfoma cutaneo a cellule T (CTCL) di grado
avanzato, refrattari ad almeno un trattamento sistemico precedente.
Decisioni PTORV
Data riunione: 01-04-2008
Decisione: Inserito con Nota
Nota Ufficiale:
La Commissione, esaminate le evidenze disponibili, stabilisce di inserire bexarotene in PTORV con
richiesta motivata per singolo paziente per il trattamento delle manifestazioni cutanee nei pazienti con
linfoma cutaneo a cellule T di grado maggiormente avanzato (stadio II B o superiori), refrattari ad
almeno un trattamento sistemico precedente.
Analisi della letteratura
Si tratta di un retinoide sintetico autorizzato con procedura centralizzata europea e commercializzato in
Italia dal 2004 per il trattamento di seconda linea del linfoma cutaneo a cellule T di stadio avanzato.
I linfomi cutanei a cellule T (CTCL) sono tumori clonali delle cellule T che si distinguono in due tipologie:
la micosi fungoide, più frequente, caratterizzata da cute epidermotrofica infiltrata di cloni di linfociti T
helper e la sindrome di Sezary in cui si evidenziano eritroderma e cellule tumorali circolanti.
L’età mediana di esordio della malattia è la metà della sesta decade di vita e si manifesta con maggior
frequenza nei soggetti di sesso maschile e in quelli di razza nera. Si tratta di un linfoma indolente: i
pazienti riferiscono per parecchi anni la presenza di lesioni cutanee eczematose e dermatitiche prima
della diagnosi. Le lesioni progrediscono dallo stadio di chiazza a quello di placca fino a quello di tumore
cutaneo [1].
La prevalenza stimata in Europa è di 16.000 casi, con 1.200 nuovi casi all’anno [2]. La malattia viene
classificata negli stadi di gravità crescente IA, IB, IIA, IIB, III, IVA e IVB; la prognosi e la sopravvivenza
risultano altamente dipendenti dallo stadio di malattia alla diagnosi. Per lo stadio IA la sopravvivenza
media è sovrapponibile a quella dei controlli di pari età, mentre quella degli stadi più avanzati diminuisce
progressivamente fino ad essere di soli 2,5 anni negli stadi IV A e B [3].
Le linee Guida
Le terapie utilizzate nei vari stadi della patologia sono molteplici. A seconda dello stadio della malattia, si
spazia da terapie topiche con steroidi e carmustina (BCNU), alla fototerapia, agli psoraleni in associazione
a radiazione UV (PUVA), all’irradiazione con fascio di elettroni TSEB (total skin electron beam), alla
somministrazione sottocutanea di interferone associato o meno a retinoidi e alla terapia citotossica
sistemica singola o di somministrazione.
La Linea Guida dell’EORTC (European Organisation for Research and Treatment of Cancer) riporta come
maggiormente appropriata negli stadi precoci la terapia topica SDT (skin directed tharapy) (PUVA, UVB,
corticosteoidi topici, radioterapia localizzata, TSEB, BCNU, mostarde azotate per uso topico). Le terapie
potenzialmente tossiche e aggressive dovrebbero essere evitate. I pazienti con mucosi fungoide in stadio
avanzato o con sindrome di Sezary presentano prognosi infausta. In questi casi l’assenza di studi
randomizzati e controllati non permette di fornire evidenze sufficienti per stabilire uno standard di terapia
univocamente riconosciuto. Le terapie raccomandate dalla linea guida per la micosi fungoide di stadio II B
sono PUVA +IFN alfa o INF alfa + retinoidi (livello evidenza B1b), mentre TSEB, irradiazioni raggi X, PUVA
+retinoidi hanno livelli di evidenza molto inferiori; tra le seconde linee vengono riportati bexarotene (liv.
B 2b), denileukin diftitox,farmaco non ancora registrato in Europa (B 1b), chemioterapia (C 4).
Nel III stadio le terapie di prima linea con maggior grado di raccomandazione sono PUVA + IFN alfa (B1
b) e IFN alfa (B 2b), mentre come seconda linea vengono riportati sempre bexarotene (B 2b) o
chemioterapia (C 4). Per gli stai IV A e IV B le terapie con maggior livello di evidenza sono considerate
Bexarotene (B2b) e denileukin diftitox (B1b), mentre alemtuzumab ((indicazione non ancora autorizzata
EMEA), chemioterapia, TSEB e/o irradiazione X, IFNalfa, basse dosi di metotrexato sono tutti a livello C
[4].
La Linea Guida della Joint British Association Dermatologists and U.K. Cutaneous Lymphoma Group per il
trattamento dei linfomi cutanei a cellule T riportano i seguenti trattamenti come prima e seconda linea
della micosi fungoide/sindrome di Sézary, suddivisi in base allo stadio della malattia. Negli stadi precoci
della malattia sono previsti principalmente trattamenti topici (SDT). Soltanto in seconda linea sono
previsti l’associazione di interferone alfa con PUVA o il TSEB (total skin electron beam).
Nello stadio IIB la prima linea è rappresentata da radioterapia o TSEB o chemioterapia, mentre la
seconda linea prevede interferone alfa o bexarotene o denileukin diftitox. Nello stadio III la prima linea
prevede PUVA interferone alfa, ECP (extracorporeal photophoresis) interferone alfa, metotrexate,
mentre la seconda linea prevede TSEB, bexarotene, denileukin diftitox, chemioterapia, alemtuzumab. Lo
stadio IV A prevede in prima linea la radioterapia o TSEB o chemioterapia e in seconda linea le terapie
con interferone alfa o denileukin diftitox o alemtuzumab o bexarotene. Lo stadio più avanzato IV B
prevede come prima linea radio o chemioterapia e come seconda linea una terapia palliativa.
Entrambi i trattamenti più innovativi Bexarotene e denileukin diftitox sono considerati come terapie
alternative dalla linea guida con un grado di evidenza A livello II (studi di coorte o caso controllo ben
disegnati, preferibilmente multicentrici) [5].
Anche le recentissime linee guida NCCN prevedono l’uso di terapie sistemiche negli stadi più avanzati
della patologia (stadio II B o superiori) o come seconda linea nei pazienti che non rispondono al
trattamento SDT. Tra le terapie sistemiche a base di retinoidi viene anche riportato l’uso del bexarotene
orale [6].
Il farmaco
Bexarotene esplica la propria azione legandosi selettivamente ai recettori X dei retinoidi (detti anche
rexinoidi) attivandoli. I recettori X costituiscono la seconda delle due famiglie di recettori per i retinoidi
attualmente conosciute. La prima di tali famiglie è quella dei RAR (recettori per l’acido retinico) che
rappresenta il sito d’azione della tretinoina. Questi recettori agiscono come fattori di trascrizione,
regolando processi di differenziazione e proliferazione cellulare, di apoptosi e sensibilizzazione
all’insulina[2].
Il farmaco viene somministrato per via orale una volta al giorno durante il pasto, poiché la sua
biodisponibilità è aumentata dalla presenza di cibo, e dopo assorbimento si lega in elevata percentuale
alle proteine plasmatiche. Viene metabolizzato principalmente dal citocromo P450 3A4 a metaboliti
inattivi ed eliminato prevalentemente per via epatobiliare. La dose giornaliera iniziale consigliata è di 300
mg/m2/die [7].
Efficacia
L’efficacia di bexarotene nel linfoma cutaneo a cellule T (CTCL) è stata testata in due studi multicentrici
non controllati. Entrambi gli studi prevedevano un gruppo di controllo storico rappresentato dai pazienti
affetti da CTCL refrattario in cui la malattia si era evoluta naturalmente [3, 8].
Gli studi hanno arruolato pazienti affetti da CTCL istologicamente confermato, refrattari o intolleranti ai
precedenti trattamenti o che avevano dovuto sospendere le terapie in atto a causa di sopravvenuti effetti
collaterali, ma a differenti stadi: il primo includeva pazienti di stadio da I a IIA, il secondo pazienti di
stadio da IIB a IVB.
La durata minima del trattamento era in entrambi gli studi di 16 settimane, ma i pazienti che ne traevano
beneficio potevano proseguire la terapia fino alla chiusura degli studi. I pazienti venivano valutati alla
seconda e quarta settimana e poi ogni quattro settimane. Come parametro primario di efficacia è stata
usata la percentuale di risposte cliniche [risposte complete (CR) + parziali (PR)] ottenute, valutate
secondo la Physician Global Assessment of Clinical Condition (PGA) e la Composite Assessment of Index
Lesion Disease (CA)1.Tra i due indici utilizzati, è stato considerato quale significativo per la
determinazione o meno della risposta quello che otteneva il punteggio più favorevole. Questo sistema
non è uno standard per la determinazione delle risposte in campo oncologico e rappresenta un limite
metodologico degli studi.
La qualità della vita è stata valutata mediante la scala di Spitzer, validata ed una scala specifica per il
CTCL, non validata.
Il primo studio ha incluso 58 pazienti, circa 90% di stadio IA (89,7%) e 10% di stadio IIA. I pazienti sono
stati inizialmente randomizzati a ricevere due diversi dosaggi di terapia, 6,5 mg/m2/die e 650 mg/m2/die,
anche se lo studio non aveva la potenza statistica per determinare una differenza tra le due dosi. Lo
studio ha subito una serie di importanti emendamenti con modifiche nei dosaggi somministrati. La
percentuale complessiva di risposta (miglioramento 50 %) secondo la PGA è stata del 20% nel gruppo
della dose di 6,5 mg/m2/die, del 54% nel gruppo della dose di 300 mg/m2/die e del 67% nel gruppo che
riceveva dosi superiori a 300 mg/m2/die (in seguito sospesa per motivi di tossicità). Le risposte complete
sono state invece il 6,7%, 7% e 27% dei pazienti rispettivamente [3].
Gli esperti dell’FDA hanno sollevato notevoli perplessità sullo studio per quanto riguarda le numerose
violazioni al protocollo e in quanto ritenevano che i pazienti inclusi non fossero rappresentativi dei malati
refrattari o intolleranti a trattamenti precedenti e che non fosse applicabile un confronto con controlli
storici. La ditta, inoltre, non ha fornito all’FDA, contrariamente a quanto preannunciato, le fotografie dei
malati, impedendo così una valutazione diretta da parte degli esperti americani [9].
Nel secondo studio sono stati trattati 94 pazienti (stadio tra IIB e IVB) anche se solo il 26% dei pazienti
presentava la malattia al IV stadio (quello a prognosi meno favorevole). Lo studio aveva previsto
inizialmente la somministrazione di una dose pari a 650 mg/m2/die, dose che è stata successivamente
ridotta per problemi di tossicità a 300 mg/m2/die. I pazienti trattati con dose iniziale superiore a 300
mg/m2/die sono poi stati analizzati separatamente. Il 45% dei pazienti trattati con dose di 300
mg/m2/die ha ottenuto una risposta (completa o parziale) e solo uno (2%) una risposta completa; i
pazienti trattati con dosaggi superiori a 300 mg/m2/die hanno presentato una percentuale di risposta
complessiva o completa rispettivamente del 55% e 13%. Non si sono osservate differenze
statisticamente significative tra i due dosaggi per quanto riguarda l’end-point primario(PEC) Il tempo
mediano di risposta è stato stimato in 180 giorni per il gruppo a dose minore e in 59 giorni per il gruppo
a dose maggiore. Il 36% ed il 38% dei pazienti che avevano risposto ai due diversi dosaggi hanno
successivamente sperimentato una recidiva. Al momento dell’interruzione dello studio, inoltre, il 67% dei
pazienti aveva sospeso lo studio [8].
Non sono disponibili studi di confronto diretto con le altre terapie; sono stati effettuati solo confronti con
controlli storici, utilizzando i risultati di studi precedentemente pubblicati su pazienti con malattia in
stadio avanzato. Nella Scientific Discussion viene riportato che tali confronti sembrano indicare una
sostanziale sovrapponibilità dell’efficacia di bexarotene rispetto a interferone ed altri retinoidi
relativamente alle risposte complessive, viceversa le risposte complete sono risultate inferiori a quelle
ottenute con gli altri trattamenti [2]
E’ di recente pubblicazione uno studio di fase II, di casistica limitata, che ha confrontato la monoterapia
con bexarotene vs l’associazione con IFN alfa 2 b. I risultati dello studio non mostrano un aumento delle
percentuali di risposta nei pazienti con l’uso dell’associazione [10]
Tollerabilità
Il 98,7% dei 152 pazienti trattati con bexarotene per CTCL sono stati soggetti ad effetti avversi, che si
sono rivelati gravi nel 29,6% dei casi. Il 15,8% dei pazienti ha sospeso il trattamento per effetti
collaterali legati al farmaco.
L’effetto collaterale principale è rappresentato dall’iperlipemia,in particolare l’ipertrigliceridemia, che si è
manifestata nel 79% dei pazienti trattati alla dose di 300 mg/m2/die. Per tale motivo, la
somministrazione di bexarotene è sconsigliata in pazienti con trigliceridemia sopra la norma ed il livello di
trigliceridi ematici deve essere monitorato settimanalmente all’inizio della terapia e successivamente con
cadenza mensile. Una eventuale iperlipemia deve essere tempestivamente trattata con adeguata terapia
farmacologica ed, eventualmente, attraverso la riduzione del dosaggio di bexarotene [2]. Negli studi
clinici, quattro pazienti hanno riportato una pancreatite acuta associata ad ipertrigliceridemia; nessun
caso di pancreatite è peraltro occorso successivamente all’istituzione di un adeguato sistema di
monitoraggio della lipemia.
Altro effetto collaterale verificatosi con elevata frequenza è l’ipotiroidismo (35% dei pazienti), con
riduzione dei livelli di tiroxina totale e di TSH. I test di funzionalità tiroidea devono pertanto essere
eseguiti all’inizio del trattamento e successivamente ripetuti con frequenza mensile.
Altri effetti collaterali che si sono manifestati sono leucopenia e anemia correlati al trattamento, ma
rapidamente reversibili con la riduzione della dose. E’ necessario eseguire la conta dei leucociti e
dosaggio dell’emoglobina settimanalmente nel corso del primo mese di terapia e mensilmente in seguito.
Tra gli altri eventi avversi frequenti sono stati segnalati dermatite esfoliativa e rash cutaneo (34%),
astenia (28%), cefalea (26%) e diarrea (12%) [2] .
In considerazione di alcuni casi di cataratta rilevati in corso di studi preclinici in ratti e cani, un
appropriato esame oculare è stato introdotto routinariamente negli studi dopo il loro inizio. Bexarotene
può accrescere l’attività ipoglicemizzante di insulina e agenti stimolanti della secrezione di insulina o
sensibilizzanti all’insulina.
La somministrazione concomitante di gemfibrozil induce aumenti nella concentrazione plasmatica di
bexarotene: il meccanismo di tale interazione non è noto.
Poiché bexarotene è in grado di indurre il citocromo P450 3A4 esso può diminuire le concentrazioni
plasmatiche delle sostanze da esso metabolizzate, riducendone l’efficacia.
Costi
Il costo annuale della terapia per un paziente adulto è di circa 25 mila euro, superiore a quello
dell’alternativa terapeutica interferone alfa 2 a che risulta essere circa 18 mila euro.
Sintesi
Bexarotene è un agonista selettivo dei 3 recettori X dei retinoidi (RXR) registrato per la terapia del
linfoma cutaneo a cellule T di grado avanzato refrattari ad almeno un trattamento sistemico precedente.
Viene somministrato per via orale e ciò costituisce un vantaggio rispetto alle terapie sistemiche
parenterali.
Nella terapia di grado avanzato è stato effettuato un unico studio non comparativo che ha incluso 94
pazienti, per lo più con patologia di stadio IIB e III. Lo studio presenta problemi metodologici, legati alla
non omogeneità delle dosi adoperate, alla mancanza di controlli paralleli e ai parametri di efficacia
soggettivi. In questo studio il 45% dei pazienti trattati alla dose di 300 mg/m2/die (dosaggio registrato)
ha ottenuto una risposta e solo il 2% una risposta completa. Un’analisi dei controlli storici condotta
dall’EMEA ha concluso per una sostanziale equivalenza o una leggera superiorità di bexarotene rispetto
alle terapie correntemente utilizzate per numero di risposte complessive, ma per una sua inferiorità in
termini di risposte complete.
Manca qualsiasi dato sulla sopravvivenza globale dei pazienti trattati, principalmente per la breve durata
dello studio. Bexarotene induce iperlipemia ed in particolare ipertrigliceridemia in un elevatissima
percentuale di pazienti e a dosi elevate ha provocato l’insorgenza di pancreatiti. Altri effetti avversi
rilevati sono stati ipotiroidismo, leucopenia, anemia, dermatite esfoliativa e rash cutaneo, astenia, cefalea
e diarrea. I livelli di lipidi ematici, di ormoni tiroidei e l’emocromo devono pertanto essere attentamente
monitorati nel corso della terapia ed eventuali alterazioni tempestivamente trattate. L’aumentata
incidenza di cataratta rilevata negli studi preclinici non è stata confermata nell’uomo a motivo dell’elevata
incidenza del fenomeno nella fascia d’età della popolazione trattata, ma è necessario un esame oculare
routinario. Ad oggi non sono disponibili studi randomizzati verso trattamenti tradizionali, né dati che
documentino un aumento della sopravvivenza. Il costo della terapia è superiore a quello dell’interferone
alfa 2A, altra alternativa terapeutica in questa tipologia di pazienti. Sono, quindi, necessari ulteriori studi
per meglio definire il ruolo del farmaco nel trattamento della patologia. Le linee guida internazionali lo
pongono come una delle possibili alternative nei pazienti non responders ai trattamenti di prima linea e
pertanto sarà necessaria una selezione dei pazienti da trattare.
Bibliografia
1. Harrison “Principi di Medicina Interna” XV edizione
2. Bexarotene
European
Public
Assesment
Report
(EPAR)
in
www.emea.eu.int/humandocs/humans/Targretin/targretin.htm
3. Duvic M. et al. Arch Dermatol 2001; 137: 581-593
4. Trautinger F. et al, Eur J Cancer 2006; 42: 1014-1030
5. Whittaker SJ et al, www.guideline.gov accesso febbraio 2008
6. Linee guida NCCN, accesso febbraio 2008
7. Targretin – Riassunto delle caratteristiche del prodotto
8. Duvic M. et al., J Clin Oncol 2001; 19: 2456-2471
9. FDA Center for Drug Evaluation and Research Clinical Team leader supplement to medical officer
review of NDA 21055 23/12/1999 accesso Marzo 2008.
10. Strauss DJ et al, Cancer 2007; 109 (9): 1799-1803
1)La PGA è una scala soggettiva e consiste nella valutazione clinica globale della malattia rispetto al baseline da parte
del medico, consta di sei gradi di valutazione, mentre la CA si basa sull’esame di un massimo di cinque lesioni indice
che vengono valutate secondo un punteggio combinato di cinque diversi parametri clinici.
Costo del trattamento:
PRINCIPIO ATTIVO
DOSAGGIO
BEXAROTENE
di 300 mg/m2/die
PRINCIPIO ATTIVO
DOSAGGIO
18 MU die / 3
INTERFERONE ALFA
volte settimana
2A
dopo titolazione di
12 settimane
COSTO* ANNUO
ALL’OSPEDALE
25.371 € range
14.498-36.244 €
*costo calcolato su un paziente di 1.8 m2
di superficie corporea, range da 0.88 a
2.60 m2.
COSTO° ANNUO
ALL’OSPEDALE
17.835 €
°Costi forniti
Marzo 2008
dalle
Ditte
produttrici,
Data di redazione 1 Aprile 2008