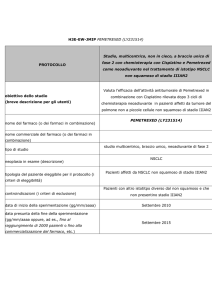
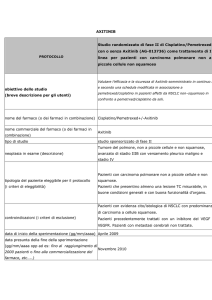
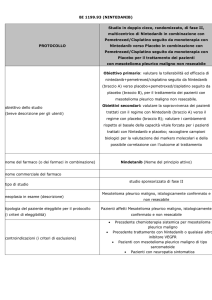
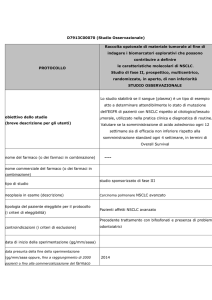
PEMETREXED per il trattamento carcinoma polmonare non a
piccole cellule. (Nuovo allargamento indicazione) (27-05-2009)
Specialità: Alimta® (Eli lilly italia spa)
Forma farmaceutica:
▪
1 fl di polvere per infusione 500 mg –
Prezzo: euro 2265.59
ATC: L01BA04
Categoria terapeutica: Analoghi dell'acido folico
Fascia di rimborsabilità: H OSP-1
Indicazioni ministeriali:
Mesotelioma Pleurico Maligno: ALIMTA in combinazione con cisplatino è indicato nel trattamento
chemioterapico di pazienti non pretrattati con mesotelioma pleurico maligno non resecabile.
Carcinoma Polmonare Non a Piccole Cellule:
®
Alimta in combinazione con cisplatino è indicato come prima linea di trattamento di pazienti con
carcinoma polmonare non a piccole cellule localmente avanzato o metastatico ad eccezione dell’istologia a
predominanza di cellule squamose.
®
Alimta è indicato in monoterapia nel trattamento di seconda linea di pazienti con carcinoma polmonare
non a piccole cellule localmente avanzato o metastatico ad eccezione dell’istologia a predominanza di
cellule squamose.
Decisioni PTORV
Data riunione: 22-02-2010
Decisione: Inserito con Nota
Nota Ufficiale:
“Nel trattamento in I linea per pazienti affetti da NSCLC ad istologia non squamosa limitatamente a 4 cicli
di trattamento”.
Commenti:
In data 27/05/2009 la Commissione aveva sospeso la valutazione in quanto aveva sollevato perplessità
relativamente all’analisi per sottogruppi ed in attesa di esaminare un'analisi farmacoeconomica, in
procinto di pubblicazione, relativa alla realtà italiana che dimostrasse un favorevole rapporto
incrementale di costo-efficacia dell’associazione pemetrexed + cisplatino vs gemcitabina+cisplatino.
Successivamente la ditta ha inviato una nota integrativa, esaminata dalla CTR nella riunione del
27/10/09, contenente un'analisi finanziaria di budget con la prospettiva della Regione Veneto ed
un'analisi farmacoeconomica con la prospettiva del SSN. Entrambe le analisi apparivano molto incerte,
nella prima il numero di tumori non squamosi riportati nell’analisi erano sottostimati e non sembravano
essere ricavati da articoli di letteratura o da registri on line disponibili anche per il Veneto, non era stato
considerato lo spreco di farmaco del pemetrexed (disponibile solo in fiale da 400 mg) e non era chiaro il
motivo per cui era stato considerato un numero di cicli di trattamento pari a 4 e non 5 come riportato
nello studio clinico registrativo.
Relativamente all'analisi farmacoeconomica, pubblicata con la prospettiva del SSN, che aveva stimato un
valore incrementale di costo efficacia per anni di vita guadagnati (LYG) pari a 34.695 €, è stata adattata
con la prospettiva della regione Veneto. Rispetto allo studio farmacoeconomico pubblicato, si sono
considerati gli stessi LYG (pemetrexed+cisplatino vs gemcitabina+cisplatino con differenza di LYG 0.12,
considerando 5 cicli di terapia), gli stessi costi calcolati per i trattamenti concomitanti, per la gestione
degli effetti collaterali, mentre sono stati fatti variare i costi di somministrazione (secondo DGR 734 del
20/03/2007) e i costi del farmaco (nello studio era stato calcolato un costo per mg per superficie
corporea, mentre è stato ricalcolato aggiungendo anche il costo dello spreco di farmaco). Sulla base di
tale analisi è risultato che l’ICER/LYG per la Regione Veneto supera i 72.000 euro.
Sulla base di questi elementi la CTR aveva ritenuto di richiedere chiarimenti dalla Ditta produttrice.
La Commissione in data 22/02/10 considerando la possibilità di minimizzare lo spreco del farmaco
pemetrexed con la commercializzazione della nuova formulazione da 100 mg, che era già stato
autorizzato in PTORV l’utilizzo del bevacizumab nella prima linea del carcinoma polmonare non a piccole
cellule avanzato o metastatico che presenta un costo annuale superiore e considerato che l'utilizzo del
pemetrexed risulta essere costo-efficace se utilizzato per un numero di cicli pari a 4, la Commissione
decide di inserire il farmaco per l’indicazione in oggetto, limitatamente al numero di cicli previsti dalla
ditta e dal NICE.
Caratteristiche del prodotto
ALIMTA (pemetrexed) è un agente antifolato antitumorale multi-target che esplica la sua azione
interferendo sui processi metabolici fondamentali folato-dipendenti essenziali per la replicazione cellulare
[1].
Studi in vitro hanno dimostrato che il pemetrexed agisce come agente antifolato multi-target inibendo la
timidilato sintetasi (TS), la diidrofolato reduttasi (DHFR) e la glicinamide-ribonucleotide-formil transferasi
(GARFT) che sono enzimi chiave folato-dipendenti per la biosintesi de novo dei nucleotidi timidina e
purina. Il pemetrexed è trasportato all’interno delle cellule sia per mezzo del carrier del folato ridotto che
dai sistemi di trasporto delle proteine di membrana leganti il folato. Una volta all’interno della cellula, il
pemetrexed è rapidamente ed efficacemente convertito alle forme poliglutammate tramite l’enzima folipoliglutammato sintetasi. Le forme poliglutammate sono trattenute nelle cellule e sono inibitori ancora
più potenti della TS e della GARFT. La poliglutammazione è un processo tempo e concentrazione
dipendente che si verifica nelle cellule tumorali e in misura minore nei tessuti normali.
I metaboliti poliglutammati hanno un’emivita intracellulare maggiore che determina un’azione prolungata
del farmaco nelle cellule maligne.
Per ridurre la tossicità, i pazienti trattati con pemetrexed devono inoltre ricevere un’integrazione
vitaminica. I pazienti devono assumere giornalmente per via orale acido folico o un prodotto
multivitaminico contenente acido folico (350-1000 mcg ). Almeno cinque dosi di acido folico devono
essere assunte nei sette giorni che precedono la prima dose di pemetrexed e l’integrazione deve
continuare durante l’intero periodo di terapia e per 21 giorni dopo l’ultima dose di pemetrexed. I pazienti
devono inoltre ricevere un’iniezione intramuscolare di vitamina B12 (1000 mcg ) nella settimana
precedente la prima dose di pemetrexed e successivamente una volta ogni tre cicli. Le successive
iniezioni di vitamina B12 possono essere somministrate lo stesso giorno di pemetrexed.
Monitoraggio:
I pazienti che ricevono pemetrexed devono essere sottoposti prima di ogni somministrazione ad un
controllo con un esame ematologico completo, comprendente la conta leucocitaria con formula (WCC) e
la conta piastrinica. Prima della somministrazione di ogni chemioterapia devono essere effettuati gli
esami chimici ematologici per valutare la funzionalità renale ed epatica. Prima di iniziare un ciclo di
chemioterapia, è necessario che i pazienti abbiano i seguenti valori: la conta totale dei neutrofili (ANC)
deve essere ≥ 1.500 cellule/mm³ e le piastrine devono essere ≥ 100.000 cellule/mm³. La clearance della
creatinina deve essere ≥ 45 ml/min.
La bilirubina totale deve essere ≤ 1,5 volte il limite superiore del valore normale. La fosfatasi alcalina
(AP), l’aspartato transaminasi (AST o SGOT) e l’alanina transaminasi (ALT o SGPT) devono essere
≤ 3 volte il limite superiore del valore normale. Fosfatasi alcalina, AST e ALT ≤ 5 volte il limite superiore
del valore normale sono accettabili se il fegato è sede di metastasi.
Inquadramento della patologia
Più di un milione di nuovi casi di tumore al polmone vengono diagnosticati in tutto il mondo ogni anno
[2]. E' il secondo più frequente tumore sia negli uomini che nelle donne. Il carcinoma polmonare non a
piccole cellule (NSCLC) rappresenta circa l'80% dei carcinomi polmonari. Le istologie più comuni sono
rappresentate da quella epidermioide o a cellule squamose (30-35%), adenocarcinoma (40-45%) e
carcinoma a grandi cellule (<10%). Nella pratica clinica, una elevata percentuale di pazienti con NSCLC
riceve la diagnosi ad uno stadio avanzato della malattia (circa il 30% in fase localmente avanzata e il
40% in fase metastatica) con il rimanente 25-30% in stadio precoce. Nonostante i recenti progressi nel
trattamento, la prognosi rimane sfavorevole. A 5 anni la percentuale di sopravvivenza dei pazienti con
NSCLC è ancora del 15%. Le stime per l’Italia indicano 30.384 nuovi casi incidenti ogni anno fra i maschi
e 6.784 fra le femmine; per quanto riguarda la mortalità, nel 2002 si sono verificati 25.639 decessi fra i
maschi e 6.495 fra le femmine. Il rischio di avere una diagnosi di tumore polmonare nel corso della vita
(fra 0 e 74 anni) è di 67,7‰ fra i maschi (1 caso ogni 15 uomini) e del 14,1‰ fra le femmine (1 caso
ogni 71 donne),mentre il rischio di morire è di 56,4‰ fra i maschi e 10,4‰ fra le femmine [3]. Esiste
una certa variabilità geografica nell’incidenza del tumore del polmone nel nostro paese con un rapporto
fra le aree con i tassi più alti e quelle con i più bassi di circa 2. In generale i tassi più elevati sono rilevati
nelle aree settentrionali e i più bassi nel Meridione. Nel corso del tempo il tumore del polmone ha
mostrato una tendenza alla riduzione sia dell’incidenza sia della mortalità nel sesso maschile, mentre è
presente una crescita costante nelle donne.
Linee guida di trattamento esistenti
Le linee guida NCCN del febbraio 2009, relativamente al trattamento sistemico del NSCLC avanzato o
metastatico, per quanto riguarda il trattamento di prima linea suggeriscono che le chemioterapie a base
di platino prolungano la sopravvivenza, migliorano i sintomi e migliorano la qualità della vita rispetto alle
cure palliative (best supportive care) [4]. In particolare l'associazione cisplatino/pemetrexed ha
dimostrato un'efficacia superiore e una minore tossicità rispetto all'associazione gemcitabina/cisplatino,
in pazienti con NSCLC ad istologia non-squamosa. I regimi a base di platino (carboplatino o
cisplatino) sono risultati efficaci in combinazione con uno dei seguenti chemioterapici: paclitaxel,
docetaxel, gemcitabina, vinorelbina, irinotecan, etoposide, vinblastina e pemetrexed. Terapie di prima
scelta vengono considerate anche l'associazione bevacizumab + chemioterapia a base di platino, per quei
pazienti con NSCLC ad istologia non squamocellulare e l'associazione cetuximab, vinorelbina e cisplatino
per i pazienti con NSCLC di stadio IIIB/IV con espressione del gene EGFR e privi di metastasi cerebrali. La
monoterapia, invece, è da riservare a pazienti con performance status 2 o anziani. Per quanto riguarda il
trattamento in seconda linea, le linee guida riportano il ricorso a pemetrexed come singolo agente per
pazienti che abbiano riportato progressione della malattia durante e successivamente al trattamento di
prima linea e con un buon performance status (compreso tra 0 e 2). Altre opzioni di trattamento in
seconda linea sono il docetaxel, gli inibitori delle tirosin chinasi e l'erlotinib, da utilizzarsi sempre in
monoterapia. Secondo le linee guida, pemetrexed in seconda linea ha dimostrato di essere equivalente a
docetaxel con un migliore profilo di sicurezza.
Le recenti linee guida dell'ESMO, raccomandano nel trattamento di prima linea del NSCLC di stadio IV,
una doppia associazione a base di cisplatino combinato con un nuovo agente (vinorelbina, gemcitabina,
tassani o pemetrexed nei pazienti con carcinoma ad istologia prevalentemente non-squamosa), con un
livello di raccomandazione I, A [5].
Trattamenti alternativi
Per quanto riguarda il trattamento di prima linea del NSCLC avanzato o metastatico le alternative
terapeutiche sono:
associazione di cisplatino o carboplatino con: gemcitabina, paclitaxel, vinorelbina, docetaxel,
etoposide, irinotecan e vinblastina (pazienti con performance status 0-1);
bevacizumab e chemioterapia a base di platino (pazienti con performance status 0-1);
associazione di cetuximab/vinorelbina/cisplatino (pazienti con performance status 0-1 o 2).
cure palliative ("best supportive care" per pazienti con performance status 3-4).
Per quanto riguarda il trattamento di prima seconda a del NSCLC avanzato o metastatico le alternative
terapeutiche sono:
docetaxel o erlotinib (pazienti con performance status 0-2);
cure palliative ("best supportive care" per pazienti con performance status 3-4).
Dati di efficacia
L'estensione di indicazione di pemetrexed, per il trattamento di prima linea del NSCLC in associazione a
cisplatino, è supportata principalmente da uno studio pilota di fase III [6] e da due studi di supporto
entrambi di fase II [7,8]. Lo studio principale ha arruolato 1725 pazienti adulti (età media di 61 anni),
con NSCLC avanzato o metastatico, mai precedentemente trattati con chemioterapia e con buon
performance status [6]. Lo studio intendeva valutare l'efficacia e la sicurezza del regime di combinazione
di pemetrexed e cisplatino rispetto al regime di gemcitabina e cisplatino nella terapia di prima linea del
NSCLC. I pazienti sono stati randomizzati a ricevere cisplatino 75mg/m2 nel giorno 1 più gemcitabina
1,250 mg/m2 al giorno 1 e 8 o cisplatino allo stesso dosaggio più pemetrexed 500 mg/m2 al giorno 1, in
cicli di 21 giorni. Il numero massimo di cicli è stato di 6, con una media di 5 cicli per paziente. I pazienti
di entrambi i bracci di trattamento hanno ricevuto una profilassi con 4 mg di destrametasone orale, 2
volte al giorno, dal giorno precedente all'inizio di ogni ciclo di trattamento, per 3 giorni. Inoltre tutti i
pazienti sono stati trattati con acido folico e vitamina B12 durante tutto il periodo di trattamento.
L'obiettivo primario dello studio è stato quello di valutare la non inferiorità, in termini di sopravvivenza
globale, dell'associazione pemetrexed - cisplatino rispetto a gemcitabina - cisplatino. Il limite stabilito per
definire la non inferiorità prevedeva un HR di 1,176. I risultati hanno dimostrato che la sopravvivenza
globale per i pazienti del braccio pemetrexed/cisplatino è risultata non inferiore a quella dei pazienti
trattati con il comparator (OS media di 10,3 mesi per entrambi i bracci) con un HR di 0,94, IC 95%, 0,84
- 1,05 (gli intervalli di confidenza sono risultati più bassi al limite stabilito per definire la non inferiorità).
Anche il tempo alla progressione e la sopravvivenza libera da progressione hanno risposto ai criteri di non
inferiorità (vedi dettagli in tabella). L'analisi statistica prevedeva analisi per sottogruppi pianificate a priori
su diversi elementi: età, fumatori, isologie del tumore e razza. Analizzando i risultati per i sottogruppi di
pazienti si è potuto osservare che la sopravvivenza globale è stata statisticamente superiore per
cisplatino/pemetrexed vs cisplatino/gemcitabina nei pazienti con adenocarcinoma (N=847; 12,6 vs 10,2
mesi rispettivamente, p=0.03) e nei pazienti con carcinoma con istologia a grandi cellule (N=153; 10,8
vs 9,4 mesi rispettivamente, p=0.03). Nel complesso sui 1000 pazienti con istologia non squamosa, la
sopravvivenza globale è stata di 11,8 mesi per il braccio pemetrexed/cisplatino vs 10,4 mesi per il
comparator (p=0.005). Al contrario, i pazienti con carcinoma a cellule squamose hanno trovato un
beneficio maggiore con il trattamento cisplatino/gemcitabina vs cisplatino/pemetrexed (N=473; OS di
10,8 vs 9,4 mesi rispettivamente, p=0.05).
I due studi di supporto presentano un disegno simile, entrambi in aperto e non controllati, hanno
arruolato 31 e 36 pazienti con NSCLC avanzato o metastatico, chemio-naive e con performance status di
0-1 o di 0-2 [7,8]. I pazienti sono stati trattati con l'associazione di cisplatino 75 mg/m2 e pemetrexed
500 mg/m2 al giorno 1 in cicli di 21 giorni per un numero medio di cicli variabile da 4 a 6. L'obiettivo
primario di entrambi gli studi era di valutare i tassi di risposta tumorali. Entrambi gli studi hanno
dimostrato l'efficacia di questo regime terapeutico (tasso di risposta globale del 39% e del 44,8%; vedi
dettagli in tabella), confermata poi dallo studio pilota.
La variazione dell'indicazione di pemetrexed in monoterapia nel trattamento di seconda linea in pazienti
con NSCLC localmente avanzato o metastatico "ad eccezione dell'istologia a predominanza di
cellule squamose", deriva principalmente da un'analisi retrospettiva dello studio registrativo,
disponibile solo in forma di abstract e descritto in una recente revisione, che ha confrontato l'efficacia del
farmaco vs docetaxel, non pianificata nel disegno originale dello studio [8,9]. Questa analisi post-hoc
intendeva valutare l'esistenza di una correlazione tra efficacia del trattamento, in termini di
sopravvivenza globale mediana, e l'istologia predominante del tumore. Da questa analisi è risultato che i
pazienti con NSCLC ad istologia non squamosa, trattati con pemetrexed, hanno dimostrato una
sopravvivenza globale media statisticamente superiore rispetto agli altri (9,3 mesi per pemetrexed vs 8,0
mesi per docetaxel, HR 0,778: 0,607-0,997). Al contrario, i pazienti con NSCLC ad istologia squamosa
hanno tratto maggior beneficio dal trattamento con docetaxel (OS: 6,2 mesi per pemetrexed vs 7,4 mesi
per docetaxel; HR 1,563: 1,079-2,264). La mediana di sopravvivenza è stata migliore per pemetrexed
anche nell'istologia a grandi cellule (12,8 vs 4,5 mesi), istologia non (9,4 vs 7,9 mesi) e simile
nell'adenocarcinoma (9,0 vs 9,2 mesi). Tuttavia la Scientific Discussion dell'EMEA non fa riferimento a
quest'analisi retrospettiva (probabilmente perché non era stata sottomessa alla commissione),
attribuendo la modifica dell'indicazione di pemetrexed in seconda linea ai risultati ottenuti dallo studio
Scagliotti per l'indicazione in prima linea, che avevano dimostrato una maggior efficacia di pemetrexed
nelle forme tumorali ad istologia non squamosa.
Principali studi clinici
Referenza
Pazienti e trattamento
Scagliotti GV et al;
J Clin Oncol 2008;
26(21):3543-3551.
[6]
1725 pz chemio-naive, con
NSCLC di stadio IIIB o IV e PS
di 0 o 1.
- CDDP 75mg/m2 gg 1 + P
500mg/m2 gg 1 [N=862]
- CDDP 75mg/m2 gg 1 + G
1,250mg/m2 gg 1 e 8
cicli di 3 settimane
trattamento massimo di 6 cicli
(mediana
di
5
cicli
per
entrambi i gruppi).
Manegold C. et al;
Ann
Oncol
2000;
11:435-440. [8]
36 pz chemio-naive, con
NSCLC di stadio IIIB o IV e
PS<1.
- CDDP 75mg/m2 gg 1 + P
500mg/m2 gg 1, ogni 21 gg
mediana di 4 cicli/pz
Disegno/fase
RCT, di non inferiorità, in aperto /
III, analisi per sottogruppi
pianificata a priori
In aperto, non controllato / II
Misure di
esito
1° OS
2° SR a 12 e
24 mesi; PFS;
OR.
1° ORR
2° DR, TTP; ST
Risultati principali
1° Dimostrata la non inferiorità: OS 10,3
mesi per entrambi i trattamenti (HR=0.94,
IC 95%, 0.84 - 1.05).
2° SR a 12 mesi: 43,5% CDDP + P; 41,9%
CDDP + G
SR a 24 mesi: 18,9% CDDP + P; 14,0%
CDDP + G
PFS: dimostrata la non inferiorità. 4,8 mesi
CDDP + P e 5,1 mesi CDDP + G (HR=1,04;
IC 95%, 0,94 - 1,15).
Sottogruppo adenocarcinoma: (N=847; OS:
12,6 CDDP+P vs 10,9 mesi CDDP+G)
Sottogruppo a istologia a grandi cellule
(N=153; OS: 10,4 CDDP+P vs 6,7 mesi
CDDP+G).
Sottogruppo a istologia a cellule squamose:
(N=473; OS: 9,4 CDDP+P vs 10,8 mesi
CDDP+G)
1° ORR= 39% (IC 95%; 23%-57%);
SD=47%
2° DR= mediana di 10,4 mesi (IC 95%: 6,3
- 12,2 mesi)
TTP= mediana di 6,3 mesi (IC 95%: 2,914,1 mesi)
ST= mediana di 10,9 mesi (IC 95%: 6,8 16,9 mesi)
Jadad
score
3
1
31
pz
chemio-naive,
con
29 pz valutabili
NSCLC di stadio IIIB o IV e PS
Shepherd FA et al;
1°OR: 44,8% (IC 95%:26-64%)
di 0, 1 o 2.
1° ORR
Cancer 2001; 92:
In aperto, non controllato / II
2° DR: mediana di 6,1 mesi (1,6 - 7,8 mesi) 1
2
- CDDP 75mg/m gg 1 + P
2° DR; ST
595-600. [7]
ST: mediana di 8,9 mesi (range da 1-15
2
500mg/m gg 1, ogni 21 gg
mesi)
mediana di 6 cicli/pz.
PS= performance status; CDDP= cisplatino ; P= pemetrexed; G= gemcitabina; OS=overall survival (sopravvivenza globale); SR= survival rates (tassi di sopravvivenza); PFS=
progression free survival (sopravvivenza libera da progressione); OR= overall response (risposta globale); TRR= tumor response rate (tassi di risposta tumorali); DR= durata
della risposta; TTP= time to progression (tempo alla progressione); SR= survival rate (tempo di sopravvivenza); PR= partial response (risposta parziale); SD= stable disease;
HR= hazard ratio; PS= performance status
Dati di sicurezza
La Scientific Discussion dell'EMEA riporta i dati di sicurezza emersi dallo studio clinico pilota per
l'indicazione NSCLC in prima linea, confrontando gli eventi avversi del braccio di trattamento
cisplatino/pemetrexed (C/P) rispetto a cisplatino/gemcitabina (C/G) [2]. Sono stati somministrati in totale
2648 cicli di C/P in 839 pazienti e 3626 cicli di C/G in 830 pazienti, con una mediana di 5 cicli/paziente
per entrambi i bracci di trattamento. In entrambi i gruppi di trattamento, gli eventi avversi riportati più
comunemente e che hanno causato ritardi nella somministrazione della dose di farmaco sono stati:
neutropenia (138 nel braccio CP e 188 nel braccio CG) e anemia (25 nel braccio CP e 43 nel braccio CG).
La percentuale di pazienti che hanno riportato eventi avversi correlati al trattamento è stata simile per
entrambi i bracci: 751 pazienti (89,5%) nel gruppo CP e 755 pazienti (91,0%) nel gruppo CG. Per
entrambi i bracci i più frequenti sono stati: anemia, neutropenia, nausea, vomito e fatica. Il 16,6% dei
pazienti del gruppo CP e il 16,4% del gruppo CG hanno riportato eventi avversi gravi, presumibilmente
correlati al trattamento. Da sottolineare che i pazienti del gruppo CG hanno riportato un numero
statisticamente superiore di tossicità di grado 3 e 4 negli esami di laboratorio rispetto al gruppo
sperimentale (39,9% vs 22,6%, p<0,001), soprattutto neutropenia, registrata nel 26,7% dei pazienti
trattati con CG vs 15,1% dei pazienti trattati con CG (p<0,001). Altre forme di tossicità, di grado 3 e 4,
riportate più frequentemente nel gruppo CG sono state l'anemia (9,9% vs 5,6%, p<0,001), la leucopenia
(7,6% vs 4,8%, p<0,001), la trombocitopenia (12,7% vs 4,1%, p<0,001), la neutropenia febbrile (3,7%
vs 1,3%, p=0.02), e l'alopecia (21,4% vs 11,9%, p<0.001). La nausea, invece, si è verificata più
frequentemente nel gruppo CP (7,2 vs 3,9%, p=0.004) come l'anoressia e l'insufficienza renale
(entrambe con incidenza molto bassa). Nessuna differenza di incidenza è stata riscontrata invece nei
decessi: sono stati registrati un totale di 116 decessi durante la terapia (63 nel braccio CP e 53 nel
braccio CG). L'interruzione del trattamento dovuta ad eventi avversi si è resa necessaria per 15 pazienti
del braccio CP e 23 pazienti del braccio CG.
Indicazione studi in corso
Nel registro governativo americano e nel registro dell'osservatorio dell'AIFA sulle sperimentazioni cliniche
sono presenti vari studi per pemetrexed per l'indicazione: NSLCL di stadio localmente avanzato o
metastatico, sia in prima che in seconda linea [11,12]. Da segnalare che diversi studi prevedono
l'associazione di pemetrexed con altri antitumorali di recente introduzione: cetuximab, bevacizumab,
bortezomib. Le sperimentazioni in corso più rilevanti sono descritte nella tabella sottostante.
Registro / Nazione
clinicaltrials.gov [11]
clinicaltrials.gov [11]
clinicaltrials.gov [11]
clinicaltrials.gov;
osservatorio
nazionale
sperimentazioni cliniche, AIFA
[11,12]
clinicaltrials.gov [11]
clinicaltrials.gov [11]
osservatorio nazionale
sperimentazioni cliniche, AIFA
[12]
Pazienti e trattamento
450 pz con NSCLC di grado IIIB/IV, già trattati
con precedente chemioterapia.
Trattamento:
- pemetrexed 500mg/m2 ogni 21 gg per 6 cicli
- erlotinib os 150mg/die fino a progressione
800 pz con NSCLC di grado IIIB/IV, già trattati
con precedente chemioterapia a base di platino.
Trattamento:
- docetaxel + cetuximab
- docetaxel
- pemetrexed + cetuximab
- pemetrexed
900 pz con NSCLC di grado IIIB/IV, mai
precedentemente trattati.
Trattamento:
- pemetrexed + bevacizumab + carboplatino
- paclitaxel + bevacizumab + carboplatino
600 pz con NSCLC avanzato o metastatico ad
istologia non squamosa
Trattamento:
terapia di induzione: cisplatino + pemetrexed
i pazienti che non hanno mostrato progressione
dopo 4 cicli di trattamento randomizzati 2:1 a
ricevere:
-pemetrexed + "best supportive care"
-placebo + "best supportive care"
260 pz con NSCLC di fase IIIB/IV mai
precedentemente trattati:
- pemetrexed + carboplatino
- docetaxel + carboplatino
1237 pz con NSCLC di fase IIIB/IV ERCC! positivi
o negativi, mai precedentemente trattati.
Trattamento:
- cisplatino + pemetrexed
- paclitaxel + pemetrexed
Pz con NSCLC in stadio localmente avanzato o
metastatico, sottoposti senza successo ad una
precedente terapia antineoplastica.
Trattamento:
- bortezomib + pemetrexed
-bortezomib
- pemetrexed
Disegno
Fase
Misure di esito
Note
RCT, in aperto, con
controllo attivo
III
End-point primario:
sopravvivenza globale (OS)
In fase di
reclutamento
RCT, in aperto, con
controllo attivo
III
End-point primario:
sopravvivenza libera da
progressione (PFS)
In fase di
reclutamento
RCT, in aperto, con
controllo attivo
III
RCT, doppio cieco,
controllato con placebo
III
End-point primario:
sopravvivenza libera da
progressione
In fase di
reclutamento
RCT, in aperto, con
controllo attivo
III
End-point primario
sopravvivenza senza
tossicità di grado 3 o 4
In fase di
reclutamento
RCT, in aperto, con
controllo attivo,
randomizzazione 2:1
III
End-point primario: tempo
medio di sopravvivenza
Non più in
reclutamento
RCT, in aperto,
multicentrico
N.D.
End-point primario:
sopravvivenza globale (OS)
N.D.
In fase di
reclutamento
Conclusa
Analisi economiche ed altri report di HTA
Relativamente alla I linea l'analisi economica presentata allo Scottish è stata considerata non
sufficientemente solida per poter essere accettata: l'analisi di costo/utilità con modello Markov ha
valutato l'associazione cisplatino/pemetrexed vs cisplatino/gemcitabina (comparator dello studio
principale) e carboplatino/gemcitabina (schema terapeutico predominante in Scozia). Altro confronto
considerato, anche se di importanza secondaria era docetaxel/cisplatino, usato talvolta nella pratica
clinica in Scozia. I dettagli dell'analisi sono mostrati in tabella: l'analisi non è stata considerata
sufficientemente robusta dallo Scottish perché i modelli di sopravvivenza pur essendo semplici
presentavano limiti in termini di trasparenza e di solidità. La preoccupazione principale riguardava una
forte incertezza sulle stime di sopravvivenza che poteva tradursi in un costo per QALY potenzialmente
elevato per pemetrexed/cisplatino rispetto alle associazioni di confronto a base di gemcitabina. Un'altra
debolezza era rappresentata da un potenziale piccolo bias in favore di pemetrexed dovuto all'uso di stime
pessimistiche di utilità originariamente generate per gli stati di salute collegati al trattamento di II linea
del NSCLC.
L'analisi farmacoeconomica relativa alla II linea, dopo un primo parere negativo dello Scottish sul
farmaco, è stata considerata valida pur essendo stato sollevato in un primo momento il dubbio che il
modello usato per valutare la sopravvivenza con pemetrexed rispetto a docetaxel fosse coerente con gli
outcome clinici misurati. Tale quesito è stato comunque chiarito dalle diverse analisi di sensibilità
presentate dalla ditta [13].
Il report dell'agenzia francese HAS è favorevole al rimborso del farmaco per il trattamento del NSCLC sia
in prima che in seconda linea [14]. Tuttavia conclude che in prima linea di trattamento in associazione a
cisplatino, pemetrexed non apporta alcun miglioramento rispetto a gemcitabina (livello V), in seconda
linea di trattamento in monoterapia, pemetrexed non apporta alcun miglioramento rispetto a docetaxel
(livello V).
Il NICE raccomanda l'utilizzo del pemetrexed in I linea in pazienti con carcinoma polmonare non a piccole
cellule localmente avanzato o metastatico con istologia confermata di adenocarcinoma o carcinoma a
grandi cellule [15]. L'approvazione è avvenuta sulla base di un'analisi farmacoeconomica che ha
confrontato pemetrexed+cisplatino versus gemcitabina+cisplatino. Nell'analisi presentata dalla Ditta
veniva considerato un numero di cicli con pemetrexed pari a 6, giudicato non rappresentativo della
pratica clinica reale (numero medio di cicli 4.4). Per il pemetrexed è stato considerato un numero di cicli
pari a tre e solo per i pazienti che rispondevano al trattamento è stato previsto un'ulteriore ciclo di
trattamento. Il NICE sottolinea che considerare un numero di cicli inferiore rispetto allo studio clinico è
inappropriato per un'analisi farmacoeconomica basata sullo studio clinico.
Pertanto il gruppo di revisione del NICE ha stimato gli effetti di una riduzione del numero di cicli con
pemetrexed da 6 a 4, facendo due supposizioni: la prima che la sopravvivenza complessiva sia correlata
alla risposta tumorale, pertanto una riduzione del 19% della risposta corrisponde ad una riduzione del
19% della sopravvivenza; nella seconda è stato supposto che la sopravvivenza complessiva sia correlata
alla durata dell'esposizione, pertanto è stata stimata una riduzione della sopravvivenza complessiva del
32%. Ciò corrisponde ad un ICER di 21.214 £ per i pazienti con adenocarcinoma e di 25.239£ per i
pazienti con carcinoma a grandi cellule. La decisione del NICE verrà rivista appena disponibile la
gemcitabina generica.
Un'analisi costo/utilità ha confrontato erlotinib, pemetrexed e docetaxel in pazienti con NSCLC in stadio
avanzato di età > 60 anni e refrattari al trattamento di I linea. I dettagli dello studio sono mostrati in
tabella. Dall'analisi risulterebbe come maggiormente costo-efficace il trattamento con erlotinib in questo
setting di pazienti. Bisogna peraltro tenere presente che l'analisi è stata svolta in USA e potrebbe essere
poco trasferibile alla realtà italiana [16].
La ditta produttrice ha presentato un' analisi di costo-efficacia [17]. In questo studio, gli autori, partendo
da dati di sopravvivenza del trial clinico hanno stimato, per il confronto tra pemetrexed più cisplatino vs
gemcitabina più cisplatino, un valore incrementale di costo efficacia (ICER) per anni di vita guadagnati
(LYG) pari a € 34.695.
Si è proceduto a ri-effettuare l’analisi, contestualizzandola alla Regione Veneto. Per quanto riguarda il
guadagno di sopravvivenza, si sono considerati gli stessi dati relativi allo studio pubblicato, cioè un
guadagno in termini di anni di vita guadagnati (LYG) di 0.12 per 5 cicli di trattamento. Sono stati,
invece, variati i costi di somministrazione ed i costi del farmaco con la prospettiva della Regione Veneto.
Per calcolare il costo delle terapie sono state considerate le dosi raccomandate in scheda tecnica, mentre
per il numero di cicli sono stati considerati quelli mediani riportati in letteratura.
Nello studio farmacoeconomico il costo del farmaco veniva calcolato in base all’utilizzo effettivo, cioè
prezzo al milligrammo per area corporea, senza alcun spreco. Tale situazione è verificabile solo grazie
all'imminente introduzione in commercio della fiala da 100 mg di pemetrexed e alla calendarizzazione dei
pazienti.
In Veneto la somministrazione della terapia viene fatta in regime ambulatoriale (DGR 734 del
20/03/2007), con una tariffa di 350 euro.
A differenza dello studio [17] per la gemcitabina è stato considerato il prezzo della formulazione
generica. Nell’analisi non è stato considerato il cisplatino in quanto presente nelle stesse quantità e con
la stessa frequenza di infusione nei 2 bracci di trattamento. Sulla base di queste considerazioni si è
stimato un ICER per anni di vita guadagnati pari a € 63.660 nel caso in cui vi sia spreco e un ICER più
basso di €55.191 per anno di vita guadagnato in assenza di spreco (Tab. 1). L'analisi si è dimostrata
molto sensibile alle variazioni di prezzo dei farmaci ed al possibile spreco.
Secondo il parere degli oncologi la durata del trattamento con pemetrexed in I linea, nella pratica clinica
reale è di 4 cicli di trattamento. Tuttavia non è possibile stimare il rapporto costo incrementale per questa
durata di trattamento in quanto i dati di efficacia degli studi clinici si riferiscono ad una durata di 5 cicli.
Pertanto l'analisi economica contenuta nel report del NICE sembra la più plausibile.
Tab 1. Analisi economica PC vs. GC, nella Regione Veneto.
Pemetrexed 5 cicli
Gemcitabina 10 cicli
Differenza Costi
Totale dei costi dei farmaci
11.119
1.242
9.877
Totale dei costi di infusione
1.750
3.500
1.750
Altri Costi*
829
1.529
-700
Costi Totali Spreco
13.698
6.271
7.427
Costi Totali NO Spreco
12.686
6147
6.439
ICER / LYG Spreco
63.660
ICER / LYG NO Spreco
55.191
*Come da studio [17] costi relativi a: trasfusione di piastrine ed eritrociti, agenti stimolanti eritropoiesi,
granulocyte colony -stimulating factor, antiemetici e ricovero per neutropenia febbrile.
Tab 2. Principali caratteristiche delle analisi farmacoeconomiche
Referenza
Metodologia /
tipo di analisi
Scottish
Medicine
Consortium
2009 [13]
Analisi
utilità.
Modello
Markov
Scottish
Medicine
Consortium
2008 [13]
Analisi costo
utilità.
Modello
Markov
NICE 2010 [15]
Analisi di
utilità.
Modello
Markov
Carlson
J.J.
Lung
Cancer
2008; 61:405415 [16]
Ravasio
Giornale
Italiano di HTA
Analisi
utilità
costo
di
di
costo
di
costo-
Analisi costo
efficacia
Confronti
Pazienti / time horizon
Punto di
vista/
Misura
efficacia
Misura di costo
Risultati
ICERs:
CDDP+P:
A istologia non squamosa
£24.684
sottogruppi:
adenocarcinoma
£18.529,
larghe cell:£ 7.826
Risultati sensibili alla stima
della sopravvivenza tanto
che
l'ICER
potrebbe
aumentare fino a £126.714.
1°
CDDP/
Pemetrexed
vs
CDDP/
gemcitabina
2°
CDDP/
pemetrexed
vs
carboplatino/
gemcitabina
3°
CDDP/
pemetrexed
vs
CDDP/
docetaxel
Trattamento di prima linea di
pz con NSCLC di istologia non
a
cellule
squamose
(2
sottogruppi: adenocarcinoma e
carcinoma a larghe cellule)
Time
horizon:
lifetime
(massimo di 6 anni)
SSN /
QALY
Costi diretti sanitari (costo
del farmaco,
ospedalizzazioni, trattamento
degli effetti avversi)
Pemetrexed vs
docetaxel
Trattamento di seconda linea
in pz con NSCLC di istologia
non a cellule squamose
Time horizon: (3 anni
SSN /
QALY
Costi diretti sanitari (costo
del farmaco,
ospedalizzazioni, trattamento
degli effetti avversi)
ICER: £21.926 che può
aumentare a £24.638 se si
considera lo spreco di
farmaco
Pemetrexed +
cisplatino vs
gemcitabina +
cisplatino
Trattamento di prima linea in
pazienti con adenocarcinoma o
carcinoma a grandi cellule con
età media di 60 anni
Time horizon: aspettativa di
vita del paziente
SSN /
QALY
Costi diretti sanitari (costo
del farmaco,
ospedalizzazioni, trattamento
degli effetti avversi)
Adenocarcinoma:
ICER=£21.214
Carcinoma a grandi cellule:
ICER=£25.239
Erlotinib vs
docetaxel vs
pemetrexed
Pz con NSCLC di stadio IIIB/IV
di 60 anni di età.
Time horizon di 2 anni
Pemetrexed +
cisplatino vs
gemcitabina +
cisplatino
Pz con NSLC di stadio IIIB/IV
di 60 anni di età.
Time horizon: aspettativa di
vita del paziente
"US
healthcare
payer"/
QALY
Costi diretti sanitari (costo
del farmaco, della
somministrazione, della
progressione, trattamento
degli effetti avversi)
SSN/LYG
Costi diretti sanitari (costo
del farmaco, della
somministrazione, della
progressione, trattamento
degli effetti avversi)
QALY
per
erlotinib,
docetaxel e pemetrexed
rispettivamente di: 0.42,
0.41, 0.41.
ICER: $37.000 vs $39.100
vs $43.800 per erlotinib,
docetaxel e pemetrexed.
ICER=€34.695
Analisi dei costi (costi delle alternative, potenziale impatto di budget etc.)
Il costo del trattamento di prima linea con l'associazione pemetrexed/cisplatino risulta significativamente
maggiore (anche fino a 4 volte tanto) rispetto alle alternative, ad eccezione dell'associazione contenente
bevacizumab che invece risulta più cara (doppia rispetto all'associazione con pemetrexed nel caso si
consideri l'alto dosaggio). Anche l'uso in monoterapia nella seconda linea il costo del trattamento con
pemetrexed risulta molto superiore alle alternative (un ciclo di terapia costa circa il doppio rispetto al
trattamento con erlotinib o docetaxel).
Trattamento in prima linea
Principio attivo
(associazioni)
Dosaggio da studio
clinico o protocolli
regione Veneto
Pemetrexed
+
Cisplatino
500mg/m2 ogni 21 gg
75mg/m2 ogni 21 gg
Gemcitabina
+
Cisplatino
Gemcitabina:1250
gg 1,8 ogni 21 gg
Cisplatino:
ogni 21 gg
Docetaxel
+
Cisplatino
Bevacizumab
+
Paclitaxel
+
Carboplatino
Paclitaxel
+
Carboplatino
Costo all'
ospedale per
ciclo di
terapia
€ 2262.52
Costo all'
ospedale per
5 cicli di
terapia
Spreco di
farmaco
per ciclo
€ 11312.60
€ 226.24
€ 575.36
€ 2876.80
€ 42.93
Docetaxel: 75mg/m2
ogni 21 gg
Cisplatino: 75mg/m2
ogni 21 gg
€ 944.49
€ 4722.45
Bevacizumab:
15mg/kg
ogni
3
settimane/
7,5mg/kg ogni 3 settimane
Paclitaxel:
200mg/m2
nel giorno 1 ogni 21 giorni
Carboplatino:
AUC=6 mg/ml/min (la dose
raccomandata
da
scheda
tecnica per pazienti non
precedentemente trattati e a
funzionalità renale normale
è di 400mg/m2) ogni 4
settimane
€ 4434.19
(Bevacizumab ad alto
dosaggio)
€ 2903.88
(Bevacizumab
a
basso dosaggio)
€ 22170.95
(Bevacizumab ad
alto dosaggio)
€ 161.30 € 14519.40
237.64
(Bevacizumab a
basso dosaggio)
mg/m2
75mg/m2
Paclitaxel:
200mg/m2
nel giorno 1 ogni 21 giorni
Carboplatino:
AUC=6
mg/ml/min
(la
dose
raccomandata
€ 1.067,81
€ 5339.05
€ 37.49
€ 8,32
Note
Per il calcolo del prezzo è stata considerata una
superficie corporea
di 1,8 m2. Si devono utilizzare quindi 2 fiale di
pemetrexed da 500 mg con uno spreco di 100 mg di
prodotto per ogni ciclo di somministrazione.
Per il cisplatino è stato considerato l'utilizzo di 1 fl da
100mg ed una fl da 50 mg con uno spreco di 15 mg
per ogni ciclo.
Per il calcolo del prezzo è stata considerata una
superficie corporea di 1,8 m2. Si devono utilizzare
quindi 2 fl di gemcitabina da
1 g e 2 fl da 200 mg,con uno spreco di 150 mg per
ogni somministrazione.
Per il cisplatino è stato considerato l'utilizzo di 1 fl da
100mg ed una fl da 50 mg con uno spreco di 15 mg
per ogni ciclo.
Per il calcolo del prezzo è stata considerata una
superficie corporea di 1,8 m2. Si devono utilizzare
quindi 1 fl da 80 mg e 3 fl da 20 mg di docetaxel, con
uno spreco di 5 mg per ogni ciclo di
somministrazione.
Per il cisplatino è stato considerato l'utilizzo di 1 fl da
100mg ed una fl da 50 mg con uno spreco di 15 mg
per ogni ciclo.
Non è stato calcolato il risk sharing
per Bevacizumab
da
scheda
tecnica
per
pazienti
non
precedentemente
trattati
e
a
funzionalità
renale
normale è di 400mg/m2)
ogni 4 settimane
Docetaxel
+
Cisplatino
+
Gemcitabina
Docetaxel:
75
gg 8 ogni 3 sett
Cisplatino:
65
gg 1 ogni 3 sett
Gemcitabina: 1000
gg 1, 8 ogni 3 sett
Per il calcolo del prezzo è stata considerata
una superficie corporea di 1,8 m2.Si devono
utilizzare quindi 1 fl da 80 mg e 3 fl da 20 mg
di docetaxel, con uno spreco di 5 mg per ogni
ciclo di somministrazione. Per il cisplatino è
stato considerato l'utilizzo di 1 fl da 100mg ed
una fl da 50 mg con uno spreco di 35 mg per
ogni ciclo. Per gemcitabina è stato considerato
l'utilizzo di 1 fl da 1 g e 4 fl da 200 mg.
mg/m2
mg/m2
€ 1349.45
€ 6747.25
€ 42.12
mg/m2
Trattamento in seconda linea
Costo
all'ospedale per
ciclo di terapia
Costo all'ospedale per
numero medio di 4
cicli di terapia
Spreco di
farmaco per
ciclo di
terapia
Principio
attivo
Dosaggio
Pemetrexed
500mg/m2
ogni 21 gg
€ 2223.84
€ 8895.36
€ 222.38
Docetaxel
75mg/m2
ogni 21 gg
€ 905.81
€ 3623.24
€ 33.63
Erlotinib
150mg die
€ 1352,82
€ 5411.28
---
Note
Per il calcolo del prezzo è stata considerata una superficie
corporea di 1,8 m2. Si devono utilizzare quindi 2 fiale da 500
mg con uno spreco di 100 mg di prodotto per ogni ciclo di
somministrazione.
Per il calcolo del prezzo è stata considerata una superficie
corporea di 1,8 m2.Si devono utilizzare quindi 1 fl da 80 mg e
3 fl da 20 mg con uno spreco di 5 mg per ogni ciclo di
somministrazione.
Calcolato costo di terapia di 21 giorni.
ANALISI DI BUDGET:
La ditta produttrice ha presentato un'analisi di spesa relativamente alle 3 linee di trattamento con
pemetrexed, considerando una popolazione elegibile di 2.369 [18]. Tale popolazione è stata stimata
partendo da una popolazione di pazienti nella Regione Veneto con NSCLC ad istologia prevalentemente
non squamosa di 3.590 [19] e che di questi circa il 66% sia in stadio IIIb - IV [20]
Nell'analisi è stato considerato:
1. 4 cicli di trattamento per i pazienti in 1° linea, 3 cicli per l'utilizzo in 2° e appena 1 ciclo in 3° linea.
2. 118 pazienti sono stati trattati in 1° linea, 478 in 2° linea e 118 in 3° linea (Anno 2009).
3. 379 pazienti verranno trattati in 1° linea, 379 in 2° linea e 71 in 3° linea (Anno 2010).
Globalmente è stato stimato un costo complessivo per il farmaco nel 2009 di €3.618.145 e di €4.962.760
nel 2010, per un aumento netto della spesa relativamente al farmaco di circa €1.344.615.
Si sottolinea che l'analisi sembra sottostimare la spesa sia in merito al numero di pazienti eleggibili alla
1° linea, dopo l'introduzione del farmaco in PTORV, sia in merito al costo per ciclo della terapia di circa
€1.840 nelle prime due linee e di €1.080 per la terza. Questi costi tra l'altro non sono chiaramente
specificati nel documento presentato. Considerando i costi da noi calcolati per il solo pemetrexed si
avrebbe un costo per ciclo di circa €2.224 considerando lo spreco e di circa €2.002 senza spreco.
Considerando quindi questi 2 prezzi per le 2 prime linee e lasciando invariati i prezzi della 3° si è stimato
un incremento di spesa maggiore, compreso tra circa €1.469.000 nel caso in cui non vi sia spreco e di
circa €1.637.000 nel caso in cui vi sia spreco. Inoltre si sottolinea che se dovessero essere ancora di più i
pazienti trattati in 1° linea con pemetrexed l'impatto sarebbe maggiore e che sarebbe stato più
interessante se la ditta avesse presentato un confronto rispetto agli altri trattamenti disponibili e non
verso le linee di trattamento con lo stesso farmaco.
Bibliografia
1. Riassunto delle caratteristiche del prodotto.
2. Scientific discussion: Alimta EMEA/H/C/000564/II/0009.
3. www.registrotumori.it (accesso del 05/05/2009).
4. NCCN Clinical Practice Guideline in Oncology " Non-small cell lung cancer".
5. D'Addario G et al, Annales of Oncology 2009.
6. Scagliotti G.V et al., J Clin Oncol, 2008; 26 (21):3543-3551.
7. Shepherd F.A. et al, Cancer 2001; 92:595-600.
8. Manegold C. et al, Ann Oncol 2000; 11:435-440.
9. Keunchil P.P. et al, J Thor Oncol 2007; 2(8) suppl 4 (abstract).
10. Scagliotti G. et al, The Oncologist 2009;14:253-263.
11. www.clinicaltrials.gov (accesso del 05/05/2009).
12. www.agenziafarmaco.it (accesso del 05/05/2009).
13. www.scottishmedicine.gov.uk (accesso del 05/05/2009).
14. www.has-sante.fr (accesso del 05/05/2009).
15. www.nice.org.uk (accesso del 14/10/2009).
16. Carlson J.J. et al, Lung Cancer 2008; 61:405-415.
17. Ravasio G. Giornale Italiano di Health Technology Assessment 2009; 2(2): 73-80.
18. Documentazione fornita dalla ditta Eli Lilly Italia.
19. Banca Dati dell'Associazione Italiana Registro Tumori. Giornale Italiano di HTA 2008; 1 (1).
20. Esteban E et al, Cancer Treatment Review 2009; 35 (4): 364-373
SINTESI
Caratteristiche del prodotto
ALIMTA (pemetrexed) è un agente antifolato antitumorale multi-target che esplica la sua azione
interferendo sui processi metabolici fondamentali folato-dipendenti essenziali per la replicazione cellulare.
Il farmaco è indicato per il trattamento di I e II linea del NSCLC a istologia non squamosa e nel
trattamento del mesotelioma pleurico maligno non resecabile.
Studi in vitro hanno dimostrato che il pemetrexed agisce come agente antifolato multi-target inibendo la
timidilato sintetasi (TS), la diidrofolato reduttasi (DHFR) e la glicinamide-ribonucleotide-formil transferasi
(GARFT) che sono enzimi chiave folato-dipendenti per la biosintesi de novo dei nucleotidi timidina e
purina.
Per ridurre la tossicità, i pazienti trattati con pemetrexed devono inoltre ricevere un’integrazione
vitaminica. I pazienti devono assumere giornalmente per via orale acido folico o un prodotto
multivitaminico contenente acido folico.
Inquadramento della patologia
Più di un milione di nuovi casi di tumore al polmone vengono diagnosticati in tutto il mondo ogni anno. E'
il secondo più frequente tumore sia negli uomini che nelle donne. Il carcinoma polmonare non a piccole
cellule (NSCLC) rappresenta circa l'80% dei carcinomi polmonari. Le istologie più comuni sono
rappresentate da quella epidermioide o a cellule squamose (30-35%), adenocarcinoma (40-45%) e
carcinoma a grandi cellule (<10%). Le stime per l’Italia indicano 30.384 nuovi casi incidenti ogni anno fra
i maschi e 6.784 fra le femmine.
Linee guida di trattamento esistenti
Le linee guida NCCN del febbraio 2009, relativamente al trattamento sistemico del NSCLC avanzato o
metastatico, per quanto riguarda il trattamento di prima linea suggeriscono che l'associazione
cisplatino/pemetrexed ha dimostrato
un'efficacia superiore e una minore tossicità rispetto
all'associazione gemcitabina/cisplatino, in pazienti con NSCLC ad istologia non-squamosa. I regimi a base
di platino (carboplatino o cisplatino) sono risultati efficaci in combinazione con uno dei seguenti
chemioterapici: paclitaxel, docetaxel, gemcitabina, vinorelbina, irinotecan, etoposide, vinblastina e
pemetrexed. Per quanto riguarda il trattamento in seconda linea, le linee guida riportano il ricorso a
pemetrexed come singolo agente per pazienti che abbiano riportato progressione della malattia durante
e successivamente al trattamento di prima linea e con un buon performance status (compreso tra 0 e
2).Come alternative si utilizzano il docetaxel o l'erlotinib. Le recenti linee guida dell'ESMO, raccomandano
nel trattamento di prima linea del NSCLC di stadio IV, una doppia associazione a base di cisplatino
combinato con un nuovo agente (vinorelbina, gemcitabina, tassani o pemetrexed nei pazienti con
carcinoma ad istologia prevalentemente non-squamosa), con un livello di raccomandazione I, A
Trattamenti alternativi
Per quanto riguarda il trattamento di prima linea del NSCLC avanzato o metastatico le alternative
terapeutiche sono: l' associazione di cisplatino o carboplatino con: gemcitabina, paclitaxel, vinorelbina,
docetaxel, etoposide, irinotecan e vinblastina; il bevacizumab associato a chemioterpia a base di platino
o l' associazione di cetuximab/vinorelbina/cisplatino .
Per quanto riguarda il trattamento di seconda linea del NSCLC avanzato o metastatico le alternative
terapeutiche sono: il docetaxel o erlotinib.
Dati di efficacia
L'estensione di indicazione di pemetrexed, per il trattamento di prima linea del NSCLC in associazione a
cisplatino, è supportata principalmente da uno studio pilota di fase III e da due studi di supporto
entrambi di fase II. Lo studio principale ha valutato l'efficacia e la sicurezza del regime di combinazione di
pemetrexed e cisplatino rispetto al regime di gemcitabina e cisplatino nella terapia di prima linea del
NSCLC. L'obiettivo primario dello studio è stato quello di valutare la non inferiorità, in termini di
sopravvivenza globale che è stato raggiunto. Anche il tempo alla progressione e la sopravvivenza libera
da progressioni hanno risposto ai criteri di non inferiorità. Lo studio subordinava al raggiungimento del
risultato di non inferiorità l'analisi di superiorità. L'analisi statistica prevedeva anche analisi per
sottogruppi pianificate a priori su diversi elementi: età, fumatori, isologie del tumore e razza. Nel
complesso sui 1000 pazienti con istologia non squamosa, la sopravvivenza globale è stata di 11,8 mesi
per il braccio pemetrexed/cisplatino vs 10,4 mesi per il comparator (p=0.005). Al contrario, i pazienti con
carcinoma a cellule squamose hanno trovato un beneficio maggiore con il trattamento
cisplatino/gemcitabina vs cisplatino/pemetrexed (N=473; OS di 10,8 vs 9,4 mesi rispettivamente,
p=0.05).
La variazione dell'indicazione di pemetrexed in monoterapia nel trattamento di seconda linea in pazienti
con NSCLC localmente avanzato o metastatico "ad eccezione dell'istologia a predominanza di
cellule squamose", deriva principalmente da un'analisi retrospettiva dello studio registrativo, che ha
confrontato l'efficacia del farmaco a docetaxel, non pianificata nel disegno originale dello studio. Questa
analisi a post-hoc intendeva valutare l'esistenza di una correlazione tra efficacia del trattamento, in
termini di sopravvivenza globale media, e l'istologia predominante del tumore. Da questa analisi è
risultato che i pazienti con NSCLC ad istologia non squamosa, trattati con pemetrexed, hanno dimostrato
una sopravvivenza globale media statisticamente superiore rispetto agli altri.
Dati di sicurezza
La Scientific Discussion dell'EMEA riporta i dati di sicurezza emersi dallo studio clinico pilota per
l'indicazione NSCLC in prima linea, confrontando gli eventi avversi del braccio di trattamento
cisplatino/pemetrexed (C/P) rispetto a cisplatino/gemcitabina (C/G). In entrambi i gruppi di trattamento,
gli eventi avversi riportati più comunemente e che hanno causato ritardi nella somministrazione della
dose di farmaco sono stati: neutropenia e anemia La percentuale di pazienti che hanno riportato eventi
avversi correlati al trattamento è stata simile per entrambi i bracci: 751 pazienti (89,5%) nel gruppo CP e
755 pazienti (91,0%) nel gruppo CG. Da sottolineare che i pazienti del gruppo CG hanno riportato un
numero statisticamente superiore di tossicità di grado 3 e 4 rispetto al gruppo sperimentale soprattutto
neutropenia, anemia, leucopenia, la trombocitopenia, la neutropenia febbrile e l'alopecia. La nausea,
invece, si è verificata significativamente con maggior frequenza nel gruppo CP come l'anoressia e
l'insufficienza renale (queste ultime con incidenza molto bassa). Nessuna differenza è stata osservata
nell'incidenza di decessi.
Indicazione studi in corso
Nel registro governativo americano e nel registro dell'osservatorio dell'AIFA sulle sperimentazioni cliniche
sono presenti vari studi per pemetrexed per l'indicazione: NSLCL di stadio localmente avanzato o
metastatico, sia in prima che in seconda linea. Da segnalare che diversi studi prevedono l'associazione di
pemetrexed con altri antitumorali di recente introduzione: cetuximab, bevacizumab, bortezomib.
Analisi economiche ed altri report di HTA
Relativamente alla I linea l'analisi economica presentata allo Scottish è stata considerata non
sufficientemente solida per poter essere accettata perché i modelli di sopravvivenza pur essendo semplici
presentavano limiti in termini di trasparenza e di solidità.
L'analisi farmacoeconomica relativa alla II linea, dopo un primo parere negativo dello Scottish sul
farmaco, è stata considerata valida e pertanto la seconda valutazione ha avuto esito positivo.
La ditta produttrice ha presentato un' analisi di costo-efficacia. In questo studio, gli autori, partendo da
dati di sopravvivenza del trial clinico hanno stimato, per il confronto tra pemetrexed più cisplatino vs
gemcitabina più cisplatino, un valore incrementale di costo efficacia (ICER) per anni di vita guadagnati
(LYG) pari a € 34.695.
Si è proceduto a ri-effettuare l’analisi contestualizzandola alla Regione Veneto con un conseguente
ICER/LYG di €63.660.
Secondo il parere degli oncologi la durata del trattamento con pemetrexed in I linea, nella pratica clinica
reale è di 4 cicli di trattamento. Tuttavia non è possibile stimare il rapporto costo incrementale per questa
durata di trattamento in quanto i dati di efficacia degli studi clinici si riferiscono ad una durata di 5 cicli.
Analisi dei costi (costi delle alternative, potenziale impatto di budget etc-)
Il costo del trattamento di prima linea con l'associazione pemetrexed/cisplatino risulta significativamente
maggiore (anche fino a 4 volte tanto) rispetto alle alternative, ad eccezione dell'associazione contenente
bevacizumab che invece risulta più cara (doppia rispetto all'associazione con pemetrexed nel caso si
consideri l'alto dosaggio). Anche l'uso in monoterapia nella seconda linea il costo del trattamento con
pemetrexed risulta molto superiore alle alternative (un ciclo di terapia costa circa il doppio rispetto al
trattamento con erlotinib o docetaxel).
La ditta produttrice ha presentato un'analisi di spesa relativamente alle 3 linee di trattamento con
pemetrexed e globalmente è stato stimato un costo complessivo per il farmaco nel 2009 di €3.618.145 e
di €4.962.760 nel 2010, per un aumento netto della spesa relativamente al farmaco di circa €1.344.615.
Rivisitando i parametri della analisi quali il costo del trattamento, si è stimato un incremento di spesa
maggiore, compreso tra circa €1.469.000 nel caso in cui non vi sia spreco e circa €1.637.000. Inoltre si
sottolinea che se dovessero essere ancora di più i pazienti trattati in 1° linea con pemetrexed l'impatto
sarebbe maggiore e che sarebbe stato più interessante che la ditta avesse presentato un confronto
rispetto agli altri trattamenti disponibili e non verso le linee di trattamento con lo stesso farmaco.