MMG/ PLS/ UF Salute Mentale
A.USL 8 AR Distretto del Casentino
La Terapia farmacologica della
Depressione
Coordinatori
Relazione
Dott M. Grifagni
Dott.ssa A. Pennacchioni
Bibbiena 12/11/2011
Dott. Vieri Sordi
MDD: questioni aperte
• La depressione maggiore rimane a
tutt’oggi una condizione dibattuta in
termini di diagnosi, cause e terapie
• Include condizioni eterogenee, spesso
complicate dalla presenza di
comorbilità
• L’utilizzo degli attuali presidi terapeutici
non sempre garantisce l’obiettivo di
una remissione completa, anche dopo
uno o più trattamenti antidepressivi
Goodwin GM, J Psychopharmacology, 2010
MDD: a complex constellation of
symptoms
Concentration
Memory
disturbances
Guilt
Lack of
interest
Obsessive
ideations
Affective symptoms
Social
withdrawal
Irritability
Anxiety
Major
depressive
episode
Tears
Anhedonia
Cognitive symptoms
Suicidal ideation
Psychomotor
retardation
Sadness
Physical pains
Moral pain
Eating
symptoms
Fatigue
Sexual
Sleep
disturbances
Physical symptoms
American Psychiatric Association, Diagnostic and Statistical Manual of Mental Disorders ; DSM-IV-TR (Washington DC, 2000).
FARMACOTERAPIA DEI DISTURBI DELL’UMORE
ANTIDEPRESSIVI
STABILIZZANTI DEL
TONO DELL’UMORE
ANTIPSICOTICI
IPNOINDUCENTI
MIGLIORAMENTO DI UN PZ DEPRESSO A SEGUITO
DELLA TERAPIA CON UN ANTIDEPRESSIVO
RISPOSTA
REMISSIONE
Riduzione di almeno il 50% della sintomatologia in
base a scale di valutazione psichiatriche standard
quali l’Hamilton Depression Rating Scale
Scomparsa
sintomi
GUARIGIONE
di
tutti
i
Se dura per un periodo da 6 a 12
mesi
Il 67% dei pz sottoposto a trattamento risponderà dopo 8
settimane, mentre il 33% non presenterà risposta
Umore normale
67% responder
Inizio terapia
33% non responder
Depressione
8 settimane
La metà dei pz depressi può guarire entro 6 mesi da un
episodio e ¾ entro due anni
Qualora vengano tentati molteplici interventi terapeutici, il
90% dei pz risponderà a uno o a una combinazioni di essi
Gli antidepressivi riducono il tasso di ricadute
IPOTESI
MONOAMINERGICA
IPOTESI
NEUROCETTORIALE
BASI BIOLOGICHE DELLA
DEPRESSIONE
IPOTESI
NEUROTROFICA
IPOTESI MONOAMINERGICA
Suggerisce che la depressione sia correlata ad un deficit
di monoamine (in particolare Noradrenalina o Serotonina)
(Schildkraut, 1965).
PROVE A FAVORE
La reserpina induce depressione nei pazienti
I farmaci antidepressivi aumentano la trasmissione monoaminergica
PROVE CONTRO
Gli effetti terapeutici degli antidepressivi compaiono dopo alcune
settimane di trattamento
Non vi è correlazione tra la potenza dell’effetto sulla concentrazione
extracellulare di monoamine e l’efficacia antidepressiva
IPOTESI MONOAMINERGICA
IPOTESI MONOAMINERGICA
Circuiti neuronali coinvolti nel disturbo depressivo
Neuron, 2002 34; 13-25
NORADRENALINA
La maggior parte dei neuroni noradrenergici del cervello è situata nel
Locus coeruleus (LC)
Alcune delle proiezioni del LC alla
corteccia frontale sono responsabili
dell’azione regolatoria della NE
sull’umore
Alcune delle proiezioni del LC alla
corteccia frontale medino gli effetti
della
NE
su
attenzione,
concentrazione
e
altre
funzioni
cognitive
Le proiezioni noradrenergiche dal LC
alla corteccia limbica possono mediare
le emozioni, l’energia, la fatica e
l’agitazione/rallentamento psicomotorio
NORADRENALINA
La maggior parte dei neuroni noradrenergici del cervello è situata nel
Locus coeruleus (LC)
Le proiezioni noradrenergiche dal LC
al cervelletto possono mediare i
movimenti motori, in particolare il
tremore
La NE dei centri cardiovascolari nel
tronco encefalico controlla la pressione
arteriosa sistemica
L’innervazione noradrenergica del
cuore tramite i neuroni sinaptici che
originano dal midollo spinale regola le
funzioni cardiovascolari, compresa la
frequenza cardiaca, tramite i recettori
beta 1
SEROTONINA
La maggior parte dei neuroni serotoninergici del cervello è situata nel
Nucleo del Rafe
SEROTONINA
La maggior parte dei neuroni serotoninergici del cervello è situata nel
Nucleo del Rafe
Le proiezioni serotoninergiche dal rafe
alla corteccia frontale possono essere
importanti nella regolazione dell’umore
Le proiezioni serotoninergiche dal rafe
alle aree limbiche potrebbero essere
coinvolte nei meccanismi dell’ansia e
del panico
Le
proiezioni
serotoninergiche
all’ippocampo regolerebbero l’appetito
e il comportamento alimentare
SEROTONINA
I neuroni serotoninergici dei centri del
sonno del tronco encefalico regolano il
sonno
I neuroni serotoninergici che scendono nel
midollo
spinale
possono
essere
responsabili del controllo di alcuni riflessi
spinali che fanno parte della risposta
sessuale, come l’orgasmo e l’eiaculazione
L’area trigger chemiorecettrice del tronco
encefalico può regolare il vomito,
soprattutto attraverso i recettori 5-HT3
I recettori 5-HT3 e 5-HT4 periferici
dell’intestino regolano l’appetito e altre
funzioni gastrointestinali, quali la motilità
gastrointestinale
SINTOMI CONTROLLATI DAI SISTEMI MONOAMINERGICI
Noradrenalina
Attenzione
Serotonina
Ansia
Irritabilità
Impulsività
Ideazione suicidaria
Umore, Emotività
Funzioni
Cognitive Sonno, Appetito
Motivazione
Funzioni sessuali
Energia
Aggressività
Attività psicomotoria
Euforia
Dopamina
NA e 5HT hanno un ruolo trofico
• Il potenziamento della trasmissione
monoaminergica si osserva dopo
alcune ore dalla somministrazione
del farmaco
• L‟azione antidepressiva si manifesta
solo dopo alcune settimane
di trattamento
LIMITI DELL‟IPOTESI MONOAMINERGICA
La teoria monoaminergica della depressione é troppo
semplicistica per spiegare una sindrome così complessa
che include cambiamenti a livello di umore, sonno,
attività sessuale, appetito, temperatura corporea, attività
locomotoria, funzioni cognitive.
Vi è una discrepanza fra la rapida modificazione dei
livelli sinaptici di amine biogene dopo somministrazione
di farmaci antidepressivi e l'effetto terapeutico che si
osserva dopo almeno 3-4 settimane di somministrazione
continua.
Evidenze farmacologiche in relazione alla
teoria monoaminergica della depressione
FARMACO
EFFETTO PRINCIPALE
EFFETTO NEI PAZIENTI DEPRESSI
Effetti in accordo con la teoria
Antidepressivi
triciclici
Bloccano la captazione di NA e 5-HT
Umore
Inibitori delle MAO
Aumentano l‟accumulo di NA e 5-HT
Umore
a-metiltirosina
Metildopa
Inibisce la sintesi di NA
Umore
Inibisce la sintesi di NA
Umore
Reserpina
Inibisce l‟accumulo di NA e 5-HT
Umore
Terapia
elettoconvulsiva
le risposte del SNC alla NA e 5-HT
Umore
Effetti non in accordo con la teoria
Nessuno effetto
Amfetamina
Libera NA
Cocaina
Inibisce la captazione di NA
Nessuno effetto
Antagonisti dei
recettori a e b
Bloccano gli effetti della NA
Nessun effetto
Levodopa
Aumenta la sintesi di NA
Nessuno
IPOTESI NEURORECETTORIALE
Questa teoria afferma che vi è qualcosa di alterato nei
recettori per i principali neurotrasmettitori monoaminergici.
Tale alterazione dei recettori può essere essa stessa dovuta a
una deplezione di neurotrasmettiri monoaminergici.
La deplezione del neurotrasmettitore causa un’up-regulation
compensatoria dei recettori neurotrasmettitoriali post-sinaptici.
STUDI AUTOPTICI
STUDI INDIRETTI
Alterazione funzionale della
neurotrasmissione
• Il principale elemento di disregolazione
funzionale alla base della fisiopatologia della
depressione consiste in una "up-regulation"
della sensibilita' dei recettori post-sinaptici
• Tutti gli interventi terapeutici in grado di
ridurre i sintomi della depressione si rivelano
efficaci in quanto in grado di ridurre la
sensibilita' dei recettori post-sinaptici
L‟IPOTESI NEUROTROFICA
La depressione potrebbe essere dovuta a
una pseudocarenza di monoamine per un
deficit nella trasduzione del segnale dal
neurotrasmettitore monoaminergico al suo
neurone post-sinaptico, in presenza di
normali quantità di neurotrasmettitori e di
recettori
L‟IPOTESI NEUROTROFICA
L’interazione
"monoamina-recettore"
determina
la
modificazione di un certo numero di "trasduttori“, quali le
"Proteine G"
Le "Proteine G" modulano la concentrazione dei secondi
messaggeri ("cAMP" e gli "inositol-fosfati"), che all’interno
della cellula attivano le "Protein-kinasi", a loro volta
responsabili della "fosforilazione" ed attivazione di un gran
numero di "proteine substrati" rappresentanti l’effettore
immediato della risposta biologica
Tra queste proteine intracellulari ve ne sono alcune che
sembrano esser più specificamente implicate nei disturbi
dell’umore. Esse sono il CREB ("cAMP response element
binding protein") e il BDNF (" brain derived neurotrophic
factor") appartenenti alla famiglia delle neurotrofine.
L‟IPOTESI NEUROTROFICA
• Studi recenti dimostrano che gli antidepressivi possono
modificare la funzione, la qualità e lo stato di
attivazione del CREB e del BDNF, mentre situazioni
di stress o di conflitto tendono a ridurlo.
• Questi studi concordano nel suggerire che, al di là del
recettore, molto probabilmente lo stato depressivo è
anche accompagnato da modificazioni o alterazioni
funzionali del CREB e del BDFN; alterazioni che
dipenderebbero in parte dalla maggiore o minore
attivazione dei geni responsabili della loro formazione.
L’IPOTESI NEUROTROFICA
Studi clinici hanno dimostrato che pazienti
depressi presentano una ridotta concentrazione
di CREB a livello della corteccia temporale
rispetto al gruppo di controllo, mentre pazienti
depressi in corso di trattamento presentano
valori comparabili a quelli del gruppo di
controllo.
L‟IPOTESI NEUROTROFICA
Il fattore di trascrizione nucleare CREB è
stato proposto come target postrecettoriale
candidato a mediare le risposte adattative
che si verificherebbero in seguito a
trattamento prolungato con diverse classi di
farmaci antidepressivi, ma non da sostanze
psicotrope non antidepressive (es. cocaina,
morfina).
L‟IPOTESI NEUROTROFICA
Gli studi più recenti si sono focalizzati sugli effetti
molecolari prodotti dal trattamento cronico con farmaci
antidepressivi.
Da questi è emerso che i farmaci antidepressivi
interferiscono non solo con la produzione e il rilascio di
catecolamine, ma anche con i meccanismi di
trasduzione del segnale di questi neurotrasmettitori.
Si può quindi ipotizzare che l’intervallo terapeutico
necessario affinché i farmaci antidepressivi siano efficaci
sia determinato dalla necessità per queste molecole di
indurre cambiamenti adattativi nei meccanismi di
trasduzione del segnale.
EFFETTI DEGLI ANTIDEPRESSIVI DOPO
SOMMINISTRAZIONE CRONICA
Regolazione espressione
dei recettori
Recettore
Regolazione dei meccanismi
di trasduzione a livello
citoplasmatico
effettore
Protein chinasi
Controllo dell‟espressione
genica
nucleo
Gli antidepressivi attraverso una modificazione del processo
di plasticità normalizzano la funzione dei neuroni NA e 5HT
Trattamento con ADs
Inibisce il
reuptake e il
metabolismo di
NA e 5HT
NA / 5HT
R
NA / 5HT
R
G AC
ATP
R
P
P
P
C
cAMP
Chinasi calcio dipendenti
R C PKA
Effetti trofici: rimodellamento
sinaptico, neurogenesi,
sopravvivenza neuronale,
nuovi recettori
CREB
CREB
CREB
Espressio
ne genica
di BDNF
Normalizzazione
funzione
e plasticità
neuronale
IPOTESI NEUROTROFICA e ANTIDEPRESSIVI
Tuuti gli antidepressivi hanno un’azione comune sui neurotrasmettitori
monoaminergici:
-
aumentano la neurotrasmissione monoaminergica
-
desensibilizzano i recettori dei neurotrasmettitori
Gli antidepressivi, a prescindere dalla loro azione
iniziale sui recettori e sugli enzimi, alla fine fanno
sì che alcuni geni critici vengono attivati o inattivati
DINAMICA TEMPORALE
DEGLI EFFETTI DEGLI ANTIDEPRESSIVI
8
EFFETTO SPECIFICO
6
Settimane di
trattamento con
antidepressivi
4
EFFETTO PLACEBO
2
REMISSIONE SPONTANEA
0
Effetti sinaptici
ore - giorni
Effetti collaterali
ore - giorni
Effetti terapeutici
4 - 6 settimane
Evoluzione dei farmaci antidepressivi
1950
2000
2010
Nefazodone
Escitalopram
Agomelatina
Sertralina
Mirtazapina
Duloxetina
Mifepristone
Venlafaxina
1970
1980
Maprotilina
Fluoxetina
Isocarbossazide Clomipramina Amoxapina
Fenelzina
Tranilcipromina
1960
Imipramina
1990
Nortriptlina
Mianserina
Paroxetina
Amitriptilina
Trazodone
Fluvoxamina Tianeptina
Desipramina
Citalopram
Reboxetina
Bupropione Milnacipran
Moclobemide
Inibitori
Monoamino
ossidasi
IMAO
Irreversibili
Documentazione sulla
efficacia degli AD nella
depressione maggiore
RIMA
TCA
Inibitori del
SSRI
Evidenze forti
reuptake
NARI
Evidenze deboli
SNRI
Antagonisti
recettori
presinaptici
Composti
“naturali”
NaSSA
Amisulpride
Iperico
Mancanza di evidenze
EVOLUZIONE DELLE INDICAZIONI PER IL
FARMACOLOGICO
DELL’ANSIA
E
DELLA
NELLE ULTIME CINQUE DECADI
Trattamento della
Depressione Maggiore
Fino al
1950
IMAO TCA
Trattamento del
Disturbo d‟Ansia
Attitudini fenomenologiche
verso l‟ansia e la depressione
BARBITURICI
Ansia e Depressione insieme
BENZODIAZEPINE
Ansia e Depressione separate
Dal 50
al 60
„70 e
primi „80
ALPRAZOLAM
SSRI BUSPIRONE
RIMA
Fine 80
e „90
TRATTAMENTO
DEPRESSIONE
ALPRAZOLAM
BUSPIRONE
TCA IMAO
Ansia e Depressione separate
SSRI
RIMA
Ansia e Depressione insieme
Antidepressivo ideale
Efficace
Rapido
Utile nel trattamento acuto e cronico
Pochi effetti collaterali
Basse interazioni tra farmaci
Sicurezza in caso di overdose
No metaboliti attivi
Come scegliere un antidepressivo
Profilo degli effetti collaterali
Presenza di un concomitante disturbo somatico
Utilizzo di altri farmaci
Risposta positiva precedente per un certo farmaco
Tipo di depressione e comorbidità
Storia familiare positiva per la risposta ad un farmaco
Stile di vita
Compliance
Costi
Esperienza del terapeuta
Attività farmacologiche
degli antidepressivi Triciclici
Inibizione
altre
Triciclici
ricaptazione
NA / 5-HT
• Anticolinergica > M-1
attività
• Adrenolitica > alfa-1
• Antiistaminica > H-1
• Chinidino-simile
EFFETTI
COLLATERALI
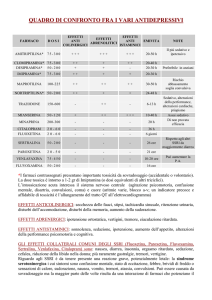
Antidepressivi Triciclici (TCA)
Amitriptilina
Clomipramina
Desipramina
Imipramina
Nortriptilina
Trimipramina
Effetti Indesiderati
dei Farmaci Antidepressivi
Gli effetti collaterali/indesiderati degli AD, ad
eccezione di quelli idiosincrasici, sono
spesso prevedibili, poichè rappresentano una
estensione delle loro attività farmacologiche.
Antidepressivi Triciclici (TCA)
- Ipotensione Ortostatica
- Tachicardia riflessa
a-1
M1
-Sedazione
-Aumento
di peso
H1
TCA
Xerostomia
Visione offuscata
Ritenzione urinaria
Stipsi
Disturbi mnesici
Proprietà Chinidino-simili
DISTURBI DEL RITMO
NRI
SRI
Effetto Antidepressivo
Stahl J. Clin. Psich. 2001
Antidepressivi Triciclici (TCA)
Effetti terapeutici
Antidepressivi Triciclici (TCA)
Effetti collaterali
INTOSSICAZIONE DA TCA
• I sintomi da sovradosaggio comprendono:
– Agitazione
– Delirium
– Convulsioni
– Iperreflessia tendinea
– Paralisi vescicale e rettale
– Sregolazione della pressione arteriosa e della
temperatura
– Midriasi
– Alterazioni dello stato di coscienza fino al coma
Triciclici: Cardiotossicità
pressione arteriosa
frequenza cardiaca
conduzione A-V
aritmie ventricolari
• I Triciclici come gli antiaritmici di
Classe 1 possono indurre aritmie
ventricolari
in
condizioni
di
anaerobiosi, quali si verificano nel
miocardio ischemico
• I Triciclici sono sconsigliati in caso
di
cardiopatia ischemica, anche
asintomatica
Glassman & Roose, J Clin Psych, 55:9 (S. A) (1994)
Sindrome da Sospensione TCA
• La maggior parte sono da rebound anticolinergico:
– Disfunzione gastrointestinale
– Nausea
– Vomito
– Diarrea
– Scialorrea
– Sudorazione
– Piloerezione
– Ansia – Irrequitezza
– (Delirium)
•
•
•
•
•
INIBITORI SELETTIVI RICAPTAZIONE DELLA SEROTONINA (SSRI)
Fluoxetina
(Prozac, Fluoxeren)
Fluvoxamina
(Fevarin, Maveral, Dumirox)
Paroxetina
(Eutimil, Daparox, Seroxat, Sereupin)
Es-Citalopram
(Cipralex, Entact - Seropram, Elopram)
Sertralina
(Zoloft, Tatig, Serad)
Altri antidepressivi
• VenlafaxinaSNRI
• Mirtazapina
• Reboxetina
• Trazodone
• Nefazodone
• Bupropione
(Efexor, Faxine)
NaSSA
(Remeron)
NRI
(Davedax, Edronax)
SARI
(Trittico)
SARI
(Reseril)
DaRI
(Quomem, Zyban, Welbutrin)
AD: Dosi terapeutiche massime
•
•
•
•
•
•
•
•
•
•
•
Triciclici
Citalopram
Fluoxetina
Fluvoxamina
Paroxetina
Sertralina
Duloxetina
Venlafaxina
Reboxetina
Mirtazapina
Escitalopram
300 mg/die
60 mg/die
60 mg/die
300 mg/die
60 mg/die
200 mg/die
60-120 mg/die
300 mg/die
12 mg/die
60 mg/die
30 mg/die
DRI
5HT2C
NRI
m-ACh
SSRI
SSRI
SSRI
SSRI
SRI
SRI
NOS
1A2
CYP 2DS
CYP
3A4
CYP 3A4
SSRI: profilo farmacologico
DA
sertralina
citalopram SRI
H1
SRI
ACh
paroxetina
SRI
NRI
NOS
fluoxetina
NRI
5HT2
SRI
fluvoxamina
SRI
Profilo farmacodinamico e farmacocinetico degli
SSRI
citalopram
SRI
H-1
DRI
sertralina
SRI
M-ACh
paroxetina
NRI
NOS
SRI
Il citalopram è il più selettivo tra gli SSRI, non interagisce con altri
trasportatori, possiede una debole affinità per i recettori H-1
dell’istamina, base neurochimica del leggero effetto sedativo, non
inibisce l’attività del CYP 450 e pertanto non dà luogo a pericolose
interazioni con altri farmaci.
La sertralina blocca anche il trasportatore della DA e questo effetto
spiegherebbe le sue proprietà disinibenti e attivanti rilevabili a
livello cognitivo soprattutto nei pazienti anziani, ma potrebbe portare
ad una eccessiva stimolazione del paziente, con manifestazioni
d’ansia.
La paroxetina inibisce anche l’uptake della NA, inibisce la nitrossido
sintasi, effetto che può portare a disfunzioni erettili, e risulta essere
la molecola con maggiore azione anticolinergica soprattutto per
un’azione a livello dei recettori muscarinici M3. Tale effetto, oltre alla
potente inibizione del CYP 2D6, richiede una particolare attenzione
nel paziente anziano con problemi cognitivi e nelle
polifarmacoterapie con altri farmaci metabolizzati dallo stesso
isoenzima.
Profilo farmacodinamico e farmacocinetico degli
SSRI
fluvoxamina
fluoxetina
NRI
5HT2
SRI
SRI
La fluvoxamina, fra gli SSRI, risulta sicuramente la molecola con
caratteristiche maggiormente sedative; è un potente inibitore
delle isoforme 1A2 e 3A4 del CYP450 e pertanto può dar luogo
ad interazioni con altri farmaci che seguono la stessa via
metabolica.
Sertralina e fluvoxamina interagiscono inoltre con il recettore sigma,
azione che ne suggerisce l‟uso, in associazione ai farmaci
antipsicotici, per i sintomi negativi della schizofrenia.
La fluoxetina inibisce anche l’uptake della NA e questo effetto
associato ad una specifica azione a livello dei recettori 5HT2c
rende conto dell’ azione attivante, contestualmente ad una
riduzione nell‟assunzione del cibo e ad una riduzione della
fame soggettiva, con conseguente perdita di peso.
Attività farmacologiche
degli Inibitori Selettivi della Ricaptazione di Serotonina:
Agonisti:
SSRI
5-HT1A
5-HT2
5-HT3
• Dopaminergica > Sertralina
• Anticolinergica > Paroxetina
• Antiistaminica > Citalopram
SSRI: effetti indesiderati associati alla
stimolazione dei recettori serotoninergici
5-HT2A
Attivazione, insonnia,
ansia, disfunzioni sessuali
5-HT2C
Irritabilità, riduzione
appetito (fluoxetina)
5-HT3
Nausea, vomito, cefalea
Altri meno comuni: Iponatremia (SIADH); Effetti
extrapiramidali; Ridotta aggregazione piastrinica
Profilo antidepressivo degli SSRI
La dose di partenza è in genere uguale alla dose di
mantenimento
L’inizio della risposta si ha solitamente entro 3-8 settimane
La risposta è frequentemente rappresenta da una
completa remissione dei sintomi
INTOSSICAZIONE DA SSRI
• I sintomi da sovradosaggio comprendono:
– Nausea
– Vomito
– Agitazione
– Insonnia
– Convulsioni
Interazioni farmacodinamiche degli SSRI
IMAO
SSRI
+
Triciclici>5HT
Litio
Carbamazepina
Meperidina
Triptofano
Sindrome
serotoninergica
Trazodone
Vomito, diarrea, mioclonie ,ipereflessia, tremore,
ipertensione, febbre, stati di eccitamento o agitazione
Sindrome da Sospensione SSRI
• Gli SSRI non sono farmaci di abuso, non
danno fenomeni di tolleranza, dipendenza e
astinenza: quando la loro assunzione viene
interrotta bruscamente, i pazienti non
mostrano né la caratteristica sindrome da
astinenza relativa alla sospensione di
farmaci che deprimono il SNC, né il
comportamento di ricerca compulsiva del
farmaco
Sindrome da Sospensione SSRI
• Sintomi Psichici:
• Sintomi Somatici:
– Ansia
– Vertigini
– Irritabilità
– Nausea e Vomito
– Accessi di pianto
– Stanchezza
– Letargismo
– Sintomi Simil-influenzali
(dolori e brividi)
• Più frequenti con Paroxetina
• Evitare sospensione brusca
– Disturbi della Sensibilità
• Si manifestano entro 2-3
– Disturbi del Sonno
giorni
Modalità di sospensione dell‟AD
• La sospensione del trattamento deve essere
sempre effettuata valutando i possibili rischi di
una recidiva.
• Non sospendere il trattamento con AD
bruscamente: possibile rischio di indurre una
sindrome da sospensione.
• La posologia va ridotta gradualmente.
Sindrome da brusca sospensione di
antidepressivi
• Comune a tutti gli antidepressivi
• Più intensa con AD ad emivita breve
> riportata più di frequente con paroxetina
• Sintomatologia: nausea, vomito, diarrea,
gastralgia, mialgie, irrequietezza, cefalea,
insonnia, sintomi extrapiramidali
• In caso di sospensione: riduzione
del 25% della dose a settimana
Profilo farmacodinamico e farmacocinetico degli
SSRI
citalopram
SRI
H-1
DRI
sertralina
SRI
M-ACh
paroxetina
NRI
NOS
SRI
Il citalopram è il più selettivo tra gli SSRI, non interagisce con altri
trasportatori, possiede una debole affinità per i recettori H-1
dell’istamina, base neurochimica del leggero effetto sedativo, non
inibisce l’attività del CYP 450 e pertanto non dà luogo a pericolose
interazioni con altri farmaci.
La sertralina blocca anche il trasportatore della DA e questo effetto
spiegherebbe le sue proprietà disinibenti e attivanti rilevabili a
livello cognitivo soprattutto nei pazienti anziani, ma potrebbe portare
ad una eccessiva stimolazione del paziente, con manifestazioni
d’ansia.
La paroxetina inibisce anche l’uptake della NA, inibisce la nitrossido
sintasi, effetto che può portare a disfunzioni erettili, e risulta essere
la molecola con maggiore azione anticolinergica soprattutto per
un’azione a livello dei recettori muscarinici M3. Tale effetto, oltre alla
potente inibizione del CYP 2D6, richiede una particolare attenzione
nel paziente anziano con problemi cognitivi e nelle
polifarmacoterapie con altri farmaci metabolizzati dallo stesso
isoenzima.
Profilo farmacodinamico e farmacocinetico degli
SSRI
fluvoxamina
fluoxetina
NRI
5HT2
SRI
SRI
La fluvoxamina, fra gli SSRI, risulta sicuramente la molecola con
caratteristiche maggiormente sedative; è un potente inibitore
delle isoforme 1A2 e 3A4 del CYP450 e pertanto può dar luogo
ad interazioni con altri farmaci che seguono la stessa via
metabolica.
Sertralina e fluvoxamina interagiscono inoltre con il recettore sigma,
azione che ne suggerisce l‟uso, in associazione ai farmaci
antipsicotici, per i sintomi negativi della schizofrenia.
La fluoxetina inibisce anche l’uptake della NA e questo effetto
associato ad una specifica azione a livello dei recettori 5HT2c
rende conto dell’ azione attivante, contestualmente ad una
riduzione nell‟assunzione del cibo e ad una riduzione della
fame soggettiva, con conseguente perdita di peso.
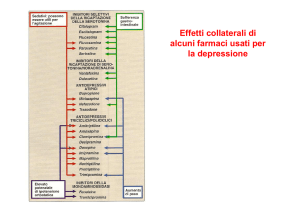
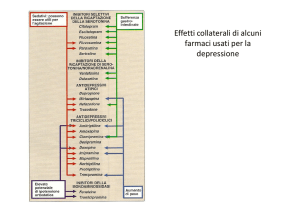
Effetti indesiderati degli altri AD
• Venlafaxina: nausea, vomito, vertigini, cefalea,
insonnia, modici rialzi pressori
• Reboxetina: attività NAergica
insonnia , irritabilità, disturbi anticolinergici,
tachicardia, sudorazione
• Mirtazapina: attività antiistaminica
sedazione, sonnolenza, ipotensione,
incremento ponderale
• Amisulpride: disturbi da iperprolattinemia
galattorrea, ginecomastia, alterazioni sessuali,
disturbi extrapiramidali, incremento ponderale
Tollerabilità
- nausea, vomito, cefalea
- insonnia
- pressione arteriosa
venlafaxina
SRI
DRI
SNRI
NRI
INIBITORI SELETTIVI DEL REUPTAKE DI
SEROTONINA E NORADRENALINA (SNRI)
Venlafaxina
Meccanismo d‟ azione Potente inibizione del reuptake della
5HT a basse dosi; blocco della
ricaptazione della NE a dosi moderate;
inibizione del reuptake della DA ad alte
dosi. Rapida “down regulation dei β-rec
Indicazioni
Depressione Maggiore
Depressione melanconica, delirante
Depressione resistente agli SSRI
Depressione nel senium
Distimia
Depressione secondaria (schizofrenia, demenza)
Depressione bipolare
Depressione associata ad ansia generalizzata
Profilassi della depressione unipolare ricorrente
SNC: Cefalea, convulsioni (rare 0.3%), agitazione,
sedazione o insonnia, del sonno REM, incubi
notturni, astenia, viraggi ipo e maniacali (0.5%),
sindrome delle gambe senza riposo.
Effetti
Anticolinergici: Bocca asciutta, sudorazione,
ritenzione urinaria, stipsi.
Cardiovascolari: Modesto della P. A., tachicardia,
collaterali
sensazioni vertiginose, ipotensione
casuale.
Gastrointestinali: Nausea.
Sessuali: 30% dei pazienti come con gli SSRI.
Altri: Iponatriemia, del colesterolo, mastopatia.
Interazioni farmacologiche Anticolinergici, IMAO, antipsicotici,
cimetidina, zolpidem, inibitori delle
proteasi.
Profilo farmacologico del
Bupropione
DRI
BUPROPIONE
SRI
DOPAMINERGICI E NORADRENERGICI (NDRI)
Bupropion
Meccanismo d‟ azione Inibizione della NA (primariamente) e della
DA (ad un minor livello) nei neuroni
presinaptici.
Indicazioni
Depressione Maggiore
Depressione resistente ai triciclici
Profilassi della depressione ricorrente
Depressione bipolare (?)
Distimia
Effetti collaterali SNC: Insonnia, incubi, ridotta latenza REM,
sonno REM, agitazione, ansia, irritabilità,
disforia, aggressività, possibile
esacerbazione dei sintomi psicotici ed
ossessivi, confusione mentale, difficoltà di
concentrazione (ad alte dosi), convulsioni,
tremori, mioclono, cefalea, artralgie,
mialgie, nevralgie, sintomi discinetici.
Anticolinergici: Bocca asciutta, sudorazione (raro)
Effetti
collaterali
Cardiovascolari: Modesto della P. A. , ipotensione
ortostatica, sensazioni vertiginose,
palpitazioni, casi isolati di
miocardite, IMA e TIA.
Endocrini: Irregolarità mestruali, rara ipoglicemia.
Altri: Orticaria, sindrome di Steven-Johnson, rari
alopecia, prurito, angioedema, anoressia,
dispnea).
Amantadina, antiaritmici, antibiotici,
: antidepressivi TCA, SSRI, IMAO irreversibili,
Interazioni
antipsicotici, beta-bloccanti, L- DOPA,
farmacologiche
,
Litio,amine simpaticomimetiche
mirtazapina
Tollerabilità
- sedazione, sonnolenza
- aumento ponderale
2
H1
NaSSA
5HT3
5HT
2A
5HT
2C
NORADRENERGICI E SEROTONINERGICI SPECIFICI
(NaSSA)
Mirtazapina
Meccanismo d‟azione Antagonismo selettivo degli auto ed
eterocettori a 2adrenergici coinvolti nella
regolazione del “release” della NA e 5HT;
blocco dei recettori 5HT e 5HT
2A .
3
Depressione Maggiore, associata a disturbi del sonno
Depressione Maggiore, associata a dist. d‟ansia
Indicazioni Depressione Maggiore, associata a deficit cognitivi
Distimia
Prevenzione delle ricadute
SNC: Sedazione, astenia, insonnia, sogni vividi,
riduzione del sonno REM, agitazione,
nervosismo, irrequietezza, sintomi psicotici
e convulsioni (raramente), delirium (raro)
Anticolinergici: Bocca secca, sudorazione, visione
offuscata, ritenzione urinaria, stipsi.
Effetti
collaterali
Cardiovascolari: Ipotensione, ipertensione,
vertigini, tachicardia,
palpitazioni, edema.
Gastrointestinali: Bocca amara, dispepsia, nausea,
vomito, diarrea, appetito e peso,
occasionale di appetito e peso.
Altri:Tremori, vampate, transitorio delle
transaminasi, neutropenia, agranulocitosi,
colesterolo e trigliceridi, mialgie e sindrome
simil-influenzale.
Interazioni
Anticonvulsivanti, IMAO, Alcol, BZD, stimolanti
farmacologiche (anfetaminici).
Profilo farmacologico del
Nefazodone e del Trazodone
a
a
NEFAZODONE
SRI
TRAZODONE
NRI
5-HT2
5-HT2C
SRI
ANTAGONISTISEROTONINERGICI E INIBITORI DEL
REUPTAKE DELLA SEROTONINA (SARI)
Trazodone
Nefazodone
Meccanismo d‟azione Azione duale mediante inibizione del
reuptake della serotonina a livello
presinaptico ed effetto antagonista sui
recettori 5HT2A postsinaptici.
Indicazioni
Depressione Maggiore
Depressione melanconica
Depressione nel senium
Depressione ricorrente
Distimia
Effetti
collaterali
SNC:astenia, letargia, affaticabilità, confusione,
agitazione, irrequietezza, difficoltà di
concentrazione, del sonno REM, episodi ipo- e
maniacali, tremori, acatisia, convulsioni (alla
sospensione), parestesie, mioclonie, balbuzie,
difficoltà di deambulazione, parkinsonismo,
cefalea.
Anticolinergici: visione offuscata, stipsi, bocca secca
Cardiovascolari: bradicardia, ipotensione, del
tempo di conduzione.
Gastrointestinali: di peso (trazodone), lingua nera,
glossite, sanguinamento
intestinale.
Sessuali:eiaculazione dolorosa o retrograda, della
libido e priapismo.
Endocrini: iponatriemia, dei livelli glicemici.
Reazioni allergiche: epatiti, transaminasi, ins.
epatica, rush, orticaria, edema,
discrasie ematiche(rari).
Altri: alopecia, bruciori in varie parti del corpo.
Tollerabilità
- insonnia
- irritabilità
- ritenzione urinaria
xerostomia
reboxetina
NARI
NRI
NORADRENERGICI (NRI)
Reboxetina
Meccanismo d‟azione Blocco selettivo del reuptake della NA
Indicazioni
Depressione Maggiore
Depressione del senium
Prevenzione delle ricadute (a lungo termine)
SNC: Ansia, nervosismo, tremori, alt. motorie,
agitazione, talora sonnolenza.
Effetti
collaterali
Anticolinergici: Bocca asciutta, stipsi, ritenzione
urinaria
Disfunzione sessuali
Evidenze di ritmi circadiani disturbati nella
depressione
• Variazioni umorali diurne
• Alterazioni del funzionamento diurno, di livello di concentrazione
• Disturbi del sonno: difficoltà nell’addormentarsi e nella continuità del sonno,
risvegli precoci
• Funzioni fisiologiche: variazioni dell’appetito e della temperatura corporea
• Fattori biologici: prolattina, cortisolo, ormone della crescita, melatonina …
Il grado di severità della depressione è correlato
con la disincronizzazione dei ritmi circadiani
Emens et al, Psychiatry Research (2009)
Wirz-Justice, Int Clin Psychopharmacol. 2006; Turek, Int Clin Psychopharmacol. 2007
McClung, Pharmacol Ther. 2007
Melatonina
Infiammazione
Dolore
Ritmo
Sonno
Neurogenesi
Veglia
Fattori
trofici
Melatonina Recp
MT2
Melatonina Recp.
MT1
GABA
GABAA
Rec
Nature, August 2010
Scelta del Farmaco AD
Fattori da valutare:
•
•
•
•
•
Efficacia antidepressiva
Tollerabilità
Tossicità da sovradosaggio
Caratteristiche farmacocinetiche
Malattie organiche concomitanti
Tossicità da sovradosaggio
degli AD
Studi di tossicologia clinica documentano
un‟elevata tossicità per gli AD Triciclici,
rispetto ad altre classi di AD.
Rischio di mortalità elevato per:
Amitriptilina e Dotiepina
Triciclici > controindicati nel trattamento
ambulatoriale dei pazienti depressi a rischio di
suicidio
Henry et al. 1995
Scelta del Farmaco AD
Fattori da valutare:
•
•
•
•
•
Efficacia antidepressiva
Tollerabilità
Tossicità da sovradosaggio
Caratteristiche farmacocinetiche
Malattie organiche concomitanti
Interazioni farmacologiche degli
Antidepressivi
• Farmacodinamiche:
Aumento o riduzione degli effetti farmacologici per
meccanismi di sinergismo o antagonismo a livello
recettoriale.
• Farmacocinetiche:
Aumento o diminuzione dei livelli plasmatici per
alterazioni dei processi cinetici: assorbimento,
legame proteico, inibizione o induzione metabolica
Interazioni farmacodinamiche
dei Triciclici
Alcolici
Triciclici
+
Barbiturici
Antiistaminici
Antipsicotici
BDZ
Aumento degli effetti sedativi e ipotensivi
Interazioni farmacodinamiche
degli SSRI
IMAO
SSRI
+
Triciclici>5HT
Litio
Carbamazepina
Meperidina
Triptofano
Sindrome
Serotoninergica
Trazodone
Interazioni farmacocinetiche
degli SSRI
• Gli SSRI possono inibire il metabolismo
ossidativo dei farmaci metabolizzati
dagli isoenzimi microsomiali epatici
> citocromo P-450 <
Esistono tra gli SSRI significative differenze
nel grado di inibizione esercitato sui diversi
citocromi
Citocromo – P-450
1A2
2D6
2C9
1 = famiglia
A = sottotipo
1= prodotto genico
2C19
3A4
Interazioni farmacocinetiche
dei Triciclici
Farmaci* che aumentano i livelli plasmatici dei triciclici
per inibizione del loro metabolismo a livello
del CYP-450, possono provocare fenomeni di tossicità:
* fluoxetina, paroxetina, fluvoxamina, trazodone,
nefazodone, antipsicotici, valproato.
Farmaci* che riducono i livelli plasmatici dei triciclici
per induzione del loro metabolismo a livello
del CYP-450, possono causare una mancanza di
efficacia terapeutica:
* barbiturici, carbamazepina, fenitoina.
Grado di inibizione degli SSRI
sulle isoforme del CYP-450
SSRI
1A/2
2C9/10
2C19
2D6
3A4
Escitalopram
-
-
-
-/+
-
Citalopram
-
-
-
+
-
Fluoxetina
-
-
++
+++
++
Fluvoxamina
+++
-
+++
+
++
Paroxetina
-
+
-
+++
-
Sertralina
-
-
+
+
-
Von Moltke et al., 2001; Brunello, 2003
Altri Antidepressivi:
Interazioni farmacocinetiche
• Nefazodone
> potente inibitore del CYP 3A4 e 2D6
• Mirtazapina
> debole inibitore dei CYP 1A2 e 3A4
• Venlafaxina
> debole inibitore dei CYP 1A2, 2D6, 3A4
• Reboxetina
> debole inibitore dei CYP - pochi dati disponibili
Fattori che influenzano le interazioni
a livello del CYP-450
Dose
farmaco
Indice terapeutico
substrato
Concentrazione
plasmatica
farmaco
Interazioni
CYP 450
Costante di
inibizione/
induzione
Polimorfismo
genetico
Tipo di enzima
“ Finalità “
del Trattamento Antidepressivo
• Riduzione dei Sintomi (Risposta)
• Prevenzione delle ricadute
• Prevenzione della ricorrenza
• Ripresa Funzionale (Remission)
L’obiettivo attualmente indicato dai ricercatori
come gold standard per la terapia di un disturbo
dell’umore è la completa rimozione dei sintomi
depressivi ovvero il raggiungimento della
guarigione clinica, con un ritorno alla condizione
di funzionamento premorboso.
Fase acuta
Trattamento psicoterapico
Trattamento farmacologico
Trattamento in associazione
Trattamento fisico (ECT et al)
Fase acuta:
Trattamento farmacologico
Nei pazienti con EDM di entità
grave o moderata, il trattamento
farmacologico rappresenta la
scelta
più
efficace.
Nelle
depressioni
psicotiche
oltre
all’AD
è
necessaria
la
combinazione con antipsicotici
Fase acuta: Mancata risposta
Per mancata risposta si intende un
inadeguato miglioramento dopo 6-8
settimane di trattamento.
…Rivalutazione
del
regime
terapeutico attuale.
Revisione radicale qualora non ci sia
ancora una risposta dopo 6-8
settimane.
Natura dell‟Intervento
Misure per raggiungere la Risposta/Remissione
• Algoritmi di Trattamento
– Ottimizzazione
– Sostituzione
– Combinazione
– Augmentation
Ottimizzazione
• Sforzi clinici per migliorare la risposta al
trattamento antidepressivo in corso:
– Aumentare la dose
– Estendere la durata
– Affrontare i problemi di compliance
– Minimizzare e gestire gli eventi avversi
– Ottimizzare i livelli plasmatici
Sostituzione
• La
sostituzione di un agente antidepressivo,
solitamente :
- Nell’ambito della classe (es. da SSRI a SSRI)
-
Con un farmaco con un profilo farmacologico
differente
- Studi in aperto supportano la pratica di sostituzione
nell’ambito della classe per la non tollerabilità o
risposta subottimale, ma tra classi la sostituzione
può assicurare una più rilevante efficacia
Combinazione
• L’uso concomitante di più
farmaci antidepressivi
Strategie di Combinazione
• SSRI e TCA
• SSRI e SNRI
• SSRI e SSRI
• SSRI e NRI
• SSRI e Bupropione
• AD e Antipsicotici Atipici
• TCA e MAOI
Nelson JC, J Clin Psychiatry, 2000
Augmentation
• L’aggiunta al trattamento antidepressivo in
corso di uno o più farmaci i quali da soli non
evidenziano una efficacia antidepressiva ma
accrescono la risposta antidepressiva o
riducono la latenza di risposta
Strategie di Augmentation
•Triptofano
•Ormoni Tiroidei
•Litio
•Buspirone
•Agenti Dopaminergici (es. pramipexolo)
•Estrogeni (donne in perimenopausa)
•Pindololo
•Anticonvulsivanti (es. lamotrigina)
Terapie Non-farmacologiche
• ECT
• Light therapy
• Deprevazione di sonno
• Psicoterapie (ad es. Terapia cognitiva)
• Trattamenti sperimentali (VNS, rTMS)
Non-Risposta agli Antidepressivi:
Valutazione del Paziente
• Non-compliance
• Avversità Psicosociali (stress)
• Errori diagnositici
- es. mania disforica, psicosi
• Comorbidità Psichiatrica
- es. Axis II, Abuso di sostanze
• Cause Mediche di Comorbidità
- es. endocrinopatia, medicazione
Risposta prolungata agli Antidepressivi
• Il Trattamento di Continuazione e Mantenimento
previene le recidive e le ricorrenze
• Il 10-25% delle recidive si verifica nel primo
anno nonostante trattamento continuato
• > 50% recidive si verifica entro 16 settimane
dall’interruzione del trattamento di continuazione
• Il 50-85% dei pazienti con MDD soffrirà di
ricorrenze
Depressione: Storia Naturale
Remissione
Guarigione
Nessun
Sintomo
Sintomi
Depressivi
Risposta
Sindrome
Depressiva
Fasi del Trattamento
Acuta
(6-12 sett.)
Continuazione Mantenimento
( 1 anno)
(4-9 mesi)
Adattato da Kupfer, 1991
Fase di Continuazione
Durante le 16-20 settimane che
seguono
la
remissione,
per
prevenire la ricaduta è necessario
proseguire con il trattamento
farmacologico assunto.
• Il trattamento continuativo con antidepressivi
riduce il rischio di ricadute all’incirca del
70%.
• I tassi medi di ricaduta nei soggetti trattati
con placebo sono del 41% rispetto al 18%
dei soggetti in trattamento attivo.
• L’efficacia profilattica del trattamento
sembra persistere anche a distanza di 36
mesi di terapia (benchè la metanalisi abbia
incluso trials della durata di 12 mesi).
(Geddes et al, 2003)
Obiettivi della terapia di mantenimento
Garantire la risoluzione di ogni sintomo residuo
Consentire al paziente il ritorno al funzionamento pre-morboso
Prevenire la ricaduta sintomatologica
Predittori di ricorrenza
•
•
•
•
•
•
•
•
Sesso femminile
Ansia concomitante, Psicosi, Depressione doppia
Elevato numero e durata di precedenti episodi
Esordio precoce della depressione
Esordio tardivo della depressione
Storia familiare, soprattutto se bipolare
Scarso funzionamento lavorativo
Persistenti sintomi residui sottosoglia
Quando avviare una terapia di
mantenimento?
3 o più episodi depressivi maggiori
2 episodi depressivi maggiori e una o più delle seguenti
caratteristiche:
-
anamnesi familiare per disturbi dell’umore
recidiva entro 1 anno dalla sospensione degli AD
elevato tasso di recidiva
lunga durata degli episodi
gravità degli episodi (inclusi sintomi psicotici e suicidalità)
esordio prima dei 20 anni e dopo i 60 anni
sintomatologia residua
comorbilità psichiatrica
Crismon et al, 1999; Bauer et al , 2002
Perché una terapia di mantenimento?
• Dei pazienti affetti da MDD circa il 50% avrà
ulteriori episodi
• La probabilità di presentare un nuovo
episodio è dell’80-90% dopo 3 episodi di
MDD
• Nei pazienti con episodi depressivi ricorrenti i
tassi di non-aderenza sono del 40-50%
• La prescrizione di AD a dosaggi subottimali e
per una durata non appropriata incrementa il
rischio di ricadute e recidive
• I clinici sperimentano spesso difficoltà nelle
gestione dei fattori legati alla scarsa
compliance
Ten Doesschate MC et al., Journal of Clinical Psychiatry, 2009
REMISSION
RELAPSE
HEALING
RECIDIVISM
Normalcy
RELAPSE
SYMPTOMS
--------------------------------------------------------SYNDROME
Treatment‟s
period
RESPONSE
Acute-phase
6-12 weeks
Prosecution
4-9 months
Maintenance
From 1 to > year
FULL-TIME
Kupfer. G. Neuropsich. Ger. Anno II – N. 1/2006
Durata della terapia di mantenimento
• Secondo le principali linee guida, la somministrazione di
antidepressivi dovrebbe essere protratta, oltre la fase acuta,
per un periodo non inferiore a un anno
• Questa procedura è indicata, in modo cogente, nelle
condizioni cliniche caratterizzate da permanenza di sintomi
residui dopo una risposta al trattamento, o dopo una
remissione, e dalla pre-esistenza di episodi recidivanti di
depressione nella storia clinica del paziente
P.L. Scapicchio., Giorn Ital Psicopat, 2008
Possibili Fattori di Ricaduta
Sintomi residui
Risposta similplacebo
Non compliance
Effetti indesiderati
Comorbidità
medica o
psichiatrica
“Poop out”
Perdita di
efficacia
Ricaduta
Errata diagnosi;
Sottotipi ad
elevato rischio
“Life events”
Supporto sociale
• È stata descritta una progressiva perdita di
efficacia nel tempo delle varie classi di AD,
sia TCAs che SSRIs
• Il fenomeno della tolleranza è ancora poco
compreso e non è possibile definire con
certezza quali ne siano le cause
• Oltre a quello della tolleranza, sono stati
descritti altri fenomeni correlati alla terapia
di mantenimento con AD quali resistenza,
sensibilizzazione, sindrome da sospensione
ed effetti «paradossi» con induzione o
peggioramento della sintomatologia
depressiva
Prescribed antidepressant class (%)
We choose differently depending
on
where we live
100
80
Combination
60
Other
40
TCA
SNRI
20
SSRI
0
All
Austria
Belgium
France Germany
Ireland
Italy Netherlands Sweden Switzerland UK
Data for Norway and Portugal are not presented separately due to small sample size, but are included in the overall sample
There are differences,
but our evidence base is the same
Bauer et al. Eur Psych 2008; 23: 66–73
Choose carefully!
Antidepressants are different
• Different in terms of:
– Efficacy
– Safety and tolerability
– Cost–effectiveness
Cipriani meta-analysis: Studies included
60
1991–
2007*
Number of trials
50
40
1993–
2007*
1993– 1994–
2007* 2007*
30
20
1991–
2007*
10
2000–
2007*
1993–
2007*
2002–
2007*
1993–
2006* 1994–
2003*
1997–
2005*
1997–
2006*
C
B
up
ro
p
io
n
ita
lo
pr
am
D
ul
ox
et
Es
in
ci
e
ta
lo
pr
am
Fl
uo
xe
tin
Fl
uv
e
ox
am
in
M
e
iln
ac
ip
ra
M
n
irt
az
ap
in
Pa
e
ro
xe
tin
R
e
eb
ox
et
in
e
Se
rt
ra
lin
Ve
e
nl
af
ax
in
e
0
2 three-arm studies comparing fluoxetine, paroxetine
and sertraline were included
*Earliest to latest year of publication
Cipriani et al., Lancet 2009 (E-pub ahead of print)
Cipriani Metanalysis: Response rate odds ratios –
fluoxetine as reference
Efficacy (response rate)
odds ratio: drug vs fluoxetine
1,6
*
1,4
1,2
1,0
*
0,8
*
*
*
0,6
0,4
0,2
C
B
up
ro
p
io
n
ita
lo
pr
am
D
ul
ox
et
in
Es
e
ci
ta
lo
pr
am
Fl
uv
ox
am
in
M
e
iln
ac
ip
ra
n
M
irt
az
ap
in
e
Pa
ro
xe
tin
e
R
eb
ox
et
in
e
Se
rt
ra
lin
Ve
e
nl
af
ax
in
e
0,0
Odds ratio >1 favours fluoxetine
*p<0.05
Cipriani et al., Lancet 2009 (E-pub ahead of print)
Cipriani meta-analysis: Drop-out rate odds ratios –
1,4
1,2
1,0
0,8
*
0,6
0,4
0,2
0,0
Bu
pr
op
io
n
Ci
ta
lo
pr
am
Du
lo
xe
tin
Es
e
ci
ta
lo
pr
am
Fl
uv
ox
am
in
e
M
iln
ac
ip
ra
n
M
ir t
az
ap
in
e
Pa
ro
xe
tin
e
Re
bo
xe
tin
e
Se
rtr
al
in
e
Ve
nl
af
ax
in
e
Acceptability (dropout rate)
odds ratio: drug vs fluoxetine
fluoxetine as reference
Odds ratio <1 favours fluoxetine
*p<0.05
Cipriani et al., Lancet 2009 (E-pub ahead of print)
antidepressants
efficacy and acceptability
1.25
Escitalopram
1.20
Sertraline
Bupropion
Acceptability (OR)
1.15
Citalopram
1.10
1.05
Fluoxetine
Mirtazapine
1.00
Venlafaxine
0.95
Paroxetine
0.90
Duloxetine
0.85
Fluvoxamine
0.80
0.8
0.9
1.0
1.1
1.2
1.3
1.4
Efficacy (OR)
OR=odds ratio, using fluoxetine as the reference medication
Acceptability = dropout rate; Efficacy = response rate
Adapted from Cipriani et al. Lancet 2009; 373: 746–758
(Source: Patrick et al. J Fam Pract 2009; 58: 365–369)
Which antidepressants have
demonstrated superiority?
Background
• An international group of experts
met to assess published evidence
• Searches in Medline and Embase
databases
and discussion with experts in the
field
• Randomised, controlled trials and
meta-analyses comparing two
antidepressants under conditions of
fair comparison
Montgomery et al. Int Clin Psychopharmacol 2007; 22: 323–329
Superior antidepressants
• Defined as two or more studies showing
superiority to another antidepressant in
a fair comparison
• Only three antidepressants are clearly
superior in efficacy:
Escitalopram
Clomipramine
Venlafaxine
Montgomery et al. Int Clin Psychopharmacol 2007; 22: 323–329
Depressed elderly patients often
suffer
from other illness
Late-life depression prevalence is higher in those patients
with other medical illness
30–50% of patients with
Alzheimer‟s disease
27% of patients with stroke
Alzheimer‟s
disease
Stroke
DEPRESSION
Chronic pain
Cardiovascular
diseases
Diabetes
20–30% of patients with
chronic pain
16–23% of patients with
cardiovascular diseases
9–27% of patients with
diabetes
Comorbid diseases need to be considered when prescribing an antidepressant
Dolder et al. ADIS, Drugs Aging 2010; 27: 625–640; Chemali et al. Harv Rev Psychiatry 2009; 17: 242–253
Elderly patients are often taking
concomitant medication
66–75 years (n=1,295)
>75 years (n=755)
261 (20.2%)
79 (10.5%)
1,034 (79.8%)
676 (89.5%)
Psychotropics
192 (14.8%)
130 (17.2%)
Cardiovascular
Beta-blockers
878 (67.8%)
269 (20.8%)
630 (83.4%)
165 (21.9%)
263 (20.3%)
258 (34.2%)
50 (3.9%)
34 (4.5%)
Anti-diabetics
256 (19.8%)
151 (20.0%)
Statins
168 (13.0%)
87 (11.5%)
NSAIDs
152 (11.7%)
120 (15.9%)
28 (2.2%)
35 (4.6%)
Patients with comedication
No
Yes
Diuretics
Anti-arrythmics
Coumarin derivatives
2,050 German elderly outpatients with depression; naturalistic setting
Möller et al. Pharmacopsychiatry 2010; 43: 210–215
DECORSO CLINICO
nell’anziano
Il decorso clinico della depressione dell’anziano ,ovvero
dopo 60-65 anni,e’ diverso da quello dei giovani:la
durata degli episodi depressivi è maggiore(12-48 mesi
vs.4-5)e la probabilità di recidiva entro i primi 24 mesi
dall’esordio del 1° episodio è di circa il 70%. Fattori di
prognosi sfavorevole sono la gravità e durata
dell’episodio,la presenza di malattie somatiche croniche
e la presenza di patologia cerebrovascolare.
Treatment myths
Some well-known
examples
• Antidepressants don’t work
• All antidepressants are equally
efficacious
• Suicide risk is increased by
antidepressants
• Drug costs are very important
It has been said that:
“Antidepressant plasma
levels do not
correlate with
clinical response”
It has been said that:
“Depression in late life
is more difficult to
treat than depression at
younger ages”
Quale medico
per i pazienti con Sintomi senza Malattia?
“Sono diventato medico
per curare le malattie,
non i malati”
Gregory House, MD
Plainsboro Teaching Hospital - Princeton
Quale medico
per i pazienti con Sintomi senza Malattia?
“ I dottori non curano,
loro fanno diagnosi.
Noi curiamo”
Jackie Peyton, nurse,
All Saints Hospital - New York
GRAZIE A TUTTI
PER L’ATTENZIONE
VIERI SORDI
FARMACOTERAPIA DEI
DISTURBI DELL’UMORE
Gli antipsicotici
e
Gli stabilizzatori del tono dell’umore
INIBITORI DUPLICI DELLA RICAPTAZIONE DELLA
SEROTONINA E DELLA NORADRENALINA
Agenti a duplice azione e
SELETTIVI per tale azione
Non hanno proprietà alfa1, colinergica o di blocco
del rec. dell’istamina
INIBITORI DUPLICI DELLA RICAPTAZIONE DELLA
SEROTONINA E DELLA NORADRENALINA
VENLAFAXINA
EFEXOR 75, 150 mg RP
DULOXETINA
CYMBALTA 60 mg
XERISTAR 60 mg
STABILIZZATORI DEL TONO DELL‟UMORE
LITIO
ANTICONVULSIVANTI
VALPROATO DI SODIO
CARBAMAZEPINA
LAMOTRIGINA
ALTRI
ANTIPSICOTICI
GABAPENTIN
TOPIRAMATO
“STABILIZZATORE DEL TONO DELL’UMORE”
1. Efficace nel prevenire le recidive di mania e
depressione
2. Efficace nello stabilizzare i cicli rapidi
3. Efficace nel trattamento di mania e depressione
4. Non determina switch verso la polarità opposta
CARBONATO di LITIO: MECCANISMI D’AZIONE
•
•
•
•
•
•
•
Stabilizzazione di Membrana
Variazione della Trasmissione Ionica
Effetti sulla Trasduzione del Segnale
Effetti sulla Trasmissione Genica
Effetti sulla Neurotrasmissione
Rallentamento del Ritmo Circadiano
Inibizione dei Sistemi Endocrini
CARBONATO di LITIO: MECCANISMI D’AZIONE
• EPISODI di IPOMANIA e MANIA
• EFFICACE NLLA PREVENZIONE DEGLI EPISODI
RICORRENTI DELLA MALATTIA
• EFFICACE NEL TRATTARE E NEL PREVENIRE
EPISODI DI DEPRESSIONE IN PZ AFFETTI DA
DISTURBO BIPOLARE
CARBONATO di LITIO: EFFETTI COLLATERALI
Side Effects
of Lithium
Li+
•
•
•
•
•
Cognitive
Tremor
Gastrointestinal
Weight gain
Endocrine
– Thyroid
MONITORAGGIO DEI
LIVELLI PLASMATICI
(0.7 -1.2)
– Parathyroid
•
•
•
•
Dermatologic
Teratogenicity
Renal function
Cardiac function
CARBONATO di LITIO: SINTOMI PRECOCI DI
TOSSICITA’
Poliuria
Nausea
Vomito
Diarrea
Eloquio impastato
Visione offuscata
Tinnito
Tremori
Vertigini
Debolezza
Confusione
Instabilità
MONITORAGGIO DEL TRATTAMENTO CON IL LITIO
Dosaggio quotidiano dei livelli plasmatici di litio fino alla
stabilizazione
Per I prime tre mesi dopo la stabilizzazione del tasso
plasmatico bisognerebbe controllarlo mensilmente, e in
seguito ogni 4-6 settimane
La creatinina e il TSH plasmatico dovrebbero essere
controllati ogni 4-6 mesi
Profilassi con litio a 24 mesi n=101 pz
Il problema dei drop-outs
• Interrompono la terapia con il Litio
32%
• Recidive durante terapia con litio
20%
• Nessuna recidiva
34%
• Coterapia con Neurolettici/Antidepressivi
79%
ANTICONVULSIVANTI
Agiscono sui canali ionici del sodio, potassio e calcio
Modulano gli effetti del GABA aumentandone la sintesi, il
rilascio, inibendo il suo catabolismo, riducendo la sua
ricaptazione
Riducono
la
GLUTAMMATO
neurotrasmissione
eccitatoria
del
VALPROATO
Trattamento della mania
Terapia di mantenimento nei pz bipolari
Pz in stato misto e con cicli rapidi
VALPROATO
EFFETTI
COLLATERALI
INTERAZIONI
• Dose dipendente
– astenia
– sedazione
– trombicitopenia
Inibizione
citocromo P-450
– tremore
– aumento di peso
• Non dose
dipendente
– alopecia
– Ovaio policistico
•aspirina
•carbamazepina
•lamotrigina
•clozapina
•clonazepam
•diazepam
CARBAMAZEPINA E OXCARBAMAZEPINA
Trattamento della mania
Efficace per l’aggressività e l’irritabilità
Terapia di mantenimento nei pz bipolari
CARBAMAZEPINA E OXCARBAMAZEPINA
EFFETTI
COLLATERALI
•
•
•
•
•
•
•
Attivazione
sedazione
citocromo P-450
atassia
sdoppiamento vista
agranulocitosi
epatotossicità (rara)
rush cutanei (10%)
iponatremia (5-40%)
Anemia aplastica
Agranulocitosi
INTERAZIONI
TENDENZA AD INCREMENTARE IL
METABOLISMO E L’ELIMINAZIONE
DI
DIVERSI
FARMACI,
ATTRAVERSO
L’INDUZIONE
DEGLI
ENZILI
METABOLICI
EPATICI
OLANZAPINA
Dose media di circa 15 mg/die in acuto; 5-15 mg/die nel lungo termine
QUETIAPINA
RISPERIDONE
Efficacia a breve termine vs efficacia a
lungo termine
Breve termine
Depressione
Mania
Lungo termine
Depressione
Mania
Litio
(+)
++
+
++
Valproato
(?)
++
(+)
(+)
CBZ
(+)
(+)
(+)
(-)
Olanzapina
+
++
+
++
Lamotrigina
+
--
++
(+)
ANTIPSICOTICI
DOPAMINA
Vi sono quattro circuiti dopaminergici nel cervello.
La neuroanatomia dei circuiti dopaminergici cerebrali può
spiegare sia gli effetti terapeutici che quelli collaterali dei farmaci
antipsicotici
DOPAMINA
- Circuiti dopaminergici NIGROSTRIATALI: dalla substantia nigra ai nuclei
della base. Controllano i movimenti.
- Circuiti dopaminergici MESOLIMBICI: dalla area tegmentale ventrale
mesencefalica al nucleo accumbens. Controllano le sensazioni si piacere,
l’euforia, i deliri, le allucinazioni.
- Circuito dopaminergico MESOCORTICALE: area tegmentale ventrale
mesencefalica alla corteccia limbica. Controlla i sintomi positivi e negativi e gli
effetti collaterali cognitivi degli antisicotici. area tegmentale ventrale
mesencefalica
- Circuito dopaminergico TUBEROINFUNDIBULARE:
all’adenoipofisi. Controlla la secrezione di prolattina.
dall’
ipotalamo
IPOTESI DOPAMINERGICA DELLE PSICOSI
IPERATTIVITA’ DEI NEURONI DELLA DOPAMINA NEL CIRCUITO
DOPAMINERGICO MESOLIMBICO DETERMINEREBBE SINTOMI
QUALI DELIRI E ALLUCINAZIONI,etc…
ANTIPSICOTICI TRADIZIONALI
BLOCCO DEI RECETTORI DELLA DOPAMINA D2
BLOCCO DEI RECETTORI MUSCARINICI M1
BLOCCO DEI RECETTORI α1-ADRENERGICI
BLOCCO DEI RECETTORI DELL’ISTAMINA H1
ANTIPSICOTICI TRADIZIONALI
IPOTESI
DELL’ANTAGONISMO
RECETTORIALE
DOPAMINERGICO
ALLA
BASE
DELL’AZIONE
FARMACOLOGICO DEGLI ANTIPSICOTICI
Blocco dei recettori post-sinaptici della dopamina nel circuito
mesolimbico
ANTIPSICOTICI TRADIZIONALI
Aloperidolo
Haldol Serenase
Clorpromazina
Largactil
Clotiapina
Entumin
Promazina
Talofen
Perfenazina
Trilafon
Droperidolo
Sintodian
Fiale 5mg
5-10mg/h max 60mg/die ev/im
Fiale 50mg
30-150mg/die im
Fiale 40mg
100-120mg/die ev/im
Fiale 50mg
300-600mg/die ev/im
Fiale 5mg im
1-3/die in amb
1-4/ die in osp
Fiale 2.5mg ev/im
10-25mg/die im in forme gravi
2.5-7.5mg/3 vv die ev
12.5-25mg in flebo/1-2 vv die
ANTIPSICOTICI TRADIZIONALI
VANTAGGI
POCO COSTOSI
EFFICACI SUI SINTMI POSITIVI e NEGATIVI
DISPONIBILI PER VIA PARENTERALE E DEPOT
ANTIPSICOTICI TRADIZIONALI
EFFETTI COLLATERALI
Blocco dei recettori dopaminergici delle
PROIEZIONI NIGROSTRIATALI
DISTURBI del MOVIMENTO
Blocco dei recettori dopaminergici delle
PROIEZIONI MESOCORTICALI
SINTOMI NEGATIVI
Blocco dei recettori dopaminergici delle
PROIEZIONI TUBEROINFUNDIBULARE
IPERPROLATTINEMIA, GALATTORREA,
DISFUNZIONI SESSUALI
ANTIPSICOTICI TRADIZIONALI
EFFETTI COLLATERALI
BLOCCO DEI RECETTORI
MUSCARINICI M1
STIPSI, VISIONE OFFUSCATA,
SECCHEZZA DELLE FAUCI,
SONNOLENZA
BLOCCO REC. H1
INCREMENTO
PONDERALE,
SONNOLENZA
E
α-1
VERTIGINI,
IPOTENSIONE,
SONNOLENZA
LIMITI DEGLI ANTIPSICOTICI TIPICI
Insufficiente
risposta
nel 20-40% dei pazienti
terapeutica
Limitata efficacia sui sintomi negativi
Effetti extrapiramidali ed iperprolattinemia
SINDROME MALIGNA DA NEUROLETTICI (SMN)
• Grave Rigidità Muscolare ( CPK )
• Alterazioni Autonomiche (ipertermia, tachicardia,
ipertensione arteriosa, tachipnea, diaforesi)
• Modificazione dei Livelli di Coscienza (da
confusione a coma)
• Si sviluppa entro 3-5 gg e dura 5-10 gg dopo la
sospensione del NRL
• Frequenza=0,1% pz
Mortalità 20-30%
Effetti
anticolinergici
Iperprolattinemia
Sedazione
Discinesia
tardiva
Effetti
extrapiramidali
Ipotensione
Effetti collaterali
degli antipsicotici
Prolungamento del
tratto QTc
Convulsioni
Alterazioni della
crasi ematica
Iperlipidemia
Aumento
ponderale
Diabete
ANTIPSICOTICI ATIPICI
DUPLICE AZIONE FARMACOLOGICA CON ANTAGONISMO
DELLA SEROTONINA E DELLA DOPAMINA (SDA): 5HT2A, D2
LA SEROTONINA CONTRASTA IL RILASCIO DELLA DOPAMINA
NEL CIRCUITO NIGROSTRIATALE e in quello INFUNDIBULARE
ANTIPSICOTICI ATIPICI
Sblocco dei recettori D2 e 5HT2A con gli antagonisti
serotonina-dopamina (SDA) nella via nigrostriale
I recettori della dopamina
sono bloccati dagli SDA
Sblocco parziale dei recettori
dopaminergici da parte degli SDA
Recettore D2
Recettore
5HT2A
Scarsi EPS e DT
La dopamina può competere
con gli SDA per l‟occupazione
dei recettori D2
ANTIPSICOTICI ATIPICI
Sblocco dei recettori D2 e 5HT2A con gli antagonisti
serotonina-dopamina (SDA) nella via tuberoinfundibolare
Recettore 5HT2A
La serotonina
stimola la
secrezione di
prolattina
Recettore D2
P
P
Prolattina
Ipofisi
Dopamina
Serotonina
P
SDA
P
Il legame della
dopamina con i
recettori D2 inibisce
il rilascio di prolattina
P
P
L‟antagonismo della
serotonina controbilancia
l‟effetto del blocco dei
recettori D2
P
ANTIPSICOTICI ATIPICI
Antagonismo recettoriale 5-HT2A/D2 (maggiore
affinità per i recettori 5-HT2A che per i recettori D2)
Maggiore affinità per i recettori D2 mesolimbici e
mesocorticali rispetto a quelli nigrostriatali
Azione su altri recettori (5-HT1A, 5-HT3, 5-HT6,
5-HT7,
adrenergico,
colinergico
muscarinico,
NMDA, GABA)
Rapida dissociazione dal recettore dopaminergico D2
ANTIPSICOTICI ATIPICI
Antagonisti multirecettoriali (MARTA)
Clozapina
Olanzapina
Quetiapina
Antagonisti 5-HT2/D2 (SDA)
Risperidone
Ziprasidone
Antagonisti selettivi D2-D3-D4
Amisulpiride
Profilo recettoriale degli antipsicotici
Olanzapina
Clozapina
Risperidone
Quetiapina
Aloperidolo
Bymaster FP, et al. Neuropsychopharmacology. 1996;14(2):87-96.
Schotte A, et al. Psychopharmacology (Berl). 1996;124(1-2):57-73.
Lawler, C, et al. Neuropsychopharmacology. 1999;20(6):612-27.
Corbett, R, et al. CNS Drug Reviews. 1997;3(2):120-47.
D1
D4.2
D2
5-HT2A
5-HT2C
5-HT1A
5-HT6
a1
a2
Musc
H1
Ridotta tendenza
ad indurre EPS
ed
iperprolattinemia
Antipsicotici
atipici
Spettro di
efficacia
più ampio
ANTIPSICOTICI ATIPICI
Neurologic
i
Effetti extrapiramidali
Convulsioni
Endocrini
Iperprolattinemia
Metabolic
i
Aumento ponderale
Iperglicemia e Diabete
Iperlipidemia
Cardiaci
Prolungamento del QTc
ANTIPSICOTICI ATIPICI
VANTAGGI
MINORI EPS
MINORE DISCINESIA TARDIVA
MINORE IPERPROLATTINEMIA
MAGGIORE COMPLIANCE
MINORI OSPEDALIZZAZIONE
ANTIPSICOTICI ATIPICI
CLOZAPINA
Molto efficace ma la più pericolosa
Può causare agranulocotosi (0.5-2%)
Monitoraggio ematologico settimanale per 6 mesi ed ogni 2
settimane in seguito
Determina convulsioni dose-dipendenti
Marcato incremento ponderale
Sedazione
Scialorrea soprattutto notturna
TRATTAMENTO CON BDZ: TRATTAMENTO SINTOMATICO
Il trattamento ha una funzione sintomatica e non
patogenetica.
Il trattamento prolungato può indurre un fenomeno di
tolleranza con successiva possibilità di dipendenza e
abuso.
Indicazione per il trattamento a breve termine
dell‟ansia (8-12 settimane).