2.6
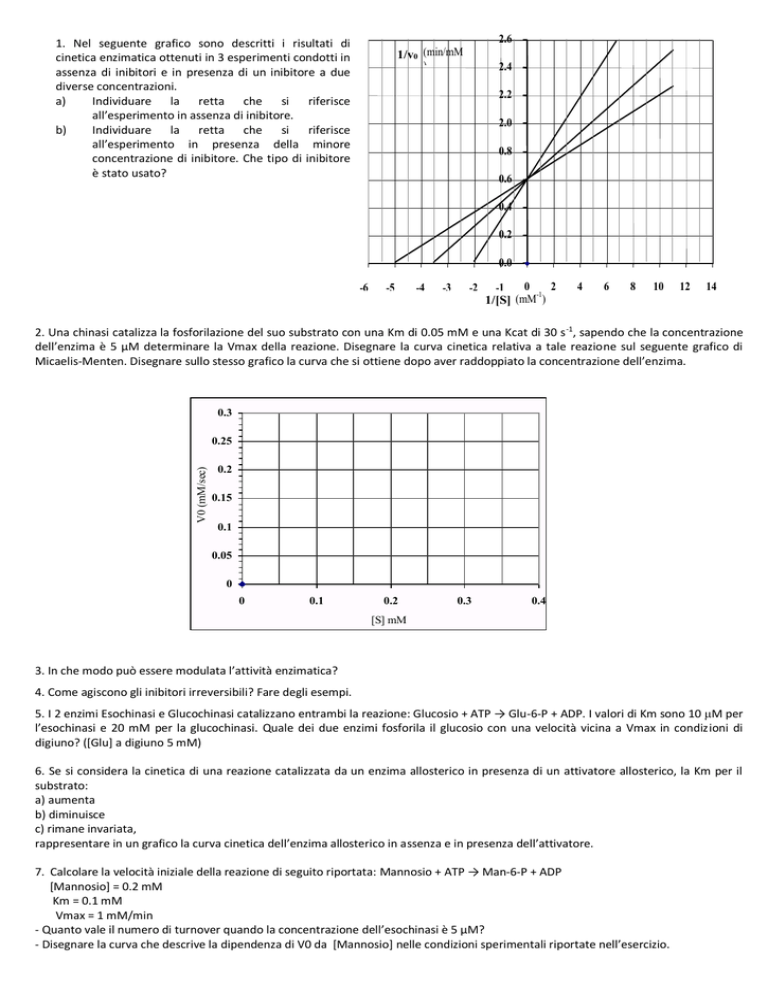
1. Nel seguente grafico sono descritti i risultati di
cinetica enzimatica ottenuti in 3 esperimenti condotti in
assenza di inibitori e in presenza di un inibitore a due
diverse concentrazioni.
a)
Individuare la retta che si riferisce
all’esperimento in assenza di inibitore.
b)
Individuare la retta che si riferisce
all’esperimento in presenza della minore
concentrazione di inibitore. Che tipo di inibitore
è stato usato?
1/v0 (min/mM
)
2.4
2.2
2.0
0.8
0.6
0.4
0.2
0.0
-6
-5
-4
-3
-2
0
2
-1
-1
1/[S] (mM )
4
6
8
10
12
14
2. Una chinasi catalizza la fosforilazione del suo substrato con una Km di 0.05 mM e una Kcat di 30 s -1, sapendo che la concentrazione
dell’enzima è 5 μM determinare la Vmax della reazione. Disegnare la curva cinetica relativa a tale reazione sul seguente grafico di
Micaelis-Menten. Disegnare sullo stesso grafico la curva che si ottiene dopo aver raddoppiato la concentrazione dell’enzima.
0.3
V0 (mM/sec)
0.25
0.2
0.15
0.1
0.05
0
0
0.1
0.2
0.3
0.4
[S] mM
3. In che modo può essere modulata l’attività enzimatica?
4. Come agiscono gli inibitori irreversibili? Fare degli esempi.
5. I 2 enzimi Esochinasi e Glucochinasi catalizzano entrambi la reazione: Glucosio + ATP → Glu-6-P + ADP. I valori di Km sono 10 μM per
l’esochinasi e 20 mM per la glucochinasi. Quale dei due enzimi fosforila il glucosio con una velocità vicina a Vmax in condizioni di
digiuno? ([Glu] a digiuno 5 mM)
6. Se si considera la cinetica di una reazione catalizzata da un enzima allosterico in presenza di un attivatore allosterico, la Km per il
substrato:
a) aumenta
b) diminuisce
c) rimane invariata,
rappresentare in un grafico la curva cinetica dell’enzima allosterico in assenza e in presenza dell’attivatore.
7. Calcolare la velocità iniziale della reazione di seguito riportata: Mannosio + ATP → Man-6-P + ADP
[Mannosio] = 0.2 mM
Km = 0.1 mM
Vmax = 1 mM/min
- Quanto vale il numero di turnover quando la concentrazione dell’esochinasi è 5 μM?
- Disegnare la curva che descrive la dipendenza di V0 da [Mannosio] nelle condizioni sperimentali riportate nell’esercizio.
4.0
1.1
1
0.9
0.8
0.7
0.6
0.5
0.4
0.3
0.2
0.1
0
3.5
3.0
1/V0 (min/mM)
V0 (mM/min)
- Disegnare la curva ottenuta in presenza di un inibitore incompetitivo, commentando brevemente le scelte fatte.
- Tracciare il corrispondente grafico dei doppi reciproci.
2.5
2.0
1.5
1.0
0.5
0.0
0.1
0.2
0.3
0.4
0.5
0.0
0.6
-12 -10 -8 -6
-4 -2
[S] mM
0
2
4
6
8
10 12 14
-1
[1/S] mM
8. Le due rette del seguente grafico descrivono i risultati di un esperimento condotto utilizzando due diverse concentrazioni dello
stesso enzima. Il substrato utilizzato era lo stesso nei due esperimenti.
- Dire in quale dei due esperimenti è stata utilizzata la minore concentrazione di enzima.
- Disegnare le corrispondenti curve cinetiche sul grafico di Micaelis-Menten.
1.8
A
1.5
1.2
0.9
0.6
0.3
0.0
-6 -5 -4 -3 -2 -1
0
1
2
[1/S] mM
3
4
5
6
7
8
9 10
-1
1.40
1.12
V0 (mM/min)
1/V0 (min/mM)
B
0.84
0.56
0.28
0
0
0.2
0.4 0.6
0.8 1.0
1.2 1.4
1.6 1.8
2.0
9. Calcolare la vmax della reazione di seguito riportata sapendo la concentrazione dell’enzima Fumarasi corrisponde a 5x10 -9 M e la kcat
vale 8,0x102 sec-1.
Fumarato → Malato
Calcolare inoltre la velocità iniziale della reazione ad una concentrazione di fumarato pari a 10 -5 M sapendo che la KM vale 5,0x10-6 M.
10. Nel seguente grafico dei doppi reciproci sono riportati i dati cinetici di una reazione enzimatica condotta in presenza ed in assenza
di un inibitore. Indicare quali variabili sono riportate sui due assi e disegnare il grafico di Michaelis-Menten corrispondente.
Sul grafico di Michaelis-Menten individuare la curva che si riferisce all’esperimento condotto in presenza dell’inibitore e stabilire di
quale tipo di inibizione si tratta.
(min/mM)
4.0
0.7
3.5
0.63
0.56
3.0
(mM/min)
0.49
2.5
2.0
0.42
0.35
0.28
1.5
0.21
1.0
0.14
0.07
0.5
0
0
0.0
-12 -10 -8
-6
-4
-2
0
2
4
6
8
10 12 14
0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45 0.5 0.55 0.6 0.65
mM
11. Quanti tipi di meccanismi di catalisi consentono agli enzimi di diminuire l’energia di attivazione della reazione da loro catalizzata?
Elencarli ed illustrarne brevemente uno.
12. Dal grafico di seguito riportato, che descrive la dipendenza della velocità di reazione enzimatica dalla concentrazione del substrato,
ricavare i seguenti parametri, sapendo che la concentrazione dell’enzima è pari a 10-3 M.
a. Km
b. Vmax
c. kcat
10
9
8
7
6
5
4
3
2
1
0
0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5 6
Disegnare sullo stesso grafico la curva che descrive i risultati ottenuti in presenza di un inibitore competitivo.
13. Quali sono i composti fosforici così detti a bassa energia e ad alta energia? Qual’è il loro ruolo nel metabolismo?
14. La reazione: fosfoenolpiruvato + ADP + H+ → piruvato + ATP
ha un ΔG0’ di -31 KJ/mole. Calcolare il ΔG0’ di idrolisi del fosfoenolpiruvato sapendo che la variazione di energia libera di
idrolisi dell’ ATP corrisponde a - 30.5 KJ/mole.
15. Sapendo che la seguente idrolisi: creatina-P → creatina + Pi ha un ΔG0’ = -10 Kcal/mole, e che l’idrolisi dell’ATP ha un
ΔG0’ = -7.3 Kcal/mole. Calcolare il ΔG0’ totale della reazione:
ADP + creatina-P →ATP + creatina.
16. Nella glicolisi la conversione del glucosio in fruttosio-1,6-bisfosfato è un processo che avviene in 3 tappe:
glucosio + ATP → glucosio-6-P + ADP
ΔG0’ = -16.7 KJ/mole
glucosio-6-P → fruttosio-6-P
ΔG0’ = +1.7 KJ/mole
fruttosio-6P → fruttosio-1,6-bisfosfato
ΔG0’ = -14 KJ/mole
0
considerando i ΔG ’ riportati calcolare la variazione di energia libera in condizioni standard del processo globale.
17. Scegliere il o i composti la cui reazione di idrolisi può essere accoppiata alla reazione ADP + Pi → ATP (ΔG 0’ = +30.5
KJ/mole) in modo tale da avere un processo globalmente esoergonico.
FOSFOENOLPIRUVATO
ΔG0’ = -61.9 KJ/mole
PPi
ΔG0’ = -19.3 KJ/mole
GLUCOSIO 6-P
ΔG0’ = -15.9 KJ/mole
GLUCOSIO 1-P
ΔG0’ = -20.9 KJ/mole
ACETIL-CoA
ΔG0’ = -31.4 KJ/mole
18. Considerando la seguente reazione: Malato + NAD+
Ossalacetato + NADH + H+
E noti i potenziali di riduzione standard delle coppie redox:
Ossalacetato + 2H+ + 2eMalato E°’ = - 0.166 V
NAD+ + H+ + 2 eNADH
E°’ = - 0.315 V
Calcolare il ΔG°’ e dire se la reazione è spontanea. (F = 96.5 KJ/V •mole)
19. Date le seguenti coppie redox di cui sono riportati i valori di E0’ ordinare le coppie in modo che gli elettroni fluiscano
spontaneamente dalla prima coppia verso l’ultima. Calcolare la variazione di energia libera standard per il processo
relativo al trasferimento di 2 elettroni dalla prima all’ultima coppia.
UBICHINONE/ UBICHINOLO
E 0’ = + 0.05 V
FMN/FMNH2
E0’ = - 0.30 V
NAD+/NADH
E0’ = - 0.32 V
Centro Fe-S
E 0’ = - 0.15 V
20. Data la reazione: Piruvato + NADH + H+ Lattato + NAD+
e noti i potenziali standard di riduzione delle 2 semireazioni: Piruvato + 2e- +2H+ lattato
NAD+ + 2e- +2H+ NADH + H+
Dire se la reazione avverrà spontaneamente in condizioni standard.
21. Data la seguente reazione: ACETALDEIDE + NADH + H+
ETANOLO + NAD+
CONSIDERANDO I SEGUENTI POTENZIALI STANDARD DI RIDUZIONE: ACETALDEIDE / ETANOLO
NAD+/ NADH + H+
LA REAZIONE E’ SPONTANEA IN CONDIZIONI STANDARD?
22. CALCOLARE IL ΔG°’ PER LAREAZIONE: SUCCINATO + FAD → FUMARATO + FADH2
Fumarato/Succinato
E0’ = 0.03 V
FAD/FADH2
E0’ = 0.0 V
(E°’ = - 0.185 V)
(E°’ = - 0.315 V)
E0’ = - 0.20 V
E0’ = - 0.32 V
SAPENDO CHE:
23. Calcolare la variazione di energia libera della seguente reazione in condizioni standard:
Glucosio-6P + ADP → Glucosio + ATP
sapendo che i ∆G°’ delle semireazioni nel senso dell’idrolisi sono: - 30.5 kJ/mole per ATP → ADP + Pi;
- 13.8 kJ/mole per Glucosio-6P → Glucosio + Pi.
Dire se la reazione è spontanea.
24. Data la reazione:
Ossalacetato + Succinato → malato + fumarato
in cui il succinato viene ossidato a fumarato, calcolare la variazione di energia libera in condizioni standard
sapendo che ciascuna coppia scambia 2 elettroni e i potenziali di riduzione standard valgono:
Ossalacetato/malato (E°’ = - 0.166 V)
Fumarato/succinato (E°’ = +0.031)
(F = 96.5 kJ/V∙mole)
25. Di seguito sono riportati i potenziali di riduzione standard di alcune coppie redox, ordinarle in maniera tale da ottenere
un flusso spontaneo di 2 elettroni attraverso di essi e calcolare la ΔG°’ del processo globale.
Ossalacetato/malato
FMN/FMNH2
α-chetoglutarato/isocitrato
Acetaldeide/Etanolo
citocromo a3(ox)/citocromo a3(rid)
UBICHINONE/ UBICHINOLO
E°’ – 0.166 V
E0’ – 0.30 V
E°’ – 0.38 V
E°’ – 0.197 V
E°’ +0.35 V
E0’ + 0.05 V
26. Il potenziale di riduzione standard del NADH a NAD+ è – 0.32 V e quello dell’ Ubichinone a ubichinolo è + 0.04 V. Noti
questi due valori
a) valutare se l’ossidazione del NADH da parte dell’ubichinone liberi energia sufficiente per la sintesi di una molecola di
ATP, in condizioni standard. (ΔG°’ idrolisi di ATP = -31kJ/mole)
F (costante di Faraday) = 96,5 kJ/V×mole.
b) indicare quanti elettroni sono scambiati nella reazione di ossidoriduzione specificando la struttura della porzione
reattiva del NAD nella forma ossidata e ridotta.
27. Di seguito sono riportati i potenziali di riduzione standard di alcune coppie redox, ordinarle in maniera tale da ottenere
un flusso spontaneo di elettroni attraverso di essi e calcolare la ΔG°’ del processo globale.
Fe+3/Fe+2 (Centro Fe-S)
E°’ – 0.15 V
+
NADP /NADPH
E°’ – 0.32 V
FAD/FADH2
E°’ – 0.22 V
α-chetoglutarato/isocitrato
E°’ -0.38 V
Acetaldeide/Etanolo
E°’ - 0.197 V
citocromo b(ox)/citocromo b(rid)
E°’ +0.07 V
citocromo a3(ox)/citocromo a3(rid) E°’ +0.35 V
28. Scrivete la struttura dell’1,3-bisfosfoglicerato e illustrate i motivi termodinamici per i quali l’energia libera standard di
idrolisi del fosfato di questa molecola è molto elevato.
29. Quali sono i composti la cui energia libera standard di idrolisi viene accoppiata alla fosforilazione dell’ADP nei processi
metabolici a voi noti? Dopo averli elencati, sceglietene uno, scrivetene la struttura e spiegate brevemente perché la sua
idrolisi è esoergonica.
30. Data la concentrazione dei metaboliti di seguito riportata:
Fruttosio 6-P
Fruttosio 1,6-bisfosfato
ATP
ADP
87
22
11400
1320
MicroM
MicroM
MicroM
MicroM
e noti i valori di variazione di energia libera standard delle reazioni:
Fruttosio 1,6-bisfosfato → Fruttosio 6-P + Pi G0’ = - 16.5 KJ/mole
ATP
→ ADP + Pi
G0’ = - 31.0 KJ/mole
Calcolare il valore del G’ della reazione:
PFK1
→
Fruttosio 6-P
ATP
Fruttosio 1,6-bisfosfato
ADP
31. Quale/i affermazione/i non sono vere?
La variazione di energia libera (G’) :
a. Dipende dalla concentrazione dei reagenti e dei prodotti.
b. È uguale a zero all’equilibrio
c. È uguale a –RT ln Keq
32. Dati i valori di E°’ delle seguenti semireazioni di riduzione:
Ossalacetato+ 2e- + 2H+ Malato
- 0.166 V
+
+
NAD + 2e + 2H NADH
- 0.320 V
e la reazione
Malato + NAD+ ← Ossalacetato + NADH
dire se la reazione procederà spontaneamente nel verso in cui è stata scritta in condizioni standard:
e alle seguenti concentrazioni di reagenti e prodotti:
[Ossalacetato] = 1 microM
[Malato] = 1 mM
[NAD+] = 0.1 mM
[NADH] = 1 microM
(F=96.5 kJ/V*mole)
33. Data la reazione:
piruvato + 2 [centro Fe-S(Fe2+)] lattato + 2 [centro Fe-S(Fe3+)]
in cui il piruvato viene ridotto a lattato, calcolare la variazione di energia libera in condizioni standard e alle
concentrazione di reagenti e prodotti di seguito riportate:
[piruvato] = 0.02M
[lattato] = 0.002M
[centro Fe-S(Fe3+)] = 0.02M
[centro Fe-S(Fe2+)] = 0.002M
sapendo che i potenziali di riduzione standard valgono:
piruvato/lattato
E0’ = – 0.19 V
centro Fe-S(Fe2+)/centro Fe-S(Fe3+) E°’ = – 0.15 V
(F = 96.5 kJ/Vmole)
(R= 8.3 J/Kmole)
34. Calcolare la variazione di energia libera della seguente reazione in condizioni standard:
Glutammato + NH3 + ATP
Glutammina + ADP + Pi
e alle seguenti concentrazioni:
[Glutammina] = 10 mM
[ATP] = 0.2 mM
[ADP] = 5 mM
[Glutammato] = 2 mM
sapendo che:
ATP ADP + Pi (G°’= - 30.5 kJ/mole)
Glutammato + NH3 Glutammina (G°’= + 14.5 kJ/mole)
Dire se la reazione è spontanea nelle due condizioni.
35. L’enolasi catalizza la seguente reazione:
2-FOSFOGLICERATO ↔ FOSFOENOLPIRUVATO + H2O
il cui ΔG°’ in condizioni standard è + 1.7 KJ/mol.
Calcolare la variazione di energia libera nelle seguenti condizioni:
pH 7.0, 25°C
[2-FOSFOGLICERATO] = 80 mM
[FOSFOENOLPIRUVATO] = 8 mM
36. Determinate in quale verso procede spontaneamente la reazione di seguito riportata:
ADP + Fosfocreatina
ATP + Creatina
Nelle seguenti condizioni: 25 °C, pH 7.0, [ATP] = 4 mM, [ADP] = 0.15 mM, [fosfocreatina] = 2.5 mM, [creatina] = 1
mM.
ΔG°’ di idrolisi della fosfocreatina = -43.1 KJ/mol
ΔG°’ di idrolisi dell’ATP = - 30.5 KJ/mol
R = 8.3x 10-3 KJ/mol.
37. Calcolare il ΔG°’ della reazione:
FADH2 + AC. LIPOICO
FAD + AC. DIIDROLIPOICO
Sapendo che:
FAD + 2H+ + 2eFADH2
AC. LIPOICO + 2H+ + 2eAC. DIIDROLIPOICO
La reazione è spontanea in condizioni standard?
La reazione è spontanea nelle seguenti condizioni?
[FAD] = 1 mM
[FADH2] = 104 mM
[AC. LIPOICO] = 6x104 mM
[AC. DIIDROLIPOICO] = 3 mM
25 °C, pH 7.0.
(F = 96.5 KJ/V∙mole).
E0’ = - 0.22 V
E0’ = - 0.29 V