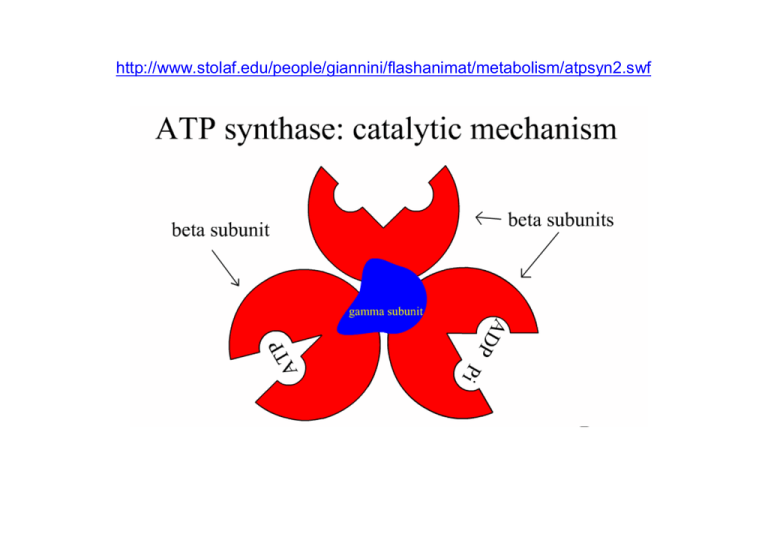
http://www.stolaf.edu/people/giannini/flashanimat/metabolism/atpsyn2.swf
Evidenza sperimentale del meccanismo d’azione dell’ATP sintasi
da: Nelson & Cox
Sulla superficie dell’enzima la reazione ADP + Pi
ATP + H2O è del tutto reversibile!
L’ATPasi lega saldamente l’ATP: la forza motrice protonica serve a staccare
l’ATP dall’enzima non a sintetizzarlo!
Misure accurate delle costanti di legame mostrano che:
FoF1 lega ATP con molta maggiore affinità KD ≤ 10-12 M rispetto all’affinità
del legame con ADP KD ≤ 10-5 M
Questa differenza di affinità di legame corrisponde a una differenza di
energia libera di legame di 40 KJ/mole, e questa energia di legame sposta
l’equilibrio verso la formazione del prodotto ATP.
Studi cinetici hanno dimostrato che per la reazione
Enz-ATP
Enz-(ADP + Pi)
Vel. idrolisi k1= 10s-1
Vel. sintesi k-1=24 s-1
K’eq= k-1/ k1= 24/10 = 2.4
non come per i nucleotidi liberi dove:
K’eq = 105
∆G0’= - RTln K’eq ≈ 0
∆G0’= - 30 KJ/mole
Come mai sul sito attivo dell’enzima la reazione di sintesi dell’ATP
(fortemente endoergonica in soluzione acquosa) diventa facilmente
reversibile? ∆G0’ ≅ 0 (ADP + Pi ATP + H2O)
• Legame forte con il sito attivo (energia di legame,DGB),
• tasca molto idrofobica
determinano : abbassamento dell’energia di attivazione
stabilizzazione dell’ATP rispetto ad ADP e Pi.
Energia libera
Stato di transizione
ATP (in soluzione H20)
∆G acq
∆G B
ADP + Pi
ATP (legato a E)
(in soluzione H20 o legati a E)
Coordinata di reazione
Poiché l’E lega molto strettamente non solo lo stato di transizione ma anche il
prodotto, sono necessari ≈ 40 KJ/mole fornite dalla forza motrice protonica, ossia
dal gradiente protonico, per staccare l’ATP dall’E