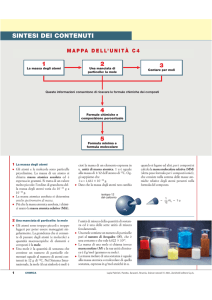
LA MOLE
La massa atomica relativa, MA, di un elemento è la sua massa espressa in unità u, quindi
relativamente alla massa dell’atomo di carbonio.
L’unità di massa atomica (u o dalton) è uguale a 1/12 della massa dell’atomo 12C.
La tavola periodica riporta per ogni elemento il valore della massa atomica, chiamata anche peso
atomico.
La massa molecolare relativa, MM o peso molecolare, è la somma delle masse atomiche che
compaiono nella molecola
Il valore dell’unità di massa atomica, 1 u = 1,661
misurato con gli strumenti a noi conosciuti.
-24
g, è estremamente piccolo per essere
È stato perciò necessario trovare una grandezza che mettesse in
relazione gli atomi e le molecole con le grandezze misurabili con le
bilance.
Questa grandezza è la mole (mol).
Una mole è la quantità di sostanza che contiene un numero di particelle
elementari uguali al numero di atomi contenuti in 12 g di 12C.
La massa di una mole di un elemento (o di una molecola) è uguale alla sua massa
atomica (o molecolare) espressa in grammi/mole.
La massa molare M che si misura in g/mol, è la massa di una mole.
Avogadro si pose il problema di quante particelle elementari fossero contenute in una mole e lo
risolse tramite il rapporto:
massa molare/massa atomica = NUMERO PARTICELLE ( o N) presenti in una mole
Il risultato del rapporto
massa molare/massa atomica
= 6,022 X 1023 particelle/moll
è noto come numero o costante di Avogadro.
Una mole di sostanza contiene sempre 6,022 X 1023 particelle (atomi, molecole o
ioni).
In pratica, per calcolare il numero di moli di una sostanza si usa la
formula
Con l’analisi qualitativa e quantitativa si calcolano sperimentalmente le percentuali in massa degli elementi,
da cui si ricava la formula minima del composto.
La composizione percentuale è utile per determinare la massa effettiva di un elemento presente in una
data massa di composto.
I passaggi per determinare la formula minima sono i seguenti:
si scrive la massa m in grammi di ciascun elemento presente in 100 g di
composto, cioè la sua percentuale in massa;
si calcola il numero di moli n di ciascun elemento;
si divide il numero di moli di ciascun elemento per il più piccolo numero di moli
calcolato: i numeri interi che si ottengono sono gli indici numerici della formula;
si scrivono gli elementi e in basso a destra di ciascuno il rispettivo indice.