Maturazione mRNA
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 0
I pre-mRNA vanno incontro a processamento
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 1
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 2
CAP al 5’
Aggiunta di una G alla base del
trascritto tramite legame 5’-5’
Aggiunta di 1/3 gruppi metile alla
base o al ribosio della nuova G
terminale
Cap di tipo 0: gruppo metile sulla G terminale (pos. 7)
Cap di tipo 1: + gruppo metile sul ribosio della 2° base
Cap di tipo 2: + gruppo metile sul ribosio della 3° base
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 3
Il cap serve a :
Aumentare l’efficienza della traduzione
Proteggere l’mRNA dalla degradazione
Facilitare il trasporto dell’mRNA dal nucleo al citoplasma
Aumentare l’efficienza del processo di splicing
Sequenza degli eventi nel processo di capping. (a) L’RNA trifosfatasi rimuove il γ-fosfato dall’estremità
5' dell’mRNA; (b) la guanilil transferasi aggiunge il GMP, usando come substrato il GTP e liberando
pirofosfato, per formare il legame trifosfato 5'-5'; (c) la metil transferasi aggiunge un gruppo metilico sulla
guanina in posizione 7, utilizzando come substrato una molecola di S-adenosilmetionina (AdoMet); (d)
B. Lewinmetilazioni
et al., IL GENE, 2/E
compatta, Zanichelli
editore S.p.A.
Copyright
© 2011
ulteriori
possono
dare luogo
a forme
varianti
del cap.
28 | 4
Ruolo della fosforilazione della coda CTD dell’RNA polimerasi II nel ciclo della trascrizione. il
CTD (C-ter Domain della subunità Rpb1) della RNApolII con i suoi stati fosforilati sulle serine 5 e 2
dell’eptapeptide ripetuto YSPTSPS (52 ripetizioni nell’enzima umano), è coinvolto, oltre che nella
transizione da inizio ad allungamento della trascrizione, anche negli altri processi post-trascrizionali, e in
particolare: l’aggiunta del cap, lo splicing, la terminazione e la poliadenilazione. Ciò spiega la specificità
del capping rispetto ai trascritti sintetizzati da RNApolII
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 5
Le estremità 3’ degli mRNA sono generate per taglio e poliadenilazione
la poliadenilazione è necessaria per la maturazione dell’mRNA dall’RNA nucleare
la reazione richiede un complesso proteico che contiene un fattore di specificità CPSF
(Cleavage and polyadenylation specificity factor), un’endonucleasi e la poli(A)polimerasi PAP
CPSF e l’endonucleasi tagliano l’RNA a valle di AAUAAA
CPSF e PAP aggiungono circa 200 nt di A all’estremità 3’ in modo processivo
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 6
La coda di poliA al 3’ caratterizza tutti gli mRNA eucariotici, con eccezione di quelli
per le proteine istoniche.
Funzioni della coda di poliA:
Proteggere l’mRNA dalla degradazione
Aumentare l’efficienza della traduzione
Facilitare il trasporto dell’mRNA dal nucleo al citoplasma
Aumentare l’efficienza del processo di splicing
La lunghezza della coda di poliA, una volta che l’mRNA è nel citoplasma, non rimane
costante.
Può infatti essere accorciata dall’azione di RNasi, azione contrastata dall’azione di una
poliA polimerasi citoplasmatica che tende ad allungarla
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 7
il fattore di specificità CPSF (contiene 4 subunità
che insieme legano l’RNA che contiene la sequenza
AAUAAA. Le singole componenti hanno affinità per
l’RNA ma non sequenza specifica.
CPSF si lega con forza a AAUAAA solo quando è
presente CstF che lega un tratto G-U al 3’ di
AAUAAA
I fattori CFI e CFII (fattori di taglio) insieme a
CPSF sono necessari e sufficienti per il taglio
endonucleolitico
In un primo step viene aggiunta una sequenza di
poli A di circa 10nt all’estremità 3’
Poi la coda di poliA è estesa in presenza anche di
PABP
PABP è una proteina che si lega al tratto di poliA e
ne controlla la lunghezza
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 8
SPLICING
Scoperti nel 1977 in un virus umano, adenovirus, i geni interrotti costituiscono la
maggioranza dei geni negli eucarioti superiori
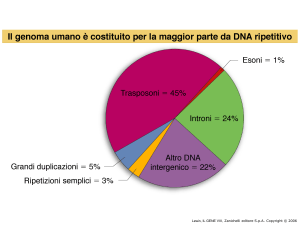
I geni interrotti sono formati da esoni (sequenze codificanti) e introni (sequenze non
codificanti)
gli esoni comprendono però anche alcune sequenze non codificanti, ma presenti nell’mRNA
maturo come le sequenze non tradotte al 5’ e al 3’ del gene (5’ e 3’ UTR)
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 9
lievito: la > parte dei geni sono non interrotti
e non hanno + di 4 esoni
funghi: la > parte dei geni sono interrotti. Gli
esoni sono <6 e lunghi meno di 5kb
insetti: la > parte dei geni sono interrotti. Gli
esoni sono meno di 10
Mammiferi: la > parte dei geni sono
interrotti. Gli esoni sono molte decine
Dimensione esoni: la maggior parte codificano per meno di 100 aa e non ci sono differenze
significative tra organismi diversi
Dimensioni introni: variabili, da 200 bp a 800 kb in casi estremi molto variabili tra organismi
diversi
Il trascritto primario può essere lungo anche 1000-2000 kb e quello maturo essere il 10%
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 10
Diversi Tipi di Splicing
① Gli introni sono rimossi dai pre-mRNA nucleari mediante riconoscimento di
sequenze consenso, grazie ad un sistema di splicing, lo spliceosoma. Il
meccanismo di splicing comporta transesterificazioni ed il centro catalitico
comprende RNA e proteine.
② Gli introni sono rimossi autonomamente, con un meccanismo che comporta
transesterificazioni e in cui l’RNA è l’agente catalitico
③ Gli introni sono rimossi mediante enzimi (taglio e ligazione) che agiscono sul
substrato che ha assunto una caratteristica conformazione (splicing tRNAs
lievito)
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 11
Gli introni dei geni che codificano
proteine sono divisi in 3 classi
① gli introni del pre-mRNA sono identificati solo
dal possedere le consenso 5’ GU…….AG 3’, ma
non hanno una caratteristica struttura secondaria
② gli introni di gruppo I e II (organelli, batteri,
eucarioti inferiori) sono classificati secondo
un’organizzazione che riflette una tipica struttura
secondaria. Questi introni, di gruppo I e II,
eseguono autosplicing
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 12
① Come e da chi
vengono riconosciuti gli esoni e rimossi gli introni?
1) Sequenze nucleotidiche specifiche all’interno del pre-mRNA
2) Un complesso RNA e proteine: SPLICEOSOMA
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 13
Il riconoscimento delle sequenze necessarie
avviene tramite una serie di componenti
che:
1) tengono aggregate le sequenze, a volte
molto distanti
2) Selezionano corretti siti di splicing
Spliceosoma formato da 150 proteine e 5
RNA ed ha le dimensioni di un ribosoma
snRNA (piccoli RNA nucleari) di 100, 300 nt
U1,U2,U5,U4/U6
Ciascuno forma complessi con proteine
definiti snRNP
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 14
Tipica struttura di un introne da splicing nucleare. Il sito donatore GU al 5' e il sito di
ramificazione contenente una A che si trova in prossimità di un tratto polipirimidinico (Y)n
che precede il sito accettore AG al 3'. Questi segnali, che permettono il riconoscimento e la
rimozione degli introni, sono contenuti in motivi oligonucleotidici più estesi, rappresentati in
basso, dove la dimensione del carattere corrispondente alla base è proporzionale al suo grado
di conservazione (notare che qui il sequence logo è dato come DNA e quindi contiene T
anziché
U).
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 15
Che reazione chimica
viene effettuata dallo SPLICEOSOMA?
1° reazione: attacco nucleofilico da parte del
2’OH della A del lariat sul sito di splicing al 5’
2° reazione: il 3’OH libero del I esone,
attacca il legame al sito di splicing al 3’
Il sito di ramificazione si trova 18-40 nt a
monte del sito 3’
Il ruolo del sito di ramificazione è quello di
identificare il sito di splicing al 3’ più vicino
Il numero di legami fosfodiestere è così
mantenuto…..
Non richiede energia
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 16
Il processo di splicing comporta la rottura e la formazione di 2 legami
fosfodiesterici, quindi bilancio energetico nullo.
Tuttavia il processo richiede energia, sotto forma di ATP, per assemblaggio e
funzionamento dell’apparato di splicing
Come si garantisce la direzionalità e irreversibilità della reazione?
La reazione di splicing è favorita perché comporta un netto guadagno di
entropia, da un pre-mRNA si ottengono l’mRNA e gli introni
Uno dei due prodotti della reazione, gli introni, sono rapidamente
degradati e non disponibili per la reazione opposta
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 17
La composizione dello spliceosoma cambia a seconda dei diversi passaggi
dello splicing
Non solo cambiano le snRNP ma altre proteine sono coinvolte nei vari
passaggi
le snRNP hanno tre ruoli fondamentali
1. Riconoscono il sito di splicing 5’ e il punto di ramificazione
2. Avvicinano i siti tra loro
3. Catalizzano il taglio e la giunzione dell’RNA
Tutto questo avviene tramite interazioni RNA:RNA, RNA:proteine,
proteine:proteine
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 18
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 19
L’ snRNA U1
L’ snRNA U1 ha una struttura
caratterizzata da stem and loop
che crea diversi domini.
L’estremità 5’ resta a singolo
filamento e si appaia con il sito di
splicing al 5’ dell’introne
La regione che lega Sm è
necessaria per l’interazione con
proteine comuni delle snRNP
I domini a stem e loop
forniscono siti di legame con
proteine esclusive della snRNP
U1.B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 20
A) La snRNP U1 interagisce con il sito di splicing al 5'
che presenta una regione di complementarietà con
l’snRNA U1, mentre il sito di ramificazione e il sito di
splicing al 3' interagiscono, rispettivamente, con le
proteine BBP e U2AF.
B) La snRNP U2 scalza la proteina BBP sfruttando
l’interazione complementare tra il sito di ramificazione
e la snRNA U2.
C) Il complesso ternario costituito dalle snRNP U4, U5
e U6, per mezzo di specifiche interazioni proteinaproteina, funge da ponte tra le snRNP U1 e U2
avvicinando i siti di splicing al 5'e al 3'.
D) La snRNP U6 scalza la snRNP U1.
E) In seguito al rilascio della snRNP U4 si ha
l’interazione tra le snRNP U6 e U2, per mezzo di
regioni di complementarietà tra i rispettivi snRNA. Si
forma così lo spliceosoma attivato (complesso B*) che
catalizza la prima reazione di trans-esterificazione che
porta al complesso C1 (F)
F) A questo punto si ha la seconda reazione di transesterificazione (G), che porta alla concatenazione degli
esoni e al rilascio dell’introne sotto forma di struttura a
forma di cappio (lariat) che viene successivamente
linearizzato e degradato. L’mRNA maturo viene
rilasciato e le snRNP riutilizzati per lo splicing di un
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
altro introne (H).
28 | 21
Regolazione dello splicing. La regolazione dello splicing comporta l’interazione tra
proteine in grado di legare specifici motivi presenti nel pre-mRNA sia negli esoni (ESE,
ESS) che negli introni (ISE, ISS). All’azione delle proteine SR che legano le sequenze
enhancer negli esoni (ESE) e negli introni (ISE), e che attivano lo splicing (frecce rosse e
verdi a punta), si oppongono le proteine hnRNP, che invece riconoscono le sequenze
silencer negli esoni (ESS) e negli introni (ISS) (frecce viola a punta piatta). Il meccanismo
di attivazione o repressione normalmente comporta l’interazione con altre componenti dello
spliceosoma
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 22
Lo splicing è connesso all’esportazione
dell’mRNA
Le proteine REF si legano alle
giunzioni di splicing associandosi allo
spliceosoma
Dopo lo spicing le proteine restano
attaccate all’RNA alle giunzioni esoneesone
EJC, exon junction complex, consiste di
più di 9 proteine
EJC non si associa con trascritti di geni
privi di introni
EJC comprende un gruppo di proteine
chiamate REF
L e p r o t e i n e R E F a l o r o v o l t a
interagiscono con TAP, proteina che
interagisce
con il poro nucleare
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 23
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 24
Movimento di ioni, metaboliti e altre
piccole molecole attraverso la membrana
nucleare. (A) Import (frecce in verde) ed
export (frecce in rosso) di macromolecole
attraverso la membrana nucleare e il
nucleolo. (B) Il meccanismo attivo di
traslocazione nucleo-citoplasmatica
coinvolge i complessi dei pori nucleari
(NPC, Nuclear Pore Complex) e proteine
della classe delle carioferine (denominate
importine o esportine a seconda della
direzione del trasporto) cui si legano le
macromolecole trasportate (dette anche
cargo). Il processo richiede energia fornita
dall’idrolisi di GTP da parte di una GTPasi
denominata Ran.
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 25
Introni autocatalitici di gruppo I e II
Thomas R. Cech. Il biochimico statunitense Cech (premio Nobel per la chimica nel
1989) ha scoperto, alla fine degli anni settanta, l’autosplicing dell’rRNA di Tetrahymena.
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 26
Maturazione dei tRNA e degli rRNA
In tutti gli organismi i tRNA e gli rRNA sono sintetizzati a partire da
lunghi precursori che vengono processati, mediante esonucleasi o
endonucleasi.
Endonucleasi RNasiIII: provvede alla scissione degli rRNA batterici e
al taglio di alcuni rRNA e tRNA. Riconosce RNA ds.
Rnasi P: taglia RNAss. Contiene nella sua struttura, oltre alla
componente proteica, una componente di RNA.
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 27
Introni di gruppo 1
Autosplicing
r-RNA eucarioti inferiori, mitocondri e
cloroplasti, fago T4, dimensioni 250/500nt
Non formano un lariat, ma utilizzano
GMP,GDP,o GTP come cofattore
Struttura secondaria evolutivamente conservata
2 reazioni di transesterificazione in sequenza:
-la G attacca l’estremità 5’ dell’introne creando
un esone con un 3’OH e un G-introne
-Il 3’OH del I esone attacca il II esone=
ligazione dei due esoni
Le due reazioni sono connesse e non ci sono
intermedi con esoni separati
l’introne rilasciato come una molecola lineare
circolarizza e viene degradato
Probabilmente alcune di queste strutture negli introni di gruppo I sono stabilizzate da proteine (geni degli
organelli)
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 28
Introni di gruppo II: organelli di funghi
e piante ed alcuni batteri.
Autosplicing
Dimensione 400/1000nt
-hanno un meccanismo di splicing simile al nucleare con formazione di un lariat tenuto
insieme da legami 5’-2’
-in vivo proteine assistono la formazione di strutture secondarie dell’RNA
Una A del dominio 6 dona il gruppo 2’ OH per la I transesterificazione costituendo il dominio
catalitico
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 29
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 30
t-RNA Splicing
Contrariamente a tutti gli altri
lo splicing dei t-RNA non è
dovuto a transesterificazioni
Gli introni sono tutti piuttosto
corti e si trovano nella stessa
posizione ossia all’interno del
braccio dell’anticodone
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 31
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 32
Viene inoltre aggiunta CCA al 3’ e vengono successivamente modificate le basi tramite
metilazione, deaminazione e riduzione
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 33
Rappresentazione schematica del cis- e trans-splicing negli introni dei tRNA dell’archeobatterio N.
equitans. (A) Nel cis-splicing convenzionale del tRNA una specifica endonucleasi riconosce e taglia il
motivo bulge-helix-bulge nel pre-tRNA, con conseguente escissione dell’introne. (B) Nella fase iniziale
del processo di trans-splicing si ha l’appaiamento dei due frammenti che contengono le metà 5' e 3' del
pre-tRNA. L’appaiamento coinvolge anche tratti delle regioni introniche presenti nei due frammenti del
tRNA precursore (in rosa), facilitando la reazione di trans-splicing che avviene con lo stesso meccanismo
del cis-splicing
convenzionale
B. Lewin et al., IL GENE,
2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 34
Le reazioni di trans-splicing mediate da piccoli RNA
Le reazioni di splicing di solito avvengono in cis fra giunzioni di splicing sulla
stessa molecola di RNA
Nei vermi ed in tripanosoma avvengono anche in trans
Sono mediate da una piccola molecola di RNA (RNA SL Spliced Leader RNA)
che è unita all’estremità 5’ di molti mRNA precursori
L’RNA SL ha una struttura che ricorda il sito di legame degli snRNA U e può
avere un ruolo analogo nella reazione
il trans-splicing si può anche ottenere introducendo sequenze complementari
negli introni di 2 RNA
Ciò dimostra che non c’è impedimento meccanico al trans splicing
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 35
Le reazioni di trans-splicing mediate da
piccoli RNA
L’RNA SL è trascritto, da RNAPol II, da un
locus indipendente, e porta sequenze addizionali
all’estremità 3’ (100 nt)
Questo RNA porta la sequenza leader di 35 nt
seguita da un sito di splicing 5’, mentre le
sequenze degli mRNA portano un sito di splicing
3’ che precede la sequenza codificante nell’mRNA
maturo
Quando l’SL e l’mRNA sono connessi da una
reazione di trans-splicing, la regione 3’ del leader e
quella 5’ dell’mRNA costituiscono le metà 5’ e 3’
di un introne.
Si forma un legame 5’-2’ che genera una
molecola a forma di Y, invece del cappio, perché le
molecole non sono unite covalentemente
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 36
Maturazione del trascritto codificante per la proteina nad2 nei mitocondri di Arabidopsis thaliana. L’RNA
che costituirà il trascritto maturo è spezzettato in cinque esoni su due loci distinti del genoma mitocondriale
(nad2a-e). Gli esoni a e b sono co-trascritti con un gene codificante per una proteina ribosomale (rps4).
Un’attività endonucleasica è necessaria per ottenere il trascritto maturo di rps4. L’autosplicing in cis concatena
gli esoni dello stesso locus con la formazione di due frammenti di RNA (a+b, c+d+e) che vengono concatenati
tra loro a opera del trans-splicing. L’RNA editing (vedi par. 14.2), rappresentato da asterischi, completa il
processo di maturazione dell’mRNA modificando 31 basi. È importante precisare che i processi di splicing ed
editing
sono
entrambi
co-trascrizionali,
e quindi
avvengono
B. Lewin
et al.,
IL GENE, 2/E
compatta, Zanichelli editore
S.p.A. Copyright
© 2011 simultaneamente via via che la trascrizione procede.
28 | 37
Lo Splicing Alternativo
Un gene umano medio contiene otto esoni e ha tre forme di splicing alternative
Inoltre un esone è lungo mediamente 100/200 nt e un introne migliaia di nt. A che
tipo di errori va incontro lo splicing?
1) Ritenzione di introne
2) Sito di splicing sbagliato.
La selezione del sito di splicing può essere aumentata da due meccanismi:
Durante la trascrizione vengono reclutate proteine coinvolte nello splicing: proteine
legano il sito 5’ e 3’ appena trascritti e interagiscono poi con lo spliceosoma
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 38
In Drosophila il sesso è determinato dal rapporto tra cromosomi X e autosomi, 1 nella
I due FT SisA e SisB, sul cromosoma X, sono presenti in maggior quantità nella .
e 0.5 nel
SisA e SisB attivano Sex-Lethal (SXL) a partire da un Promotore early (Pe), che è represso da Dpn nei .
SXL risulta espresso nei maschi a partire da Pm. SXL (da Pe) regola lo splicing del suo mRNA, inducendo
espressione di 2 isoforme, e solo quella espressa nelle
volta lo splicing di tra.
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
esprime proteina funzionale che regola a sua
28 | 39
Solo l’isoforma di tra
espressa nelle
codifica
per un prodotto funzionale
che, al contrario di SXL,
funziona da attivatore dello
splicing, utilizzando come
cofattore tra2.
Si hanno quindi due
isoforme differenti della
proteina doublesex (dsx).
Quella nelle
ha una
regione C-ter di 30 aa,
mentre
quella
dei
ha una regione di
150 aa.
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 40
Gli introni dal punto di vista evolutivo
Non si sa se gli introni esistevano ancestralmente in tutti gli organismi e i batteri li hanno
persi o
se si sono inseriti tardivamente come i trasposoni
Perché esistono negli eucarioti? Qual i vantaggi?
Splicing alternativo ossia prodotti proteici multipli con un unico gene
Riarrangiamento degli esoni per formare nuove proteine
Esoni sono domini funzionali
Molti geni si sono evoluti per duplicazione di esoni Ig
Alcuni esoni si trovano in proteine differenti
La maggiore lunghezza degli introni fa sì che la ricombinazione avvenga più spesso negli
introni, causando con più frequenza un riassortimento che un interruzione degli esoni
B. Lewin et al., IL GENE, 2/E compatta, Zanichelli editore S.p.A. Copyright © 2011
28 | 41