Università di Roma Tor Vergata - Scienze della Nutrizione Umana
Biochimica
Prof.ssa Luciana Avigliano
2011
SELENIO
SELENIO
1817
1960
scoperta dell’elemento dal chimico svedese Berzelius
(da Selene dea greca della luna)
micronutriente essenziale della dieta
1973
Se nella GSH perossidasi
Interesse per la comunità pubblica e per la ricerca
Protezione da danno ossidativo ed invecchiamento
Prevenzione da cancro
Ruolo nella riproduzione (maschile)
Protezione negli animali da forme di distrofia muscolare
Tossicità
Aspetti biochimici e molecolari particolari
Chimica del selenio
O, S, Se: stessa famiglia nella tavola periodica
abbondanza nella crosta terrestre:
Selenio 4 ordini di grandezza inferiore rispetto allo zolfo
Uomo: Selenio 10-20 mg milligrammi
Zolfo 140 g
forma inorganica
selenuro (-2) SeH-
intermedio metabolico
selenito (+4) SeO32-
suolo, integratori
selenato (+6) SeO42-
forma organica
selenometionina Se-Met
selenocisteina - forma funzionale presente soltanto
in proteine del regno animale
COO–
21° amminoacido
+H
3N
–C–H
CH2SeH
codice 3 lettere Sec
codice 1 lettera U
- implicata in reazioni redox
- funziona da centro catalitico
Se più acido dello S e S più acido dell’O
Dipende dalla massa più grande:
Se > S > O
a pH fisiologico, il Se è ionizzato
-OH della serina
non dissocia
-SH della cisteina
pKa ~ 8,5
COO–
COO–
+H
3N
–C–H
CH2OH
- SeH della Sec
pKa ~ 5,2
COO–
+H
3N
–C–H
CH2SH
+H
3N
–C–H
CH2Se-
Enzimi omologhi (lieviti, piante) con Cys al posto di Sec
hanno minore efficienza catalitica
Funzioni
biochimiche
Selenoproteine - contengono Sec
Identificate nel genoma 25 Se proteine,
funzione per lo più non nota
glutatione perossidasi - difesa da ROS e perossidi
tioredossina reduttasi - riduzione dei tioli proteici
iodiotironina deiodinasi - rimozione di I da ormoni tiroidei
selenoproteina P - trasporto plasmatico del Se, antiossidante
selenofosfato sintetasi - formazione di Sec dalla serina
DIFESA DAL DANNO OSSIDATIVO
Glutatione perossidasi (GPx):
Glutatione ridotto GSH γGlu-CysSH-Gly
NADPH
G6P
deidrogenasi
forma funzionale
H2O
GS-SG
glutatione
reduttasi (FAD)
NADP+
glutatione
perossidasi
O2.-
2 GSH
H2O2
ROOH
via dei pentosi-P
glutatione reduttasi eritrocitaria
valutazione stato nutrizionale vit B2
perossidazione lipidica
ossidazione proteine
danno a membrane,
funzionalità enzimatica
GPx-1 citosolica
eritrocitaria:: ha una relazione lineare con la quantità di Se ed è usata
quale marcatore biochimico dello stato nutrizionale
GPx-2 epitelio del tratto gastrointestinale, incluso esofago
con protezione dai perossidi lipidici alimentari,
importante antiossidante nel colon (difesa dal cancro del colon)
GPx-3 extracellulare, nel plasma (20% Se plamatico totale)
marcatore biochimico dello stato nutrizionale
GPx-4 o PHGPx (fosfolipide idroperossido GPx) membrana
(sistema nervoso, riproduttivo, cuore) ed LDL - sinergica con vit E
Spermatidi GPx-4 funzione enzimatica
spermatozoi: più alta concentrazione in Se di tutti i tessuti
diventa inattiva ed acquista un ruolo strutturale nella capsula mitocondriale
carenza altera la mobilità e può indurre sterilità
Tioredossina reduttasi: mantiene ambiente ridotto tramite NADPH
- Rigenera antiossidanti (Vit C, GSH)
- Mantiene proteine (fattori di trascrizione) nello stato ridotto
agendo sui gruppi sulfidrilici -S-S- 2 -SH
Regola la trascrizione: espressione genica, proliferazione cellulare
- Tioredossina (Trx) proteina substrato specifico
dà gli equivalenti di riduzione alla ribonucleotide reduttasi
GSSG
Vit C
NADPH
NADP+
via dei pentosi-P
tioredossina reduttasi (Trx-R)
GSH
DHA
NADP+
GSSG
glutatione reduttasi
NADPH
Trxox
Trxrid
Trxrid
nucleo
iodiotironina 5’-deiodinasi
enzimi di membrana (plasmatica, R.E.) espressi in numerosi tessuti
metabolismo degli ormoni tiroidei;
Tipo 1
T4 T3 (3,5,3’)
tiroide, fegato, rene, per esporto nel plasma
INOLTRE nella tiroide: carenza di Se favorisce danno tissutale forse
per alterazione TrxR e GPX con stress ossidativo da H2O2 prodotto
per ossidare e legare lo ITiroide esprime 11 Se-proteine, numero alto forse collegato alla
elevata produzione di H2O2
Ruolo
fisiologico
attività antiossidante
protezione malattie cardiovascolari
funzione degli ormoni tiroidei
fertilità
anticancro
prevenzione cancro della prostata, colon, polmoni
funzione immune
proliferazione e risposta linfociti T, protezione da infezione virale
risposta infiammatoria
asma, artrite
Gp4x regola attività di cicloossigenasi e lipossigenasi e quindi
sintesi leucotrieni e prostaglandine
Malattie da Carenza:
richiedono fattori addizionali affinché si manifestino
Malattia di Keshan, descritta nella regione di Keshan, Cina.
Cardiopatia endemica che colpisce soprattutto bambini e donne in età
fertile per aumentata virulenza di un virus Coxsackie (CVB3).
Eliminata negli anni 70 da campagna di supplementazione
Malattia di Kashin-Beck, Tibet, Nord Cina. Alterata crescita
cartilagine, che compare nell’adolescenza. Il Se da solo non efficace;
altri fattori, quali carenze di altri minerali tra cui iodio, micotossine
Dolori e debolezza muscolare, descritta in pazienti in nutrizione
parenterale (white muscle disease descritta in pecore allevate in aree
rurali con bassi livelli di selenio)
Cretinismo accompagnato da ingrossamento della tiroide (Zaire) per
contemporanea carenza di iodio e selenio
Possibili alterazioni da moderata carenza in Se
alterazione dell’attività antiossidante
alterazione delle condizioni neurologiche (malattie di
Alzheimer e Parkinsons)
alterazione della risposta immune ed aumentato rischio di
infezione analogamente agli altri micronutrienti
aumentati rischio di cancro
miopatia
alterazione funzionalità tiroide
Biosintesi e catabolismo
delle
selenoproteine
Assorbimento
Non vi è controllo omeostatico per l’assorbimento del Se
Alta biodisponibilità in ogni forma inorganica ed
organica
SeMet ~ 90%
Limitante non l’assorbimento ma la trasformazione in
forma attiva
Met (a.a. essenziale per gli animali) e Se-Met
sintetizzati da piante e lieviti
Se-Met inserita in maniera non specifica nello proteine
come analogo della Met sia nelle piante che negli animali
la sostituzione è casuale e dipende dalla % dei due amino
acidi.
Negli animali: Sec presente nelle selenoproteine
ruolo specifico e controllo omeostatico
non esiste un pool di Sec libera
Metionina - precursore della cisteina
Se-Met NON è precursore della Sec presente nelle
selenoproteine
I) Indipendentemente dalla forma di assunzione il Se per
essere utilizzato deve essere ridotto a selenuro (SeH-)
1.
Sale (selenato, selenito): riduzione GSH dipendente
2.
Sec + Sec-liasi PLP-dipendente SeH- + alanina
enzima specifico che non scinde la Cys)
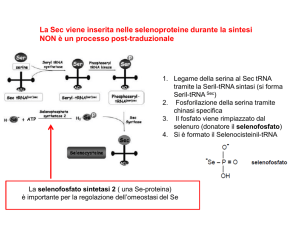
II) selenuro è trasformato in selenofosfato ad opera della
selenofosfato sintetasi (a sua volta selenoproteina)
SeH- + ATP + H2O HPO3Se2- + Pi + AMP
O
-Se – P = O
OH
selenofosfato
III) biosintesi di Sec nel corso della traduzione
seril-tRNASec
selenocisteina sintasi (enzima a PLP) + selenofosfato
selenocisteil-tRNASec
Il livello di Se regola il livello di selenofosfato e quindi il livello Sec-tRNASec
IV)
inserzione della Sec nella proteina
mRNA: struttura a forcina denominata SECIS
(Seleno Cysteine Insertion Sequence)
a valle del codone UGA nella regione 3’ non tradotta
permette la distinzione tra UGA/Sec ed UGA/codone di stop
isopentenil-adenosina in posizione 37 necessaria per la
funzione è presente nel Sec-tRNASec
Lancet marzo 2004
ipotesi: miopatia da statina legata alla mancata
isopentenilazione del tRNASec
sulla base di alcune osservazioni
miopatia da statina simile a miopatia da carenza nutrizionale
di Se
lovastina inibisce sintesi Se-proteine in cellule in coltura
Proteine
Se-proteine
Selenito
(come Secisteina)
↓↑
↑
↓
Selenometionina
selenofosfato
GS-Se-SG
↓(transulfurazione)
↑
↓
selenocisteina → H2Se ← GS + SeH
SadenosilMetionina ↓ derivati metilati
CH3SeH
↓
CH3Se-GalN
1β-metilseleno-N-acetil-galattosamina
(CH3)2Se → respiro
↓
+
(CH
)
Se
→ urine
3 3
escrezione
Alti livelli di Se o intossicazione da Se dimetilSelenuro - volatile –
Eliminato con la respirazione - odore simile all’aglio “garlic breath
Fonti
alimentari
SUOLO PIANTE ANIMALI UOMO
La quantità presente negli alimenti dipende dalla ricchezza in Se del terreno
bassa in Europa, Asia centrale - alta in Usa, Giappone
Cereali : può variare tra <10 e > 80 µg/100 g
grano
riso
PIANTE: non usano Se ma lo metabolizzano come lo S
assorbono selenato (compete con il solfato),
quindi incorporato nella Se-Met e Se-Cys senza ruolo funzionale
per evitare l’eccesso nelle proteine con conseguente danno funzionale,
- piante accumulatrici trasformano in composti non tossici quali gli
a.a.non proteici metil-Se-cisteina e metil- Se-Met
- piante non accumulatrici nel composto volatile dimetil-selenuro
disperso nell’aria
Eccesso nel suolo
- suolo arido selenifero dopo abbondante irrigazione
- acqua di scarico industriale
piante non accumulatrici utili per disinquinare il terreno dal Se
Carenza nel suolo
Fertilizzazione del suolo (Finlandia, Cina)
tramite selenito
broccoli, aglio, leguminose accumulano fino a 10 mg/kg
Mangime (selenito, metodo a basso costo) per maiale più
biodisponibile che per ruminanti (selenito trasformato in selenuri
insolubili dai batteri del rumine)
Lievito selenizzato
supplementato in selenito che viene trasformato in Se-Met
lievito per il pane (Nord Ucraina)
ALIMENTO
µg/100g
rognone, fegato
carni, pesce
cereali e derivati
latte e derivati
frutta e verdura
40-150
10-40
10-80
1-3
1-2
variazioni in base al
paese di provenienza
sotto forma di
sale inorganico: selenato. selenito
Se-Met, Se-Cys
metil-Se-Cys
più abbondante in grano, legumi, soia
in piante che concentrano Se - aglio, cipolla,
broccoli
Fabbisogno
Assunzione di Selenio (Br J Nutr 100: 254, 2008)
Paese
µg Se/ per persona al giorno
—————————————————————————————
Canada
98-224
Giappone
104-199
USA
106
Australia
57-87
Nuova Zelanda
55-80
Svizzera
70
Austria
48
Gran bretagna
29-39
Belgio
28-61
Danimarca
38-47
Italia
43
Francia
29-43
Repubblica ceca
10-25
India
27-48
Egitto
29
Arabia Saudita
15
Non facile da stabilire, si basa su parametri biochimici
RDA 1989 (FAO, WHO)
30-40 µg/die per la max attività GPx3 (+ 30% per sicurezza)
70 µg/die M adulto - 55 µg/die F adulta
RDA 2000 (al momento considerato valido)
altri studi con bassa o alta supplementazione in Se ed attività GPx3
55 µg/die M e F adulto (60 gravidanza, 70 allattamento)
15 e 20 µg/die infante fino a 6 e 12 mesi
World Health Organization (sulla base attività GPx3)
Iimite inferiore per mantenere buono stato di salute:
40 µg/die M adulto, 30 µg/die F
Cina (area di Keshan): livello protettivo 21 µg/die M e 16 µg/die F
Nuova Zelanda: livello protettivo 33 µg/die M e 23 µg/die F
UK 1 µg Se/ kg peso corporeo
Due livelli di gerarchia in carenza di Se
1- Cervello, sistema endocrino e sistema riproduttivo al top:
in carenza perdono poco Se
dopo somministrazione rapido accumulo
fegato e muscolo scheletrico ne perdono buona parte
2. gerarchia fra le proteine
attività GPx cala di più della Se-proteina P o della deiodinasi
attività GPx potrebbe non essere indice funzionale
(in genere raggiunta nei paesi europei)
non è nota la saturazione delle altre Se-proteine
UL = 400 µg/die
TOSSICITA’
L’ambito di valori entro i quali l’introito di Se è adeguato e non tossico è
molto stretto con un rapporto di ~1/10 fra quantità richiesta e tossicità
Fino a 800 µg/die non vi è tossicità apparente.
Avvelenamento da Se (rari casi - ingestione di grammi) disturbi gastrointestinali, neurologici, respiratori, infarto del miocardio, danno renale.
Selenosi (acuta o cronica) (intrito superiore a 1250 mg/die).
Acuta: lavoratori microelettronica per inalazione selenio volatile
difetti respiratori, edema polmonare, dermatite, irritazione occhio
Cronica: per introito eccessivo (alti livelli suolo ed acqua - Cina)
associata a caduta dei capelli (forse distruzione cheratine)
EFFETTI TOSSICI VANNO TENUTI PRESENTI PER
1. Alimenti arricchiti
2. Supplementi
Si considera che se
- l’alimento contiene più di 1 mg Se / kg può indurre tossicità
- l’alimento meno di 0,1 mg Se / kg può indurre carenza
Importante la misura del selenio presente