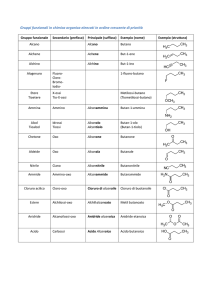
Reattività degli alogenuri alchilici
1
3
Meccanismo della Reazione di
Sostituzione Nucleofila
4
5
Meccanismo unimolecolare: sostituzione
nucleofila unimolecolare (SN1)
• Un alogenuro che reagisca con questo meccanismo lo fa in
due stadi, il primo dei quali è lento e consiste nella
dissociazione dell’alogenuro stesso con formazione del
carbocatione.
• Nel secondo passaggio, che è veloce, il carbocatione si
combinerà con il nucleofilo per dare il prodotto.
• Poiché lo stadio lento interessa un solo reagente, il
meccanismo è detto unimolecolare
6
Esempio di una SN1:
bromuro di tert-butile.
CH3
CH3
C
CH3
H
..
:
Br
..
+
CH3
CH3
C
: O:
H
CH3
OH
1° Stadio
CH3
CH3
..
:
Br
..
C
CH3
lento
H3C
+
C
CH3
CH3
+
.. –
: Br :
..
2° Stadio
H3C
CH3
+
C
H
: O:
CH3
H
veloce
CH3
CH3
H
+
C
CH3
O:
H
3° Stadio
CH3
CH3
CH3
H
CH3
+
C
CH3
+ H3O+
C
O:
+ H2O:
H
deprotonazione
veloce
CH3
OH
NATURA DEI CARBOCATIONI
• Carbocationi si classificano in primari,
secondari e terziari in relazione al numero di
atomi di carbonio legati all’atomo di carbonio
che porta la carica.
11
CH3
CH3
C
CH3
CH3
CH3
C
CH3
CH3
CH2
X
X
X
CH3
H
C
CH3
CH3
H
C
CH3
CH3
CH2
13
14
• Quindi poiché si passa attraverso la formazione di un
carbocatione, questo meccanismo sarà quello preferito
dagli alogenuri che formano carbocationi più stabili,
cioè i terziari.
15
Fattori che influenzano la SN1
• Struttura dell’alogenuro alchilico
Forza del Nucleofilo
Natura del Solvente
Gruppo Uscente
Forza del Nucleofilo
Il nucleofilo nella SN1 deve essere
debole perché altrimenti si avrebbe
più prodotto di eliminazione (competizione!!!!!)
18
20
21
Effetto del solvente
•La velocità della reazione SN1
aumenta in Solventi Polari Protici i quali
riescono efficacemente a
solvatare gli ioni che si formano in seguito
alla rottura eterolitica del legame C-X
Solventi protici e aprotici
• I solventi possono essere protici o aprotici.
I solventi protici contengono gruppi –OH, donatori di
legame idrogeno (es. acqua, alcoli, acidi carbossilici). Tali
solventi sono in grado di solvatare gli anioni ed i cationi,
favorendo la scissione eterolitica dei legami e la
formazione dei carbocationi, favorendo in questo modo
le S N1 .
I solventi aprotici non contengono gruppi –OH. Possono
essere polari, con una densità di carica negativa
localizzata, come acetone, dimetilsolfossido (DMSO),
oppure apolari, come diclorometano (DCM) o etere
23
etilico.
• PROTICI sono "donatori di legami ad
idrogeno", poiché nella loro struttura
possiedono "O-H". In virtù di questo fatto,
riescono a solvatare bene sia gli anioni che i
cationi e quindi favoriscono le SN1.
Ci sono poi quelli APROTICI che invece,
mancando di "O-H" nella loro struttura, NON
son capaci di fornire legami a idrogeno,
favorirebbero le reazioni SN2
24
25
26
27
Natura del gruppo uscente
28
• La natura del gruppo uscente che viene
scacciato dal nucleofilo è un’altra variabile che
può influenzare la reazione SN. I migliori gruppi
uscenti sono quelli che conducono alla
formazione degli anioni più stabili (gli anioni
degli acidi forti), in quanto nella maggior parte
dei casi il gruppo uscente che viene espulso
porta con sé una carica negativa.
• Gli ioni alogenuro (I - , Br – o Cl -) sono i gruppi
uscenti più comuni.
• Al contrario anioni quali F -, OH -, OR – e NH2 –
si comportano raramente da gruppi uscenti.
29
30
Il processo SN1 è favorito da:
• 1. Molecole che favoriscono la formazione di
carbocationi
• 2. Uso di nucleofili deboli, spesso molecole
neutre
• 3. Uso di solventi polari che stabilizzano
l’intermedio carico
31
Meccanismi bimolecolari: sostituzione
nucleofila bimolecolare (SN2)
• Quando un alogenuro reagisce con questo
meccanismo lo fa in un unico stadio al quale
partecipa assieme al nucleofilo.
32
• Si ha dunque l’ingresso del nucleofilo
contemporaneo all’allontanamento del gruppo
uscente.
33
• Durante l’attacco i tre sostituenti del carbonio vengono
rovesciati nel senso opposto a quello di entrata del
nucleofilo: la configurazione del carbonio subisce
inversione.
34
• Inoltre, questo meccanismo, in cui il nucleofilo deve
farsi strada attraverso i sostituenti presenti sul
carbonio, è molto sensibile all’ingombro sterico: gli
alogenuri terziari sono quelli che più difficilmente
reagiranno mentre quelli metilici sono quelli più
favoriti.
35
• La SN2 è favorita da solventi polari aprotici,
come l’acetone, poiché non si legano agli
anioni. Il nucleofilo, che è un anione, è così
libero di arrivare “nudo” al carbonio e di
reagire con esso. Un solvente protico, invece,
rivestendo il nucleofilo ne renderebbe difficile
l’azione.
d-
O
S
d+
CH3
CH3
d- d+
CH3-O-H
Nu-
36
37
• Che cosa significano le sigle: SN1 e SN2?
Quali dei seguenti composti, sottoposti a una
reazione di sostituzione nucleofila, seguiranno con
maggiore probabilità la SN1? Quali la SN2? E quali
entrambe?
Dimetilformammide
Acetonitrile
Tertraidrofurano
Etere dietilico
Metanolo
Etanolo
Individuare il nucleofilo, l’atomo nucleofilo,
l’atomo elettrofilo e il gruppo uscente
44
Il prodotto della reazione
45
• Porre i seguenti composti in ordine di
reattività rispetto alla sostituzione nucleofila
alifatica e spiegare le cause di tale ordine:
•
CH3Cl
CH3I CH3F CH3Br
46
esercizio
47
soluzione
48
Vediamo questo. Esercizio
Cosa si ottiene da…
C
l
CH3CHCH2CH3
+
CH3OH/H2O T
bassa
49
Soluzione Esercizio
Cosa si ottiene da…
C
l
CH3CHCH2C +
H3
CH3OH/H2O T
bassa
• Alogenuro
secondario
• Solvente protico
• Nucleofilo debole
OH
• SN
1
CH3CHCH2C +
H3
50
Al lavoro, con un po’ di esercizi
Cosa si ottiene da…
CH3
DMSO
CH3CHCH2Br
+
I-
• Alogenuro primario
• Solvente aprotico
• Nucleofilo forte/base debole
• SN 2
CH3
CH3CHCH2I
la nucleofilicità degli ioni alogenuro
segue l’ordine I-> Br-> Cl-> F-, opposto
all’ordine di basicità F-> Cl- > Br - > I -.
Sembra che alla base di questo
fenomeno vi siano le differenze delle
energie di solvatazione degli ioni
51
E questo?
Cosa si ottiene da…
Br
CH3CHCH2CH3 +
CH3S-
acetone
• Alogenuro secondario
• Solvente aprotico
• Nucleofilo forte/base debole
• SN 2
SCH3
CH3CHCH2CH3
Con inversione
52
E ancora…
• Cosa si ottiene da
Cl
+
CH3OH
CH3OH
• Alogenuro secondario
• Solvente protico
• Nucleofilo debole
• SN1/ E1
OCH3
+
53
Stanchi?
Cosa si ottiene da…
Cl
CH3CCH2CH3
+
OH-
acqua
CH3
• Alogenuro terziario
• Solvente protico
• Nucleofilo forte/base forte
• E2
(CH3)2C=CHCH3 prevalente
CH2=C(CH2CH3)CH3
54
Vediamo questo
Cosa si ottiene da…
Cl
CH3CHCH2CH3
+
CH3OH/H2O T bassa
• Alogenuro secondario
• Solvente protico
• Nucleofilo debole
• SN 1
OH
CH3CHCH2CH3
OCH3
+
CH3CHCH2CH3
Con racemizzazione
55
Eh sì, dai, e dopo…
Cosa si ottiene da…
Cl
CH3CHCCH2CH=CH2
+
OH-
acqua
CH3CH3
• Alogenuro terziario
• Solvente protico
• Nucleofilo forte/base forte
• E2
(CH3)2CH (CH3)C=CHCH=CH2
Prevalente. Perché?
(CH3)2C=C(CH3)CH2CH=CH2
56
Veloci che è l’ultimo…
• Cosa si ottiene da
Cl
+
acetone
I-
CH3
• Alogenuro secondario
• Solvente aprotico
• Nucleofilo forte/base debole
• SN 2
I
CH3
57
Ci arrabbiamo se ne
arriva ancora uno?
Cosa si ottiene da…
Br
CH3CH2CHCH2CH3 +
CH3O-
CH3OH
• Alogenuro secondario
• Solvente protico
• Nucleofilo forte/base forte
• E2
CH3CH2CH=CHCH3
58