PROTEINE
dal greco proteios
primario
Strutture
molecolari
più
rilevanti sia dal punto di vista
funzionale che quantitativo
degli esseri viventi costituendo
circa il 15 % della massa totale.
FUNZIONI
Catalisi enzimatica
Trasporto (emoglobina, albumina, lipoproteine, proteine di
membrana)
Protezione (immunoglobuline)
Coagulazione (fribinogeno)
Contrazione (actina, miosina)
Ormonale (insulina, glucagone, vasopressina, testosterone)
Trasmissione impulsi nervosi (acetilcolina, noradrenalina)
Strutturale (collagene, elastina, cheratina..)
Regolazione dell’espressione genica (induttori, repressori)
Organizzazione del DNA nei cromosomi (nucleoproteine)
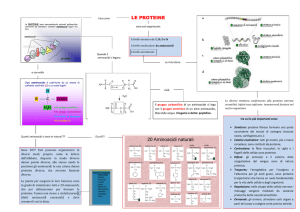
STRUTTURA
Composti organici costituiti da sequenze di aminoacidi
< 30 aa
Aminoacidi
+ 100 aa
+ 30 aa
OLIGOPEPTIDI
PROTEINE
POLIPEPTIDI
AMINOACIDI
unità strutturali delle proteine
R
caratteristico di ogni a.a.
I
+ NH
3
- C - COO I
H
gruppo
aminico
gruppo carbossilico
AMINOACIDI PROTEICI
sono circa una ventina, ma legandosi in un elevato
numero di combinazioni riescono a formare l’enorme
varietà di proteine esistenti
AMINOACIDI NON PROTEICI
Non si trovano mai nella composizione delle proteine.
Sono composti intermedi di reazioni metaboliche
(es. ornitina dal ciclo dell’urea; omocisteina da cui
deriva la metionina, etc…)
AMINOACIDI PROTEICI
Gli aminoacidi possono essere classificati in base alla loro
carica elettrica e all’affinità per l’acqua della loro catena
laterale.
Avremo cosi aminoacidi:
-
con carica positiva
con carica negativa
neutri polari (senza carica e idrofilici)
neutri apolari (senza carica e idrofobici)
AMINOACIDI PROTEICI
Neutri apolari
Neutri polari
Basici(carica-)
Acidi(carica+)
Alanina
Valina
Leucina
Isoleucina
Metionina
Fenilalanina
Triptofano
Glicina
Serina
Treonina
Cisteina
Asparagina
Glutamina
Tirosina
Lisina
Arginina
Istidina
Aspartato
Glutammato
* aminoacidi essenziali
* aminoacidi semiessenziali (fanno risparmiare Metionina e Fenilalanina)
* aminoacidi condizionatamente essenziali (in condizioni fisiologiche
particolari quando non sono sintetizzati a velocità sufficiente; substrato
energetico di macrofagi e linfociti responsabili delle difese immunitarie)
Valina, Leucina, Isoleucina: a.a. ramificati; substrato energetico a livello
muscolare con risparmio delle scorte di glicogeno
ingombro sterico dei gruppi R
affinità tra i gruppi polari ed apolari
attrazione tra gruppi acidi e basici
modellano la conformazione delle
proteine nello spazio dalle quali
dipende in modo essenziale
l’attività biologica delle proteine
stesse
Il legame chimico che unisce 2 aminoacidi (monomeri) a
formare un polimero (oligopeptide, polipeptide o proteina)
è detto legame peptidico e si instaura tra il gruppo
aminico ( -NH3+ ) di un aa ed il gruppo carbossilico
(- COO-) di un altro aa, con liberazione di una molecola
d’acqua.
Le reazioni che producono legami covalenti tra monomeri
e che liberano una molecola d’acqua per ogni legame
covalente formato vengono chiamate reazioni di
condensazione.
Una singola catena di aa è chiamata polipeptide
(oligopeptide se composta da meno di 30 aa). Ogni
polipeptide ha un gruppo aminico libero (estremità Nterminale) e un gruppo carbossilico libero all’altra
(estremità C-terminale).
LEGAME PEPTIDICO
+ NH
3
– CHR1 – COO +NH –
3
CHR2 – COO -
H2O
O
II
+NH – CHR – C – N – CHR – COO 3
1
2
I
H
Legame peptidico
STRUTTURA DELLE PROTEINE
La maggior parte delle proteine è costituita da più di una
catena polipeptidica.
Anche se una proteina potrebbe assumere un grande
numero di forme diverse, dette conformazioni, la maggior
parte delle catene peptidiche si ripiega in una determinata,
(la sua unica) conformazione detta nativa.
Uno degli elementi che più incidono sulle modalità di
ripiegamento di una proteina è la distribuzione delle catene
laterali polari e non polari.
Le catene laterali idrofobe tendono a rimanere all’interno
della proteina, in modo da evitare il contatto con l’ambiente
acquoso, mentre le catene polari (idrofiliche) stanno
all’esterno, dove reagiscono con altri gruppi polari o con
l’acqua.
STRUTTURA DELLE PROTEINE
Nella struttura delle proteine sono individuabili 4 livelli di
organizzazione.
1. Struttura primaria :
sequenza lineare di aminoacidi
2. Struttura secondaria
Ripiegamento delle catene 1ie in strutture regolari
(α-elica o foglietto β) a dare una configurazione
tridimensionale necessaria per lo svolgimento
dell’attività biologica della proteina stessa
conformazione a spirale
α - elica
legami idrogeno
conformazione β
foglietto pieghettato
3. Struttura terziaria
Ulteriore ripiegamento ed avvolgimento della catena
polipeptidica 2ia (mantenuto da interazioni elettrostatiche,
idrofobiche e legami ad idrogeno) in una conformazione
più stabile e compatta detta dominio.
Proteine globulari
(regolatorie)
albumine (trasporto acidi grassi)
Proteine fibrose
(strutturali)
collagene: tendini
resistenza alla
tensione
α-globuline (protrombina, VLDL,LDL)
β-globuline (transferrina, HDL)
γ-globuline (immunoglobuline)
istoni (organizzazione del DNA)
elastina: vene, arterie e
polmoni estensione e deformazione senza
danni per i tessuti
4. Struttura quaternaria
diverse catene polipeptidiche in str. 3ia tenute insieme da
forze elettrostatiche si associano a formare una singola
proteina
Emoglobina
4 subunità proteiche
ognuna associata ad
un gruppo EME (anello
al cui interno c’è lo
ione ferroso che lega
l’ossigeno)
PROTEINE CONIUGATE
Quando la proteina è associata ad altre molecole organiche o gruppi chimici
Glicoproteine
(responsabili
del
riconoscimento
antigenico e dei rapporti intercellulari, ormoni ipofisari,
globuline)
Lipoproteine (VLDL, LDL, HDL)
Fosfoproteine (dentina e caseina)
Cromoproteine (mioglobina, emoglobina)
FUNZIONE ENZIMATICA
DELLE PROTEINE
Gli
enzimi catalitici sono proteine in grado di accelerare la
velocità di una reazione senza alterarne l’equilibrio, senza entrare a
far parte dei prodotti della reazione stessa e senza risultare alterate
al termine del processo.
Viene chiamato substrato la sostanza che subisce una
trasformazione durante la reazione catalizzata dall’enzima
L’enzima possiede un sito di legame che riconosce e lega il
substrato e un sito catalitico che lo catalizza.
Il legame enzima-substrato può avvenire secondo 2 modalità:
• chiave-serratura : enzima e substrato
complementari per forma e carica elettrica
risultano
essere
• adesione indotta : il substrato induce l’enzima ad un cambio
conformazionale che renda possibile il legame e la conseguente
reazione catalitica
substrato
sito
attivo
Ingresso del substrato nel sito
attivo dell’enzima
L’enzima cambia
conformazione man mano che
il substrato si lega
Complesso
enzima-substrato
Complesso
enzima-prodotti
prodotti
Uscita dei prodotti
dal sito attivo
dell’enzima
L’attività catalitica degli enzimi non è costante né riguardo il
numero né riguardo il tipo di reazioni che avvengono, ma viene
regolata in base alle necessità metaboliche della cellula.
Spesso un enzima che
catalizza una reazione viene
inibito o attivato dal prodotto
ultimo della reazione mediante
un meccanismo di feed-back
(retroazione) negativo o positivo.
Inibizione competitiva
inibitore
enzima
L’enzima lega
l’inibitore
L’inibitore compete
con il substrato
Gli enzimi spesso contengono piccole molecole strettamente
legate dette coenzimi, cofattori enzimatici di natura organica, che
aiutano gli enzimi ad esplicitare la loro attività catalitica.
La maggior parte degli enzimi ha suffisso in – asi (ligasi, liasi, etc)
e derivano dal nome della sostanza su cui agisce l’enzima
(substrato) e dal nome della reazione che catalizza (es. malico
deidrogenasi).
ACIDI NUCLEICI
Macromolecole di grande complessità chiamate così
perché sono collocate nel nucleo delle cellule.
L’unità di base è il NUCLEOTIDE
radicale
fosforico
zucchero pentoso
ribosio o
desossiribosio
A
G
C
T
U
adenina
guanina
citosina
timina
uracile
DNA
Zucchero: desossiribosio
Gruppo fosfato
Basi: adenina
guanina
citosina
timina
RNA
Zucchero: ribosio
Gruppo fosfato
Basi: adenina
guanina
citosina
uracile
Basi azotate
Sono suddivise in due gruppi a seconda della loro struttura:
PURINE
Costituite da due anelli appaiati
A = adenina
G = guanina
PIRIMIDINE
Costituite da un solo anello
C = citosina
T = timina (solo nel DNA)
U = uracile (solo nel RNA)
Nucleoside = base azotata + zucchero pentoso
Nucleotide = base azotata + zucchero pentoso + gr. fosfato
DNA
acido desossiribonucleico
Trasmissione dell’informazione genetica
Non esce mai dal nucleo
MODEDLLO A DOPPIA ELICA
2 filamenti nucleotidici paralleli
Il collegamento avviene tra le basi
complementari dei due filamenti
che si abbinano a coppie esclusive
A
T
C
G
RNA
acido ribonucleico
Trasporta fuori dal nucleo le informazioni
genetiche dopo averle ricopiate dal
DNA
È responsabile della sintesi delle proteine
MODEDLLO A SINGOLA ELICA
1 solo filamento di nucleotidi
RNA
acido ribonucleico
RNA messaggero
mRNA
singolo filamento
complementare di DNA
trasferisce fuori dal
nucleo le informazioni
genetiche
RNA ribosomiale
rRNA
RNA di trasporto
tRNA
trasporta gli
aminoacidi nella
sintesi proteica
insieme a proteine
costituisce i ribosomi
dove avviene la
sintesi proteica
I nucleotidi, sono altresì molecole in grado di fornire energia a
tutte quelle reazioni di sintesi che lo richiedono (sintesi delle
proteine, degli ac.nucleici, dei polisaccaridi, etc…) perciò entrano
nella composizione anche di…
ATP
NADP
adenosin trifosfato
nicotinamide-adenindinucleotide
fosfato
accumulatore di energia
trasporto di ioni H +
FAD
flavin-adenin-dinucleotide
trasporto di ioni H +
VITAMINE
Composti organici eterogenei
necessari in dose minime, ma indispensabili per la
sopravvivenza delle cellule
no valore energetico
ottenibili attraverso una dieta equilibrata
bioregolatori (cofattori enzimatici)
fattori di crescita (A, D)
strutture nervose (B, PP)
resistenza ad infezioni e radicali liberi (A, C, E)
protezione della pelle
prevenzione da tumori
suddivise in 2 gruppi a seconda della solubilità in acqua o
nei grassi
LIPOSOLUBILI
IDROSOLUBILI
VITAMINE LIPOSOLUBILI
ergocalciferolo
tocoferolo
A
D
E
K
retinolo
VIT.
PRINCIPALI
FUNZIONI
SINTOMI DA
CARENZA
PRINCIPALI
FONTI ALIMENTARI
Interviene nel meccanismo
della visione, favorisce il
mantenimento degli epiteli,
immunostimolante, protegge
dal cancro
Anemia, diarrea,
cecità notturna,
depressione del
sistema
immunitario,
lesioni oculari
Fegato, uova, burro, spinaci ed
altri vegetali a foglie verde
scuro, broccoli, meloni,
albicocche, carote ed altri frutti
color arancio
Mineralizzazione delle ossa e
corretta utilizzazione del
calcio e del fosforo
Rachitismo nel
bambino e fragilità
ossea nell’adulto
Fegato, uova, pesce azzurro
(sardine).
Proviene anche dalla sintesi
endogena del colesterolo
Antiossidante, blocca la
formazione dei radicali liberi,
protegge le membrane
cellulari
Anemia, debolezza,
crampi
Olii vegetali non raffinati, germe
di grano, semi, noci, vegetali a
foglia verde
Interviene nel meccanismo
della coagulazione del
sangue, antiemorragica
Emorragie o
ritardato tempo di
coagulazione
Broccoli, cavoli, vegetali a foglia
verde, fegato.
Viene anche sintetizzata dai
batteri del tratto intestinale.
VITAMINE IDROSULUBILI
niacina
piridossina
acido
pantotenico
B6
B5
B3/PP
B2
riboflavina
B1
tiamina
VIT.
PRINCIPALI
FUNZIONI
SINTOMI DA
CARENZA
PRINCIPALI
FONTI ALIMENTARI
Cofattore nel metabolismo
energetico dei carboidrati,
stimola l’appetito e le funzioni
del sistema nervoso
Problemi cardiaci,
inappetenza,
debolezza, insonnia,
irritabilità
degenerazione del
sistema nervoso
Presente in moltissimi
alimenti, soprattutto cereali
integrali, legumi, maiale, noci
È in molteplici reazioni
metaboliche, aiuta la visione
e la pelle
Lingua magenta, ferite
agli angoli della bocca,
arrossamento degli
occhi
Latte e derivati, carne,
cereali integrali, vegetali
verdi
Coenzima nella respirazione
cellulare(componente del
NADP), aiuta la pelle e i
sistemi digerente e nervoso
Diarrea, debolezza,
alterazioni mentali fino
al delirio, glossite,
pellagra
Olatte, carne, uova,pesce,
cereali integrali,frutta secca
ed altri alimenti proteici
Costituisce il coenzima A
utilizzato nel metabolismo
energetico
Insonnia, vomito,
disturbi intestinali
Largamente diffuso negli
alimenti
Ha un ruolo essenziale nella
regolazione del metabolismo
delle proteine e dei grassi ed è
la più importante per il
sistema immunitario,
regolazione dell’umore.
Anemia, glossite,
irritabilità, convulsioni,
deterioramento
dell’immunità umorale
e cellulo-mediata
Cereali integrali, vegetali
verdi, legumi, carne, pesce
VITAMINE IDROSULUBILI
biotina
B9
B12
cobalamina
acido ascorbico
H
C
acido folico
VIT.
PRINCIPALI
FUNZIONI
SINTOMI DA
CARENZA
PRINCIPALI
FONTI ALIMENTARI
Ha un ruolo importante nella
formazione dell’emoglobina
ed azione stimolante sul
sistema immunitario
Disturbi intestinali,
depressione del sistema
immunitario, anemia
megaloblastica,
confusione mentale,
spina bifida nel feto
Vegetali a foglia verde,
legumi, semi, fegato
Fa parte di un coenzima
utilizzato nella sintesi di nuove
cellule. Interviene nella
formazione dei globuli rossi.
Anemia, glossite,
affaticamento,
degenerazione del
sistema nervoso,
depressione
Alimenti di origine
animale: carne, pesce,
latte, formaggi, uova
Fa parte di un coenzima
utilizzato nel metabolismo dei
grassi e dei carboidrati e
coinvolto nella sintesi degli
aminoacidi
Inappetenza, nausea,
depressione, debolezza,
perdita di capelli,
dermatiti, anomala attività
cardiaca
Largamente diffusa negli
alimenti, in modo
particolare in: legumi,
uova, fegato, funghi,
cacao, mandorle.
Antiossidante, interviene
nelle sintesi del collagene e
della tiroxina, aumenta la
resistenza alle infezioni,
aiuta l’assorbimento del
ferro, contrasta lo stress.
Frequenti infezioni,
anemia, gengive
sanguinanti, depressione,
fragilità capillare e ossea,
scorbuto
Agrumi, broccoli, cavoli,
melone, fragole, kiwi,
pomodori, papaia,
mango, peperoni, patate,
lattuga.