Chimica Inorganica e Laboratorio
Esperienza n. 4: decavanadato di ammonio esaidrato
A.A. 2016/2017
L’esperienza consiste nella sintesi del decavanadato di ammonio esaidrato (NH4)6V10O28·6H2O e nell’analisi del sale
mediante la determinazione del suo contenuto di vanadio espresso come percentuale in peso. Lo studente esegua con
attenzione ogni operazione, riportando ordinatamente nel proprio quaderno di laboratorio tutti i dettagli ed i calcoli.
1. Generalità
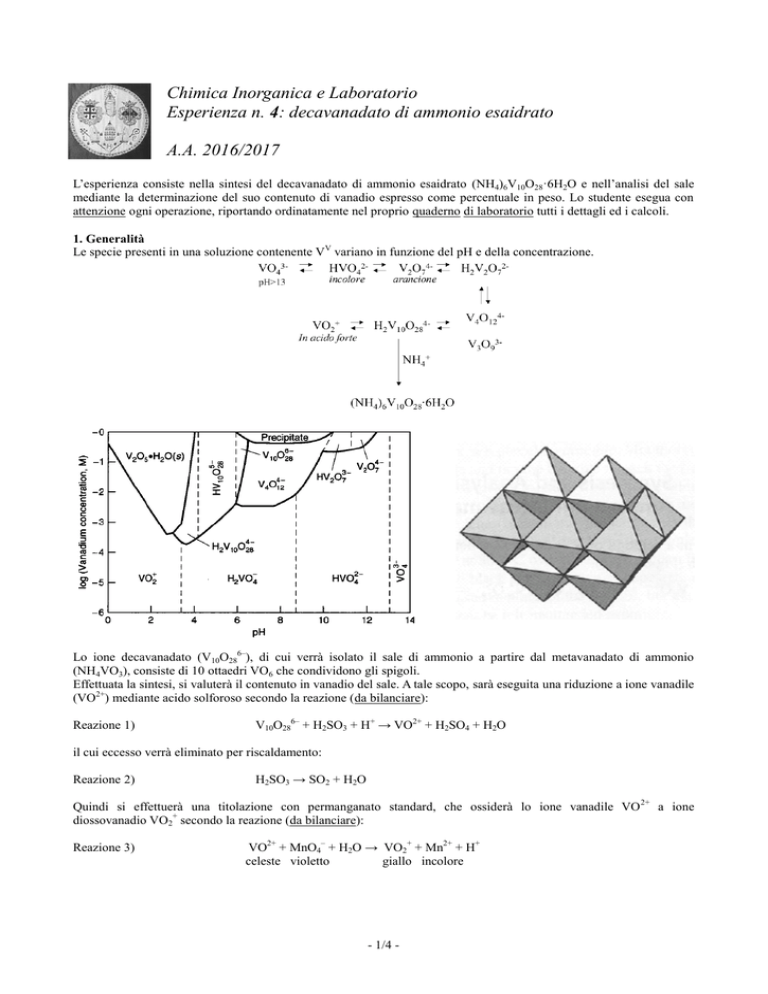
Le specie presenti in una soluzione contenente VV variano in funzione del pH e della concentrazione.
Lo ione decavanadato (V10O286–), di cui verrà isolato il sale di ammonio a partire dal metavanadato di ammonio
(NH4VO3), consiste di 10 ottaedri VO6 che condividono gli spigoli.
Effettuata la sintesi, si valuterà il contenuto in vanadio del sale. A tale scopo, sarà eseguita una riduzione a ione vanadile
(VO2+) mediante acido solforoso secondo la reazione (da bilanciare):
Reazione 1)
V10O286– + H2SO3 + H+ → VO2+ + H2SO4 + H2O
il cui eccesso verrà eliminato per riscaldamento:
Reazione 2)
H2SO3 → SO2 + H2O
Quindi si effettuerà una titolazione con permanganato standard, che ossiderà lo ione vanadile VO 2+ a ione
diossovanadio VO2+ secondo la reazione (da bilanciare):
Reazione 3)
VO2+ + MnO4– + H2O → VO2+ + Mn2+ + H+
celeste violetto
giallo incolore
- 1/4 -
2.Parte Sperimentale
2.1 Preparazione delle soluzioni
Si preparino le seguenti soluzioni:
a) KMnO4 0.020 M
130 mL per gruppo
b) CH3COOH 50% v/v
5 mL per gruppo
c) H2SO4 1.5 M
150 mL per gruppo
diluizione da normex
diluizione da glaciale
diluizione da 96%
2.2 Sintesi di (NH4)6V10O28·6H2O
a) Pesare mediante bilancia tecnica (± 0.01 g) 3.00 g di metavanadato di ammonio (NH 4VO3).
b) Sciogliere sotto agitazione a caldo il campione pesato in 100 mL di acqua distillata.
c) Filtrare la soluzione mediante un filtro a pieghe ed aggiungere goccia a goccia sotto agitazione 4 mL (misurati
mediante una pipetta graduata o un cilindro graduato) di una soluzione acquosa di acido acetico al 50% v/v.
d) Aggiungere, sempre sotto agitazione, 150 mL di alcol etilico denaturato (95% v/v), misurati mediante un
cilindro graduato.
e) Raffreddare per 15 minuti la soluzione in un bagno di acqua e ghiaccio. Nel frattempo, raffreddare a parte in
bagno di ghiaccio 50 mL di alcol etilico (95% v/v).
f) Filtrare il precipitato arancione alla pompa ad acqua o a membrana mediante un filtro di Gooch a porosità 3.
Lavare il precipitato con due o tre aliquote da 15 mL di alcol etilico freddo (0°C). Effettuare un ultimo
lavaggio con etere dietilico.
g) Seccare il prodotto alla pompa e, dopo essersi accertati che l'etere dietilico sia completamente evaporato porre
il campione in stufa a 60°C per venti minuti.
h) Pesare e calcolare la resa.
2.3 Analisi permanganometrica di (NH4)6V10O28·6H2O
a) Pesare alla bilancia analitica (± 0.0001 g) un campione di circa 0.3 g di decavanadato di ammonio esaidrato in
una beuta da 250 mL e sciogliere con 40 mL di acido solforico 1.5 M (scaldare moderatamente se necessario),
misurati mediante un cilindro graduato.
b) Sotto cappa, aggiungere 50 mL di acqua distillata ed un lieve eccesso (15 %) di solfito di sodio (da calcolare
sulla base della quantità pesata di decavanadato di ammonio esaidrato e della stechiometria della reazione 1).
Agitare fino a dissoluzione.
c) Dopo 5 minuti, verificare che il colore della soluzione sia celeste per la presenza del vanadile (VO2+). A questo
punto, portare all’ebollizione per 15 minuti, per allontanare l’eccesso di acido solforoso sotto forma di anidride
solforosa (reazione 2).
d) Titolare a caldo con permanganato di potassio 0.020 M usando una buretta da 50 mL. Il punto finale (reazione
3) si ha quando la colorazione gialla, dovuta allo ione VO 2+, assume una sfumatura scura (dovuta all’eccesso di
MnO4–) che persiste per almeno 15 secondi.
e) Ripetere la titolazione altre due volte dopo aver azzerato la buretta. Se uno dei valori ottenuti fosse
sensibilmente differente dagli altri eseguire una quarta titolazione.
f) Sulla base dei risultati delle titolazioni calcolare la percentuale in peso media di vanadio (rapporto fra la massa
dell'elemento nel composto ed il peso formula) e confrontare con il risultato teorico (percentuale in peso del
vanadio calcolata sulla base della formula minima).
Attenzione: il permanganato di potassio reagisce con i substrati organici ossidabili. Evitare acetone e sapone. Lavare
invece il materiale utilizzato con acido cloridrico diluito.
3. Esercizi e calcoli
Ogni studente risolva nel proprio quaderno di laboratorio i seguenti punti:
1) Si bilancino tutte le reazioni chimiche coinvolte nei processi osservati.
2) Si calcoli il valore di resa ottenuta nella sintesi del decavanadato di ammonio esaidrato.
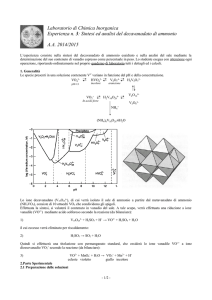
3) Si riportino i valori delle tre pesate W1–3 di analita e dei corrispondenti tre volumi V 1–3 della soluzione di
permanganato di potassio impiegati durante le titolazioni corrispondenti e si utilizzi il test Q per verificare la
congruenza dei risultati delle tre titolazioni [Q(90%; n = 3) = 0.941].
4) Si calcoli la percentuale in peso di vanadio nel campione di decavanadato di ammonio determinata
sperimentalmente per ogni titolazione e l'errore relativo e assoluto.
5) Si calcoli il valore medio della percentuale in peso e la deviazione standard s p/p e la si confronti con il valore
p/p%calc previsto sulla base della formula del composto (NH4)6V10O28·6H2O.
4. Bibliografia
a) F. A. Cotton e G. Wilkinson, Chimica Inorganica, 3a edizione, 1984, CEA, Cap. 21-B pag. 728.
b) D. C. Harris, Elementi di Chimica Analitica, 1997, Zanichelli, pag. 405.
c) G. Charlot, Analisi Chimica Qualitativa, 1977, Piccin, pag. 332.
d) G.G. Long, R. L. Stanfield e C. F. Hentz, J. Chem. Ed., 1979, 56, 195.
- 2/4 -
Esperienza 4: Allegato A
Gruppo N.
_________________________________
Componente 1
_________________________________
Componente 2
_________________________________
Componente 3
_________________________________
Punto 2.2 Sintesi di (NH4)6V10O28·6H2O
Massa di NH4VO3 pesata
________________ ± _________________ g
Massa di (NH4)6V10O28·6H2O ottenuta
________________ ± _________________ g
Resa%
________________ ± _________________ g %
Reazione di sintesi ____________________________________________________________________
Punto 2.3 Analisi permanganometrica di (NH4)6V10O28·6H2O
Valore teorico di p/p% per V in (NH4)6V10O28·6H2O
________________%
Massa di (NH4)6V10O28·6H2O pesata1
________________g ± _________________g
Massa di (NH4)6V10O28·6H2O pesata2
________________g ± _________________g
Massa di (NH4)6V10O28·6H2O pesata3
________________g ± _________________g
Massa di (NH4)6V10O28·6H2O pesata4
________________g ± _________________g
Reazione di riduzione (solfito):
______________________________________________________________________
Reazione di ossidazione (permanganato)
______________________________________________________________________
Concentrazione del titolante KMnO4
________________M ± _________________M
Volume di KMnO4 nella titolazione 1
_______________mL ± _________________mL (titolazione 1)
Volume di KMnO4 nella titolazione 2
_______________mL ± _________________mL (titolazione 2)
Volume di KMnO4 nella titolazione 3
_______________mL ± _________________mL (titolazione 3)
Volume di KMnO4 nella titolazione 3
_______________mL ± _________________mL (titolazione 4)
Valore sperimentale di p/p% per V in (NH4)6V10O28·6H2O
________________% (titolazione 1)
Valore sperimentale di p/p% per V in (NH4)6V10O28·6H2O
________________% (titolazione 2)
Valore sperimentale di p/p% per V in (NH4)6V10O28·6H2O
________________% (titolazione 3)
Valore sperimentale di p/p% per V in (NH4)6V10O28·6H2O
________________% (titolazione 4)
Valori non accettabili (test Q)?
SI: Quale?________ NO
- 3/4 -
Valore sperimentale medio di p/p% per V in (NH4)6V10O28·6H2O
________________%
Valore stechiometrico di p/p% per V calcolato per (NH4)6V10O28·6H2O_______________%
Scarto fra i valore sperimentale e calcolato di p/p%
________________%
Commento:
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
- 4/4 -