Laboratorio di Chimica Inorganica
Esperienza n. 3: Sintesi ed analisi del decavanadato di ammonio
A.A. 2014/2015
L’esperienza consiste nella sintesi del decavanadato di ammonio esaidrato e nella analisi del sale mediante la
determinazione del suo contenuto di vanadio espresso come percentuale in peso. Lo studente esegua con attenzione ogni
operazione, riportando ordinatamente nel proprio quaderno di laboratorio tutti i dettagli ed i calcoli.
1. Generalità
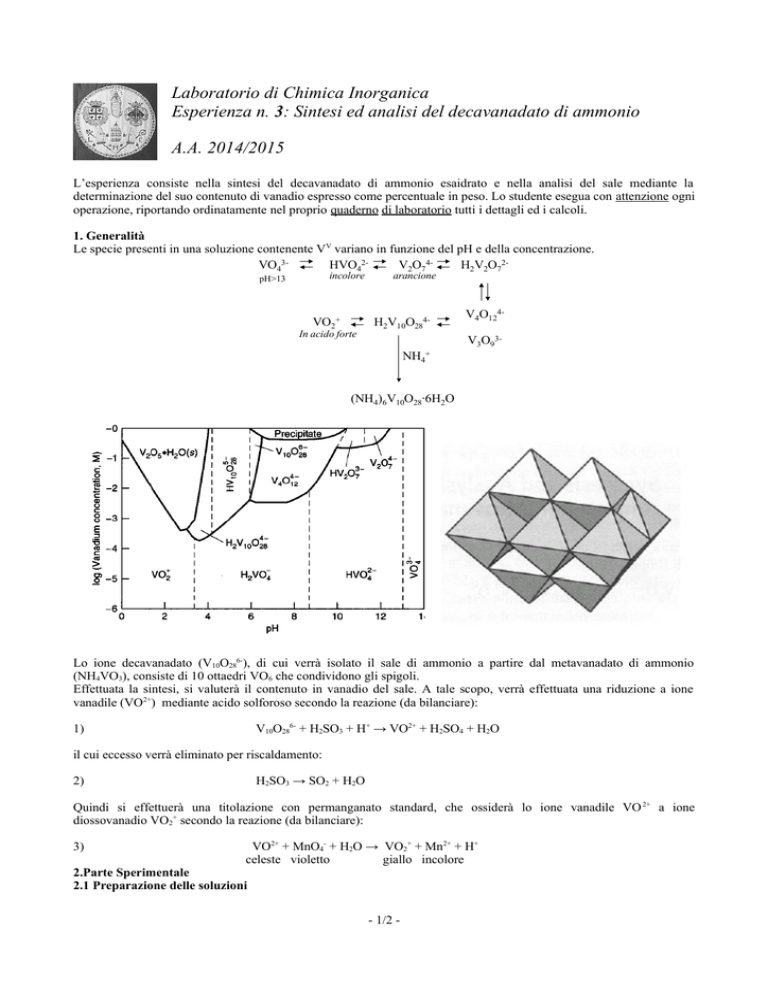
Le specie presenti in una soluzione contenente VV variano in funzione del pH e della concentrazione.
VO43HVO42V2O74H2V2O72incolore
pH>13
VO2+
In acido forte
arancione
H2V10O284-
V4O124V3O93-
NH4
+
(NH4)6V10O28∙6H2O
Lo ione decavanadato (V10O286-), di cui verrà isolato il sale di ammonio a partire dal metavanadato di ammonio
(NH4VO3), consiste di 10 ottaedri VO6 che condividono gli spigoli.
Effettuata la sintesi, si valuterà il contenuto in vanadio del sale. A tale scopo, verrà effettuata una riduzione a ione
vanadile (VO2+) mediante acido solforoso secondo la reazione (da bilanciare):
1)
V10O286- + H2SO3 + H+ → VO2+ + H2SO4 + H2O
il cui eccesso verrà eliminato per riscaldamento:
2)
H2SO3 → SO2 + H2O
Quindi si effettuerà una titolazione con permanganato standard, che ossiderà lo ione vanadile VO 2+ a ione
diossovanadio VO2+ secondo la reazione (da bilanciare):
3)
VO2+ + MnO4- + H2O → VO2+ + Mn2+ + H+
celeste violetto
giallo incolore
2.Parte Sperimentale
2.1 Preparazione delle soluzioni
- 1/2 -
Si preparino le seguenti soluzioni:
1) KMnO4
0.02 M
2) CH3COOH 50% v/v
3) H2SO4
1.5 M
130 mL per gruppo
5 mL per gruppo
150 mL per gruppo
diluizione da normex
diluizione da glaciale
diluizione da 96%
2.2 Sintesi di (NH4)6V10O28·6H2O
1) Pesare mediante bilancia tecnica (± 0.01 g) 3.00 g di metavanadato di ammonio (NH4VO3).
2) Sciogliere sotto agitazione a caldo il campione pesato in 100 mL di acqua distillata.
3) Filtrare la soluzione mediante un filtro a pieghe ed aggiungere goccia a goccia sotto agitazione 4 mL (misurati
mediante una pipetta graduata o un cilindro graduato) di una soluzione acquosa di acido acetico al 50% v/v.
4) Aggiungere, sempre sotto agitazione, 150 mL di alcol etilico denaturato (95% v/v), misurati mediante un cilindro
graduato.
5) Raffreddare per 15 minuti la soluzione in un bagno di acqua e ghiaccio. Nel frattempo, raffreddare a parte in bagno
di ghiaccio 50 mL di alcol etilico (95% v/v).
6) Filtrare il precipitato arancione alla pompa ad acqua o a membrana mediante un filtro di Gooch a porosità 3. Lavare
il precipitato con due-tre aliquote da 15 mL di alcol etilico freddo (0°C). Effettuare un ultimo lavaggio con etere
dietilico.
7) Seccare il prodotto alla pompa e, dopo essersi accertati che l'etere dietilico sia completamente evaporato porre il
campione in stufa a 60°C per venti minuti.
8) Pesare e calcolare la resa.
2.3 Analisi del vanadio
1) Pesare alla bilancia analitica (± 0.0001 g) un campione di circa 0.3 g di decavanadato di ammonio esaidrato in una
beuta da 250 mL e sciogliere con 40 mL di acido solforico 1.5 M (scaldare moderatamente se necessario), misurati
mediante un cilindro graduato.
2) Sotto cappa, aggiungere 50 mL di acqua distillata ed un lieve eccesso (15 %) di solfito di sodio (da calcolare sulla
base della quantità pesata di decavanadato di ammonio esaidrato e della stechiometria della reazione 1). Agitare
fino a dissoluzione.
3) Dopo 5 minuti, verificare che il colore della soluzione sia celeste per la presenza del vanadile (VO 2+). A questo
punto, portare all’ebollizione per 15 minuti, per allontanare l’eccesso di acido solforoso sotto forma di anidride
solforosa (reazione 2).
4) Titolare a caldo con permanganato di potassio 0.02 M usando una buretta da 50 mL. Il punto finale (reazione 3) si
ha quando la colorazione gialla, dovuta allo ione VO 2+, assume una sfumatura scura (dovuta all’eccesso di MnO 4-)
che persiste per almeno 15 secondi.
5) Ripetere la titolazione altre due volte dopo aver azzerato la buretta.
6) Sulla base dei risultati delle titolazioni calcolare la percentuale in peso media di vanadio (rapporto fra la massa
dell'elemento nel composto ed il peso formula) e confrontare con il risultato teorico (percentuale in peso del
vanadio calcolata sulla base della formula minima).
Attenzione: il permanganato di potassio reagisce con i substrati organici ossidabili. Evitare acetone e sapone. Lavare
invece il materiale utilizzato con acido cloridrico diluito.
3. Esercizi e calcoli
Ogni studente risolva nel proprio quaderno di laboratorio i seguenti punti:
1) Si bilancino tutte le reazioni chimiche coinvolte nei processi osservati.
2) Si calcoli il valore di resa ottenuta nella sintesi del decavanadato di ammonio esaidrato.
3) Si riportino i valori delle tre pesate W 1-3 di analita e dei corrispondenti tre volumi V 1-3 della soluzione di
permanganato di potassio impiegati durante le titolazioni corrispondenti e si utilizzi il test Q per verificare la
congruenza dei risultati delle tre titolazioni [Q(90%; n = 3) = 0.941].
4) Si calcoli la percentuale in peso di vanadio nel campione di decavanadato di ammonio determinata
sperimentalmente per ogni titolazione e l'errore relativo e assoluto.
5) Si calcoli il valore medio della percentuale in peso e la deviazione standard s p/p e la si confronti con il valore
p/p%calc previsto sulla base della formula del composto (NH4)6V10O28·6H2O.
6) Si comunichi al docente il valore medio di percentuale in peso di vanadio ottenuto sperimentalmente.
4. Bibliografia
a) F. A. Cotton e G. Wilkinson, Chimica Inorganica, 3a edizione, 1984, CEA, Cap. 21-B pag. 728.
b) D. C. Harris, Elementi di Chimica Analitica, 1997, Zanichelli, pag. 405.
c) G. Charlot, Analisi Chimica Qualitativa, 1977, Piccin, pag. 332.
d) G.G. Long, R. L. Stanfield, C. F. Hentz, J. Chem. Ed., 1979, 56, 195.
- 2/2 -