I LEGAMI DEBOLI
1
I LEGAMI DEBOLI
Legame a idrogeno
Legami dipolari:
Interazione ione-dipolo;
Interazioni di Van der Waals:
• Dipolo permanente-dipolo permanente;
• Dipolo permanente-dipolo indotto;
• Dipolo istantaneo-dipolo indotto (forze di London)
2
Legame ionico
Legame covalente
Legame metallico
E = 100-5000 kJ/mol
Legame a idrogeno
Legami dipolari
E < 100 kJ/mol
3
Legame a idrogeno
A—H····B
E = 10-60 kJ/mol
A, B: atomi piccoli e molto elettronegativi
N, O, F, (Cl)
δ- δ+
δ-
A—H····B
a ponte
A e B → stessa molecola → LEGAME A IDROGENO INTRAMOLECOLARE
4
A e B → molecole diverse → LEGAME A IDROGENO INTERMOLECOLARE
Legame a idrogeno nell’acqua
δ
-
2δ
-
δ
2δ
δ
δ
5
Legame a idrogeno nel ghiaccio
6
Legame a idrogeno
Struttura del ghiaccio
7
Legame a idrogeno in altri composti
HF
R-OH
R
R
R
O
O
O
H
H
F
H
H
F
H
F
H
Legame idrogeno
intramolecolare
R-COOH
O
R—C
O
H
H
O
O
C—R
Legame idrogeno
intermolecolare
8
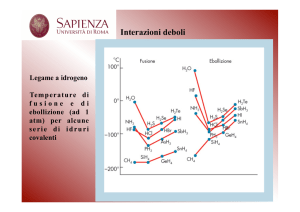
Temperatura di ebollizione degli idruri degli elementi dei
gruppi 14, 15, 16 e 17
Aumento delle temperature di
ebollizione e di fusione
9
Legami dipolari
Interazioni IONE-DIPOLO
Interazioni di Van der Waals
Sono interazioni di natura elettrostatica. Ogni carica elettrica (ione o
dipolo elettrico associato ad una molecola) genera un campo elettrico
che può:
i) indurre orientazione di eventuali dipoli presenti;
ii) indurre polarizzazione in molecole polari;
iii) causare la formazione di dipoli indotti in molecole apolari.
10
Interazioni ione-dipolo: idratazione dei cationi in acqua
Soluzioni di composti ionici (NaCl)
in solventi polari (H2O)
NaCl +n H2O → Na(H2O)x + Cl(H2O)y
+
H
H
δ+
O
2δ-
H
O
-
H
O
H
O
H
Na+
O
H
Interazioni
ione-dipolo
+
ione-(dipolo indotto)
H
H
O
H
O
H
H
H
11
Interazioni ione-dipolo
Soluzioni di composti ionici (NaCl)
in solventi polari (H2O)
NaCl +n H2O → Na(H2O)x+ + Cl(H2O)yEnergia di interazione fra 2 ioni:
1
1
E∝
E
∝
nel vuoto
4πε 0 r
4πεr
ε/εo = 78
in H2O (25°C)
ε/εo = 33
in CH3OH (25°C)
ε/εo = 2.27
in C6H6 (25°C)
ε/εo = 2.24
in CCl4 (25°C)
solvente con costante dielettrica ε
Solubilità in solventi polari
Insolubilità in solventi apolari
ε = costante dielettrica ed ε0 = costante dielettrica nel vuoto
12
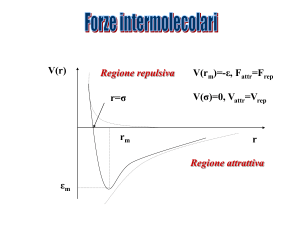
Interazioni di Van der Waals
Forze di attrazione tra molecole in fase gas, liquida o solida
Sono forze a corto raggio di natura elettrostatica
• interazioni dipolo permanente - dipolo permanente
Molecole
• interazioni dipolo permanente - dipolo indotto
polari
• interazioni dipolo istantaneo - dipolo indotto
(forze di London)
Molecole
apolari
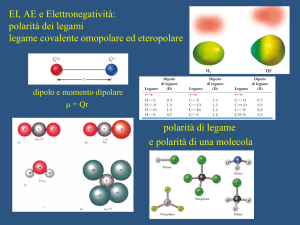
+ –
+ –
+ –
+ –
H2, N2, O2, CH4, He, Ne, ...
Spostamenti temporanei di carica
HCl
↓
Dipolo istantaneo
↓
Energia di interazione
k
dipolo istantaneo -dipolo E = −
Dipolo indotto
indotto
r6
13
Temperature normali di fusione ed ebollizione °C
Sostanza
Temp. fusione °C
Temp.ebollizione
ebollizione°C
°C
Temp.
GAS NOBILI
ALOGENI
14