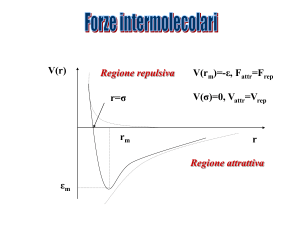
FORZE INTERMOLECOLARI
Le forze intermolecolari sono legami di tipo debole (2-10 kcal/mole) dovuti ad interazioni di natura
elettrostatica che si formano tra particelle portatrici di carche elettriche parziali. Esse possono essere di
diverso tipo a seconda del tipo di interazione:
- ione - dipolo
- dipolo - dipolo
- dipolo - dipolo indotto
- dipolo temporaneo - dipolo temporaneo
Le prime tre tipologie di interazione sono dette forze di Van der Waals, mentre quelle dell’ultimo tipo
vengono dette interazioni di London. Esse, come abbiamo già detto, sono responsabili dell’esistenza
della materia nelle fasi condensate e della miscibilità relativa delle varie sostanze. Per capire in cosa
consistono è indispensabile definire i tipi di particelle tra cui si instaurano: il dipolo, il dipolo indotto ed
il dipolo temporaneo.
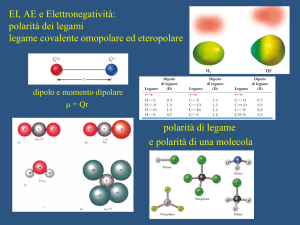
Il dipolo è una molecola polarizzata a causa della diversa elettronegatività degli atomi che si legano per
formarla. I legami covalenti che si formano sono dunque polarizzati e possono determinare una
polarizzazione dell'intera molecola.
Il dipolo indotto è una molecola apolare che viene polarizzata a causa della vicinanza di molecole
dipolari.
Il dipolo temporaneo invece può essere presente anche in un sistema completamente apolare. Esso si
forma a causa della diversa posizione nel tempo degli elettroni all’interno degli orbitali. Tali "dipoli"
possono quindi interagire tra di loro in quanto ogni carica elettrica, anche parziale, genera un campo
elettrico nel quale si orientano gli altri eventuali dipoli presenti. Questo fa sì che si abbia un’interazione
fra cariche elettriche parziali di segno opposto, meccanismo che è alla base delle interazioni di tipo
debole. L'entità di tali forze diminuisce progressivamente passando dalle interazioni dipolo - dipolo alle
interazioni dipolo temporaneo - dipolo temporaneo.
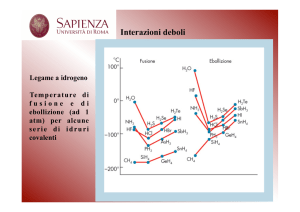
Legame idrogeno.
Un tipo particolare di interazione dipolo - dipolo è il legame idrogeno. Tale legame si instaura quando
il dipolo è costituito da una molecola all’interno della quale si trova un atomo di idrogeno legato ad un
atomo fortemente elettronegativo. In questo caso si genera un dipolo la cui carica parziale positiva è
condensata su un atomo molto piccolo (l’atomo di idrogeno) e che proprio per questo interagisce con
gli altri dipoli ad esso adiacenti con una forza particolarmente intensa. Nonostante la bassa energia del
legame idrogeno, esso è di grande importanza in quanto influenza profondamente le proprietà fisiche e
chimiche delle sostanze nelle quali si instaura. Nell’acqua, ad esempio, la presenza di legami idrogeno
tra le molecole fa in modo che tale sostanza abbia una densità minore allo stato solido piuttosto che allo
stato liquido, cosa che non avviene comunemente nelle altre sostanze.