DESCRIVERE LE FORZE INTERMOLECOLARI DEBOLI Le forze intermolecolari deboli sono le forze attrattive esistenti tra le molecole. La presenza di tali forze determina l’esistenza dei solidi e dei liquidi, senza queste la materia si presenterebbe solo sotto forma di stato gassoso. Infatti nei gas le molecole e gli atomi sono separati da grandi distanze, in quanto possiedono un' elevata energia cinetica. Nei liquidi le molecole o gli atomi hanno ancora possibilità di muoversi, mentre nei solidi questi si trovano in posizioni fisse. La maggiore compattezza e la minore motilità delle molecole è da imputarsi alle interazioni presenti tra di esse. Tali interazioni riguardano sia molecole polari che molecole non polari e sono conosciute come forze intermolecolari deboli o con il nome di forze di Van der Waals. Le forze di Van der Waals sono interazioni molto deboli e l'intensità di queste forze diminuisce con l’aumentare della distanza. Vi sono tre tipi fondamentali di forze di intermolecolari deboli, in ordine crescente di forza sono: • Le forze di disperzione (forze di London) • Le forze dipolo-­‐dipolo • Il legame a idrogeno • LE FORZE DI DISPERSIONE ( FORZE DI LONDON) Le forze di dispersione sono dovute alle fluttuazioni nella distribuzione elettronica all’interno delle molecole o degli atomi. Ad esempio in un atomo, solitamente la distribuzione della nuvola elettronica è simmetrica rispetto al nucleo dell'atomo; però può succedere in un determinato istante che che la distribuzione della nuvola elettronica sia asimmetrica rispetto al nucleo e addensata da un lato, il lato dove sono presenti i due elettroni assume carica parzialmente negativa (δ-­‐) e il lato privo di elettroni acquista una carica parzialmente positiva (δ+). Questa separazione di carica è nota come dipolo istantaneo (in quanto si verifica in un dato istante). Il dipolo istantaneo genera un campo elettrico che a sua volta induce un dipolo indotto sugli atomi vicini: Le forze di dispersione si instaurano nel momento in cui gli atomi si attraggono l’uno con l’altro. Tali dipoli sono transienti, variano in base alle fluttuazioni nella distribuzione degli elettroni all'interno delle nuvole elettroniche. L'intensità delle forze di dispersione aumenta all'aumentare delle dimensioni e della massa molecolare (o atomica) delle molecole (o atomo), poiché gli elettroni sono trattenuti meno fortemente dal nucleo e possono dare origine più facilmente ad un legame. •
FORZE DIPOLO – DIPOLO Le forze dipolo-­‐dipolo sono presenti in tutte le molecole polari, le quali presentano dipoli permanenti e interagiscono con i dipoli delle molecole adiacenti. Le molecole dipolari (molecole con due poli, uno positivo δ+ e l'altro negativo δ-­‐ ) creano attorno a sè deboli campi elettrici che attraggono altre molecole polari vicine. Le molecole dipolari si avvicinano e tendono a disporre i loro poli l'uno di fronte all'altro, in modo che un polo con carica δ+ sia di fronte un polo con carica δ-­‐, così facendo si raggiunge una configurazione di elevata stabilità. Nello stato gassoso non troviamo interazioni dipolo dipolo a causa dell'elevata distanza presente tra due molecole che è determinata dall'energia cinetica. Al variare della temperatura e della pressione, ovvero con l'abbassarsi della temperatura e/o all'aumentare della pressione, la distanza tra le molecole diminuisce facendo aumentare il numero di interazioni dipolo-­‐
dipolo. In queste condizioni le interazioni dipolo-­‐dipolo diventano maggiori dell'energia cinetica determinando una maggiore coesione tra le molecole e infine il passaggio dallo stato gassoso a quello liquido. Con un ulteriore diminuzione della temperatura e/o aumento della pressione le interazioni dipolo-­‐dipolo aumentano e si ha dunque il passaggio allo stato solido. Situazione contraria l'abbiamo con l'aumentare della temperatura e/o diminuzione della pressione che determina una maggiore energia cinetica che interferisce con la creazione dei legami intermolecolari dipolo-­‐dipolo. •
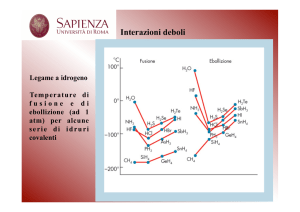
LEGAME A IDROGENO Il legame a idrogeno è un particolare tipo di interazione dipolo-­‐dipolo che si forma tra molecole nelle quali un atomo di idrogeno forma un legame covalente con un atomo di piccole dimensioni e fortemente elettronegativo, in particolare con fluoro (F), azoto (N) e ossigeno (O). Alcuni esempi sono l'acqua (H2O), l'ammoniaca (NH3) e il fluoruro di idrogeno (HF). Il legame a idrogeno viene indicato con una linea tratteggiata che unisce l'idrogeno di una molecola con l'elemento fortemente elettronegativo (F, N, O) dell'altra molecola. La sua energia di legame è superiore a quella delle altre forze intermolecolari. L'idrogeno nel dipolo che si è creato rappresenta la parte positiva (δ+). L'atomo di idrogeno, poichè è dotato di caratteristiche particolari come le piccolissime dimensioni e la presenza di un solo elettrone, queste rendono il suo campo particolarmente elettrico. Infatti atomi di maggiore dimensione atomica anche se positivizzati allo stesso modo dell'atomo di idrogeno non creano legami come quest' ultimo. La presenza del legame a idrogeno determina alcune proprietà nell' acqua, nell'ammoniaca e nel fuoruro di idrogeno. Se confrontiamo ad esempio le temperature di ebollizione dei composti HF, HCl, HBr, HI si può notare che il valore della temperatura diminuisce con il diminuire della massa molecolare ad eccezione del fluoruro di idrogeno (HF). Questo avviene perchè il fluoruro di idrogeno presenta il legame a idrogeno ed essendo un legame molto forte, per poter passare allo stato gassoso è necessaria un'energia maggiore e quindi una maggiore temperatura di ebollizione. Inoltre il legame a idrogeno spiega perchè la densità del ghiaccio sia inferiore a quella dell'acqua. Infatti quando l'acqua congela le molecole devono distanziarsi l'una dalle altre per poter formare la struttura esagonale e ordinata caratteristica del ghiaccio che è pertanto meno densa della struttura disordinata che presenta l'acqua allo stato liquido.