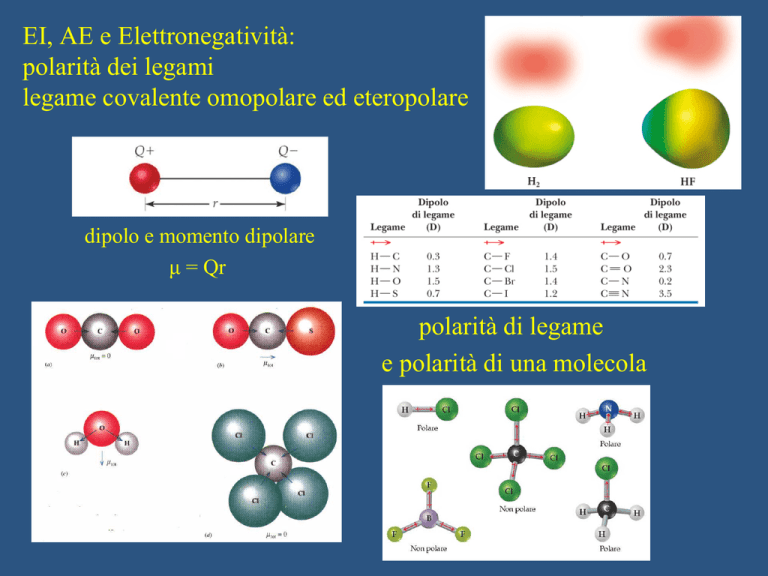
EI, AE e Elettronegatività:
polarità dei legami
legame covalente omopolare ed eteropolare
dipolo e momento dipolare
μ = Qr
polarità di legame
e polarità di una molecola
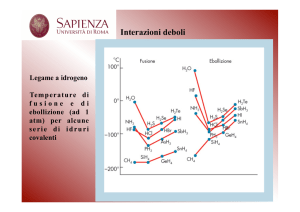
Legami intermolecolari: interazione tra le molecole, stati di aggregazione della
materia, punti di fusione e di ebollizione di una sostanza pura
Legame idrogeno:
Forze di van der Waals:
a. dipolo – dipolo
b. dipolo - dipolo indotto
c. dipolo istantaneo-dipolo
indotto (forze di dispersione di
tra H legato a atomo fortemente
elettronegativo – F, O, N – quindi H
fortemente polarizzato e atomo
fortemente elettronegativo
H2O!
London)
DNA!
L’appaiamento obbligatorio di A con T e di C con G rende i due
filamenti fra loro complementari: se uno di essi presenta la sequenza
C-T-A-C-G, l’altro non potrà che avere la sequenza complementare
G-A-T-G-C. Un filamento costituisce quindi una sorta di stampo per
l’altro.
Legame H intermolecolare…
…ma anche legame H intramolecolare
Il legame
metallico
¾ degli elementi sono metalli: 1° e 2° gruppo, gli elementi di transizione e
qualche altro.
Proprietà più caratteristiche dei metalli:
1. Elevata conducibilità elettrica e termica (flusso di e- se ddp o T)
2. Effetto fotoelettrico e termoionico (estrazione di e- con luce o per T)
3. Duttilità e malleabilità (riducibili in fili e lamine)
4. Lucentezza (assorbono tutte le radiazioni e riemettono in tutte le direzioni)
5. Elettropositività (bassi valori di EI)
Elevata mobilità
degli elettroni
Con la teoria O. M.
conduttori
isolante
semiconduttore
ΔE≤ kT
La Termodinamica studia i trasferimenti di energia:
sistema termodinamico
stato termodinamico
Chiuso
Aperto
Isolato
Variabili di stato Fisiche
cost nel tempo: Eq. Term.
Chimiche Var. nel tempo: Trasformazione
Funzioni di stato
Reversibile > all’ EQUILIBRIO
Irreversibile > SPONTANEA verso EQ.
Energia di un sistema termodinamico: Eint = Epot + Ecin
Capacità di cedere calore Q Capacità di compiere un lavoro W
La Termodinamica Chimica studia:
la variazione di energia associata ad una trasformazione
la spontaneità di una trasformazione
2° Principio: un sistema isolato evolve per
raggiungere uno stato di massima entropia.
dS ≥ 0
S ENTROPIA
ΔS = ∑ νi Si
Si ricava il criterio di spontaneità per un sistema
chiuso :
(dGs)P, T ≤ 0 H – TS = G ENERGIA LIBERA
di GIBBS
- (dGs)P, T ≥ δW’ (≠ PdV)
ΔG = ∑ νi Gi
Termochimica
L’Eint di un sistema può cambiare
variando la massa (no per sistemi chiusi),
acquistando/cedendo «calore», Q
compiendo/subendo un lavoro , W
1° Principio sulla conservazione dell’energia
ΔEint = Q + W (per sistema chiuso)
da cui:
Qp = Eint + PV = H ENTALPIA
ΔH = ∑ νi Hi > 0 ENDOTERMICA
< 0 ESOTERMICA
Stati standard, ΔH di form., comb., reazione
dG VdP SdT
Dipendenza di G da P e T:
Quindi:
G P ,T
Sostanze pure
P
dG VdP
GT0
GP,T GT0
Per solidi e liquidi
P0
GP,T GT0 nRT ln
Sostanze in miscela
dG VdP
T = cost
P,T T0 RT ln P
P
P
0
Potenziale chimico (energia libera molare
parziale del componente i-esimo)
Equilibrio: meccanico (P cost), termico (T cost) e di materia
Legge delle
masse
Kp
pC pD
pA pB
Per il calcolo del grado di avanzamento
di una reazione e quindi per la composizione
di un sistema all’equilibrio
ni
ni0
i x
di reazione
i i i 0
Equilibri omogenei
ed eterogenei
Per i gas
i i dni 0
di fase
Miscele non
reattive
Sostanze pure
Passaggi di stato
Eq. Ionici in soluzione acquosa omogenei: reazioni di trasferimento di protoni
H2 O + H2 O
H+
Acidi e Basi:
kw = [H3O+] [OH-] = 1,0x10-14
OH- + H3O+
HA + H2O
A - + H3 O +
B + H2O
OH- + BH+
Coppie acido/base coniugata
K w = Ka K b #
Scala di pH come indicatore
di acidità di una soluzione:
Quando
[HA]debole ≈ [A-]debole
soluzione tampone
pH = pKa +- 1
T = 25°C
Forti: dissociazione completa
Deboli: reazione di equilibrio
Ka costante di dissociazione acida
Kb costante di dissociazione basica
7
0
pH acido
14
pH basico
[H3O+] = [OH-]
Condizione di neutralità
pH = 7
Lavoro da una reazione redox: le pile
Zn + Cu2+ = Zn2+ + Cu
MA SE
Bilanciamento
ionico-elettronico
Schematizzazione
di una pila
Scala di potenziali
Semielementi
Termodinamica:
equazione di Nernst
Elettrodi di riferimento
NHE
E il tempo?
Cinetica Chimica
A + B -> C + D
Velocità media v = Δc/Δt
Velocità istantanea v = dc/dt
v = - dc/dt = k [c]α
k= costante cinetica
k = Ae- Ea/RT
Teoria dello stato di transizione
Catalisi omogenea
eterogenea
enzimatica
α= ordine di reazione
(sperimentale)
MECCANISMO