RASSEGNA
La patogenesi autoimmune del diabete di tipo 1
Incani M2, Baroni MG1,2
1
Endocrinologia, Dipartimento di Medicina Sperimentale, Università Sapienza di Roma, Roma; 2Endocrinologia e Diabete,
Dipartimento di Scienze Mediche e Sanità Pubblica, Università di Cagliari, Cagliari
RIASSUNTO
Il diabete di tipo 1 rappresenta un esempio patognomonico delle malattie multifattoriali. Su un background di predisposizione
genetica, fattori ambientali (multipli e differenti tra persone e popolazioni) agiscono per attivare una riposta autoimmune che
causa la distruzione delle β-cellule pancreatiche. Difetti o alterazione nella riposta innata, insieme a difetti nel controllo della
riposta immunitaria (attraverso alterazioni nella selezione clonale timica, fenomeni di mimetismo molecolare, soppressione
immune) sono tutti coinvolti nella distruzione β-cellulare. In ultimo, i linfociti T, nella loro funzione regolatoria, helper e citotossica,
sono i determinanti finali del processo autoimmune che porta al diabete di tipo 1.
SUMMARY
The autoimmune pathogenesis of type 1 diabetes
Type 1 diabetes is the pathognomonic example of a multifactorial disease. Against a background of genetic predisposition,
environmental factors (multiple and different in different patients and populations) trigger an autoimmune response that causes the
destruction of pancreatic β-cells. Altered or defective innate immunity, together with defective control of the immune response (by
alterations in clonal selection, molecular mimicry, immune suppression) are all involved in the autoimmune destruction of these cells.
Ultimately, T lymphocytes, in either their regulatory, helper or cytotoxic functions, are the final determinants of the autoimmune process
that leads to type 1 diabetes.
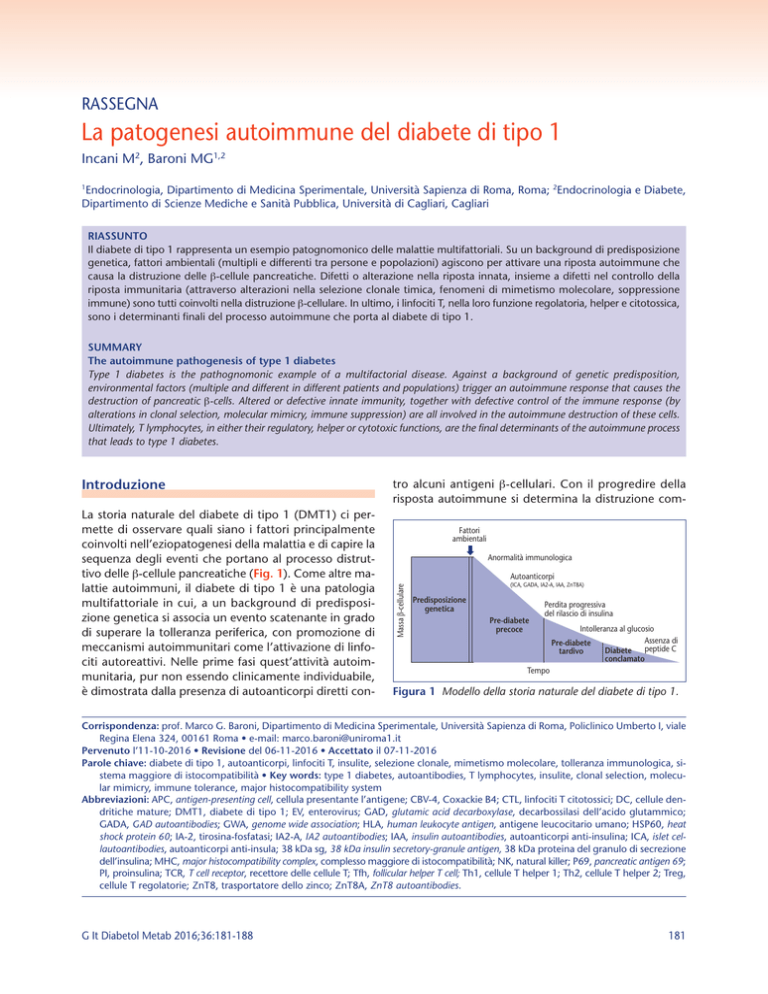
La storia naturale del diabete di tipo 1 (DMT1) ci permette di osservare quali siano i fattori principalmente
coinvolti nell’eziopatogenesi della malattia e di capire la
sequenza degli eventi che portano al processo distruttivo delle β-cellule pancreatiche (Fig. 1). Come altre malattie autoimmuni, il diabete di tipo 1 è una patologia
multifattoriale in cui, a un background di predisposizione genetica si associa un evento scatenante in grado
di superare la tolleranza periferica, con promozione di
meccanismi autoimmunitari come l’attivazione di linfociti autoreattivi. Nelle prime fasi quest’attività autoimmunitaria, pur non essendo clinicamente individuabile,
è dimostrata dalla presenza di autoanticorpi diretti con-
tro alcuni antigeni β-cellulari. Con il progredire della
risposta autoimmune si determina la distruzione comFattori
ambientali
Anormalità immunologica
Autoanticorpi
Massa β-cellulare
Introduzione
(ICA, GADA, IA2-A, IAA, ZnT8A)
Predisposizione
genetica
Pre-diabete
precoce
Perdita progressiva
del rilascio di insulina
Intolleranza al glucosio
Assenza di
Diabete peptide C
conclamato
Pre-diabete
tardivo
Tempo
Figura 1 Modello della storia naturale del diabete di tipo 1.
Corrispondenza: prof. Marco G. Baroni, Dipartimento di Medicina Sperimentale, Università Sapienza di Roma, Policlinico Umberto I, viale
Regina Elena 324, 00161 Roma • e-mail: [email protected]
Pervenuto l’11-10-2016 • Revisione del 06-11-2016 • Accettato il 07-11-2016
Parole chiave: diabete di tipo 1, autoanticorpi, linfociti T, insulite, selezione clonale, mimetismo molecolare, tolleranza immunologica, sistema maggiore di istocompatibilità • Key words: type 1 diabetes, autoantibodies, T lymphocytes, insulite, clonal selection, molecular mimicry, immune tolerance, major histocompatibility system
Abbreviazioni: APC, antigen-presenting cell, cellula presentante l’antigene; CBV-4, Coxackie B4; CTL, linfociti T citotossici; DC, cellule dendritiche mature; DMT1, diabete di tipo 1; EV, enterovirus; GAD, glutamic acid decarboxylase, decarbossilasi dell’acido glutammico;
GADA, GAD autoantibodies; GWA, genome wide association; HLA, human leukocyte antigen, antigene leucocitario umano; HSP60, heat
shock protein 60; IA-2, tirosina-fosfatasi; IA2-A, IA2 autoantibodies; IAA, insulin autoantibodies, autoanticorpi anti-insulina; ICA, islet cellautoantibodies, autoanticorpi anti-insula; 38 kDa sg, 38 kDa insulin secretory-granule antigen, 38 kDa proteina del granulo di secrezione
dell’insulina; MHC, major histocompatibility complex, complesso maggiore di istocompatibilità; NK, natural killer; P69, pancreatic antigen 69;
PI, proinsulina; TCR, T cell receptor, recettore delle cellule T; Tfh, follicular helper T cell; Th1, cellule T helper 1; Th2, cellule T helper 2; Treg,
cellule T regolatorie; ZnT8, trasportatore dello zinco; ZnT8A, ZnT8 autoantibodies.
G It Diabetol Metab 2016;36:181-188
181
Incani M e Baroni MG
pleta delle β-cellule e la comparsa dell’iperglicemia(1).
Gli elementi coinvolti nell’eziopatogenesi del diabete di
tipo 1 comprendono quindi fattori genetici, fattori ambientali e sistema immunitario.
Fattori genetici
Da un punto di vista genetico la caratteristica comune
del diabete di tipo 1 e delle altre malattie multifattoriali
è l’assenza di una specifica corrispondenza tra genotipo
e fenotipo, tipica invece delle patologie monogeniche.
Nelle malattie multifattoriali una qualunque variante eziologica non segrega costantemente con la patologia, poiché non ne è la causa, ma determina solo un aumentato
rischio. Questo spiega la ridotta penetranza di ciascun
polimorfismo considerato singolarmente, e rende molto
difficoltoso il mappaggio dei geni coinvolti nel DMT1.
Sono numerosissimi i geni o i loci cromosomici che sono
stati trovati in linkage con la malattia(2,3). Una vasta ricerca genomica ha dimostrato che, nonostante vi siano
molti geni responsabili dello sviluppo del diabete, i più
importanti sono legati all’MHC (complesso maggiore di
istocompatibilità), e in particolare all’antigene leucocitario umano (HLA), il locus dei geni che codificano le
proteine responsabili per la regolazione del sistema immunitario nell’uomo. Si tratta di un gruppo di geni polimorfici costituito da 30 unità, localizzate nell’uomo sul
braccio corto del cromosoma 6. Le molecole dell’HLA di
classe II (DP, DM, DOA, DOB, DQ e DR) sono attive nei
fenomeni di cooperazione cellulare che si verificano nell’ambito della risposta immunitaria. Le molecole HLA
sono il prodotto dei geni corrispondenti, e i più importanti sono DP, DQ e DR. In particolare alcuni alleli dei
geni DR e DQ sono fortemente associati al DMT1 e contribuiscono fino al 50% del rischio(3). L’associazione con
la malattia si ha solamente in presenza di aplotipi con alleli di suscettibilità a entrambi i loci DQB1 e DRB1. Nella
popolazione caucasica l’associazione è più marcata con
gli alleli HLA-DR3 e -DR4 e con alcuni alleli del locus HLADQB1 (DQB1* 0302 e DQB1* 0201)(4). In generale l’associazione dei vari aplotipi con la malattia esibisce un
continuum che va da aplotipi altamente predisponenti
ad aplotipi fortemente protettivi, passando attraverso
aplotipi neutrali e moderatamente protettivi.
Il meccanismo con il quale alcuni alleli HLA conferiscono
suscettibilità alla malattia non è stato del tutto chiarito.
Tuttavia è stato ipotizzato che possa dipendere da una
ridotta affinità di legame con gli autoantigeni, per cui
cellule autoreattive sfuggono alla selezione clonale timica
(vedi sezione successiva) e sono presenti in periferia(5).
All’opposto, i geni protettivi sarebbero dotati di alta affinità, determinando un’efficiente selezione clonale.
A oggi, studi di genome wide association (GWA) hanno
dimostrato l’associazione tra diabete di tipo 1 e più di
182
50 geni. A parte l’HLA, gli altri geni conferiscono individualmente un modesto aumento del rischio di sviluppare
diabete di tipo 1. Fra gli altri geni trovati associati, vanno
citati il gene PTPN22, coinvolto nella regolazione della risposta immune innata, nell’attivazione T-cellulare e nella
proliferazione delle cellule NK, e il gene dell’insulina
(IDDM2), in particolare la sua regione variabile (INSVNTR).
Fattori ambientali
In molti dei Paesi sviluppati l’incidenza del DMT1 è aumentata troppo rapidamente per essere spiegata solo
dalla componente genetica(6). Questo aumento rappresenta la migliore prova dell’influenza di fattori ambientali
nella patogenesi della malattia(7,8). La valutazione di fattori ambientali quali virus, batteri, cambiamenti legati all’alimentazione, fattori antropometrici e psicosociali sono
in corso di studio in trial clinici osservazionali, come nello
studio TEDDY, che ha lo scopo di accertare determinanti
ambientali in grado di innescare autoimmunità nelle
β-cellule e di accelerare o rallentare la progressione dall’esordio clinico in soggetti con persistente autoimmunità(9).
Secondo la “teoria dell’igiene”(10), vi è un rapporto inverso tra le condizioni igieniche e l’aumento d’incidenza
delle malattie autoimmuni. Fra i vari fattori ambientali associati alla “teoria dell’igiene” i virus sono sempre stati
chiamati in causa come possibili fattori scatenanti della
malattia e tra questi gli enterovirus (EV), in particolare i
virus Coxackie B4 (CBV-4). I dati epidemiologici hanno
costantemente dimostrato un aumento dell’incidenza di
diabete di tipo 1 in presenza di epidemie causate da enterovirus(11). Inoltre, CBV-4 sono stati isolati da pazienti
all’esordio del diabete, e alcuni di questi sono stati in
grado di indurre la malattia in modelli animali(12). Livelli
elevati di anticorpi IgM specifici per CBV sono stati osservati in diabetici di tipo 1 neodiagnosticati(13) e, infine,
la presenza di RNA specifico di EV è stato dimostrato in
questi pazienti, a indicare la presenza di infezioni in
atto(14). EV-RNA è stato trovato nel 50% dei bambini all’esordio del diabete di tipo 1, e in nessuno dei bambini
sani di controllo. Recenti studi osservazionali hanno rivelato la presenza di proteine immunoreattive del capside
enterovirale, VP1, all’interno delle β-cellule in soggetti affetti da DMT1(15,16). Malgrado queste evidenze, il ruolo
delle infezioni virali come causa di perdita delle β-cellule
nel diabete resta ancora da chiarire.
Fra i fattori alimentari, studi ecologici mostrano un’associazione tra consumo di latte e incidenza di DMT1, e
i dati epidemiologici confermano l’associazione tra l’inserimento precoce di proteine del latte vaccino e aumentata incidenza di DMT1. Anche studi su modelli
sperimentali animali dimostrano che l’eliminazione di
La patogenesi autoimmune del diabete di tipo 1
proteine del latte dalla dieta riduce l’incidenza di diabete
e studi immunologici dimostrano la presenza di anticorpi
e linfociti attivati verso proteine del latte in pazienti con
DMT1(17).
L’importanza della dieta e il conseguente coinvolgimento
del sistema gastrointestinale nell’eziologia del diabete di
tipo 1, è suggerito anche da alcune differenze riscontrate
nella composizione del microbiota intestinale di soggetti
affetti o con evidenza di autoimmunità β-cellulare e soggetti sani(18,19). Studi condotti fino a ora sul microbiota
intestinale (BABYDIET e DIPP) hanno dato risultati non
del tutto in linea tra loro, probabilmente per alcuni fattori confondenti come l’area geografica, la dieta e l’insufficiente numerosità delle casistiche. Ci sono inoltre
prove che il genoma umano possa in qualche maniera
controllare la composizione della flora batterica intestinale, tuttavia non è noto se una predisposizione genetica al DMT1 (genotipo HLA) influisca su questa stessa
composizione(20).
Fattori immunologici
Autoanticorpi
La presenza in circolo di autoanticorpi diretti contro il
pancreas endocrino incrementa in modo significativo il rischio di sviluppare diabete di tipo 1(21-23). Già nella fase
subclinica del DMT1 sono riscontrabili autoanticorpi specifici diretti contro antigeni delle isole pancreatiche, ma
essi sono un epifenomeno della malattia (non sono cioè
patogenetici), rappresentando un valido marcatore sierologico di autoimmunità e costituendo un elemento
fondamentale per la diagnosi di diabete. Inoltre, il loro
dosaggio può aiutare a identificare con maggiore sensibilità e specificità coloro i quali siano maggiormente predisposti a sviluppare il DMT1 nell’arco della loro vita(24).
Gli anticorpi contro il pancreas endocrino attualmente
meglio conosciuti e dosati sono gli ICA, i GADA, gli IA2-A,
gli IAA e l’ultimo anticorpo scoperto, diretto contro il trasportatore dello zinco (ZnT8A)(25).
Dei diversi marker immunologici per il diabete di tipo 1,
gli ICA descritti per la prima volta nel 1974, hanno rappresentato il “gold standard” per la determinazione di
anticorpi anti-insula per oltre 15 anni, ma a causa della
complessità dell’analisi gli ICA non rappresentano più da
svariati anni l’esame di riferimento per la malattia diabetica e trovano oggi spazio estremamente limitato nella
pratica clinica.
Gli anticorpi che adesso sono utilizzati come marcatori
della malattia sono quelli rivolti verso la decarbossilasi
dell’acido glutammico (GAD), l’insulina, la tirosina-fosfatasi (IA-2) e il trasportatore dello zinco (ZnT8). Questi anticorpi sono presenti in oltre il 90% dei soggetti con
diabete di tipo 1 all’esordio, anche se i livelli variano a
seconda dell’etnia e dell’età. Proprio in anni recenti sono
stati identificati in pazienti con DMT1 gli autoanticorpi
diretti contro il trasportatore dello zinco-8 (ZnT8A), una
proteina di membrana con abbondante espressione nei
granuli secretori delle β-cellule(26-28). Essi sono individuati
nel 60-80% di DMT1 di recente insorgenza e in meno
del 2% dei soggetti di controllo(25). Inoltre gli ZnT8A sono
stati osservati nel 26% dei soggetti con DMT1 classificati
in precedenza come anticorpo-negativi, permettendo
quindi di rivalutare la diagnosi(29). Se venissero dosati tutti
i 4 marcatori nei soggetti affetti da DMT1 all’esordio, solo
il 2-4% risulterebbe anticorpo-negativo, meno del 10%
avrebbe solo un marcatore positivo e circa il 70%
avrebbe tre o quattro marker di positività(24). È interessante notare come i più importanti autoantigeni a oggi
conosciuti per il DMT1 siano tutti correlati all’apparato
secretore della β-cellula, inclusi gli ultimi anticorpi identificati (ZnT8A)(25).
Sistema immunitario
La presenza di concentrazioni elevate di autoanticorpi circolanti diretti verso antigeni autologhi mette in evidenza
l’importanza della tolleranza immunologica, cioè della
capacità di riconoscere antigeni “self” da “non-self” nello
sviluppo delle patologie autoimmuni, come nel caso del
diabete di tipo 1. L’iperglicemia cronica è il risultato, nel
diabete autoimmune, della distruzione selettiva delle
β-cellule insulari pancreatiche, processo che ormai è noto
essere mediato principalmente dai linfociti T. Infatti, queste cellule sono quelle più rappresentate a livello degli infiltrati insulari e sono le uniche in grado di trasferire la
malattia da animali diabetici ad animali sani. Inoltre la
loro presenza negli animali geneticamente suscettibili allo
sviluppo del diabete, come il topo NOD, è fondamentale affinché si sviluppi la malattia, come dimostrato dal
fatto che animali timectomizzati o trattati con sostanze
che inibiscono selettivamente la funzione dei linfociti T
non sviluppano mai il diabete.
I meccanismi per indurre la tolleranza al “self” sono rappresentati dall’eliminazione dei linfociti T immaturi che
incontrano gli autoantigeni durante il loro processo di
sviluppo (selezione negativa), e dalla delezione o inattivazione funzionale dei linfociti T maturi che incontrano
gli autoantigeni nel corso della vita. Lo scatenarsi della
risposta immunitaria nei confronti di autoantigeni,
quindi, può essere la conseguenza di difetti sia nella tolleranza centrale (mancata selezione clonale) sia in quella
periferica.
Sia i linfociti T con fenotipo CD4 (T helper) sia quelli CD8
(T cytotoxic) sono coinvolti nella patogenesi del diabete.
Le informazioni disponibili in letteratura indicano che un
tipico reperto patognomico nel DMT1 è la presenza di
infiltrati linfocitari (insulite) nelle isole di Langherans che
contengono le cellule T CD8 (il più abbondante tipo cellulare) seguito dalle cellule B, dai linfociti T CD4, da cel-
183
Incani M e Baroni MG
lule NK (natural killer) e macrofagi(30,31). Tutti questi diversi sottoinsiemi di cellule immunitarie possono svolgere
ruoli differenti e contribuire alla patogenesi del DMT1,
operando simultaneamente ad altre cellule e/o fattori in
fasi differenti nel corso della risposta autoimmune che
caratterizza la patologia.
Entrambe le linee cellulari T CD4 e T CD8 hanno dato
evidenza di essere in grado di promuovere e sostenere
in modo significativo l’infiammazione e la morte delle
β-cellule(32). Tuttavia i meccanismi non sono del tutto
chiariti. Essi seguono tipicamente una fase iniziale caratterizzata da molteplici anomalie nella risposta immunitaria innata(33), tra cui deficit nella tolleranza immunologica in cellule dendritiche mature (DC) insieme a deficit di cellule NK(34) e alterazione nella funzione e differenziazione dei macrofagi (per esempio ridotta fagocitosi
nelle β-cellule apoptotiche)(35). A queste anomalie nella
risposta innata seguono meccanismi di attivazione o repressione delle varie componenti del sistema immunitario che determinano, alla fine, la distruzione β-cellulare.
Come illustrato in figura 2, diverse sono le componenti
del sistema immunitario coinvolte nel processo che porta
alla distruzione delle β-cellule nel DMT1. Le proteine delle
β-cellule danneggiate vengono fagocitate da cellule presentanti l’antigene (antigen-presenting cell, APC), come
le cellule dendritiche o i macrofagi. Le APC elaborano
queste proteine in frammenti di peptidi che sono presentati da molecole HLA di classe II alle cellule T helper 1
proinfiammatorie (Th1); queste cellule, a loro volta, attivano una cascata di risposte immunitarie, tra cui l’attivazione delle cellule B (che producono autoanticorpi
specifici contro antigeni insulari) e dei linfociti T citotossici (CTL) specifici contro antigeni β-cellulari. In alterna-
tiva, le APC possono presentare peptidi antigenici a cellule T regolatorie (Treg), che in condizioni normali sopprimono la cascata proinfiammatoria e impediscono la
distruzione delle β-cellule. Come illustrato in figura 2,
molte alterazioni immunologiche (nei riquadri) distinguono i pazienti con DMT1 dai soggetti sani.
Sia i linfociti T CD4 sia i CD8 riconoscono gli antigeni attraverso un recettore di superficie denominato TCR (T cell
receptor) costituito da una catena α e una β. Il riconoscimento dell’antigene è reso possibile solo se è presentato
da parte di molecole HLA espresse sulla superficie delle
cellule APC. I linfociti T autoreattivi nel DMT1 mostrano
reattività nei confronti di diversi antigeni insulari. La natura di questi antigeni e il loro ruolo nella patogenesi del
DMT1 sono tuttavia ancora molto dibattute.
Come nel caso degli anticorpi, anche le risposte T cellulari sono state descritte nei confronti di almeno una decina di autoantigeni pancreatici, tra cui l’insulina, che
sono poi gli stessi verso cui reagiscono gli anticorpi(36)
(Tab. 1). D’altra parte, è improbabile che le risposte T e
B cellulari nei confronti di un numero così elevato di autoantigeni siano tutte primarie o patogenetiche. È più
probabile invece che la risposta autoimmune cellulomediata verso un antigene primario induca un certo
grado di danno tessutale con rilascio di prodotti di degradazione che a loro volta possono determinare l’induzione di risposte immuni secondarie e contribuire all’estensione e alla cronicizzazione del processo. Nel gergo
immunologico questo fenomeno viene definito molecular and epitope spreading ed è un meccanismo ben noto
che è generalmente attribuito alla produzione di citochine da parte della prima ondata di cellule autoreattive
nei confronti di un epitopo immunodominante di un
Figura 2 I maggiori
componenti della risposta immunitaria coinvolti nel processo multifattoriale che porta alla
distruzione β-cellulare
nel diabete di tipo 1.
184
La patogenesi autoimmune del diabete di tipo 1
Tabella 1 Target della risposta autoimmune nel diabete di tipo 1.
Autoantigeni
Anticorpi
Risposta T-cellulare
Insulina
+
+
GAD 65/67
+
+
IA2
+
?
ICA512
+
?
P69
+
+
HSP60
+
+
Periferina
+
+
Carbossipeptidasi H
+
+
Gangliosidi
+
?
38 kDa sg
?
+
antigene primario a livello dell’organo bersaglio, che determina la perdita di tolleranza nei confronti di altri antigeni con un meccanismo a cascata.
Una situazione di questo tipo è stata descritta nel topo
NOD in cui è stata studiata la cronologia della comparsa
di autoreattività T cellulare nei confronti di alcuni autoantigeni β-cellulari. Alcuni studi hanno dimostrato che la
reattività cellulare alla GAD è la prima a comparire, intorno alla terza settimana di vita, seguita con alcune settimane di distanza dalla comparsa di reattività nei
confronti degli altri antigeni insulari(37-39). Un gran numero di autoantigeni, generalmente riconosciuti da autoanticorpi, sono stati identificati e sono target di cellule
CD8+ e CD4+ che possono contribuire alla distruzione
delle β-cellule, ma possono avere anche un ruolo protettivo. (Pre) proinsulina ([P] PI), GAD, IA-2 e ZnT8 svolgono
un ruolo particolarmente importante e sono riconosciuti
da autoanticorpi rilevabili mediante test clinici laboratoristici(40). Dato che la presenza di particolari autoantigeni
fornisce specificità al DMT1, numerosi sforzi sono stati
fatti sia per sviluppare saggi che determinino la presenza
di autoantigeni e per il monitoraggio delle risposte patologiche delle cellule T verso questi autoantigeni, sia per
cercare di progettare e sviluppare strategie terapeutiche
che in maniera specifica inibiscano tale risposta. Le sempre maggiori conoscenze però mostrano che è necessario investire ancora in questo campo, dove i risultati
recenti sono ancora discordanti e poco riproducibili,
prima di potere immaginare una terapia immunologica
a base autoantigenica che possa portare risultati soddisfacenti. Attualmente l’insulina rimane senza dubbio l’autoantigene “numero uno” nel modello NOD di DMT1,
non solo a causa della sua espressione ristretta alle β-cellule, l’associazione del suo polimorfismo genetico con rischio di malattia e il ruolo del suo riconoscimento nella
risposta autoimmune iniziale, ma anche perché la base
strutturale del suo riconoscimento da cellule T CD4+ è
ben compresa e fornisce ulteriori elementi di prova per il
ruolo chiave di insolite interazioni TCR-peptide MHC nel
DMT1(40). Un interessante recente studio condotto su
modelli murini mostra che le cellule T sono attive verso
peptidi “ibridi” formati dalla fusione di un peptide derivato dalla PI con altri peptidi derivati da proteine presenti
nelle β-cellule pancreatiche. Inoltre, le cellule T isolate
dalle isole pancreatiche di due persone con DMT1 hanno
riconosciuto tali peptidi ibridi, suggerendo che essi possano svolgere un ruolo importante nella malattia(41).
L’analisi biochimica di estratti delle insule ha rivelato che
i cloni T cellulari riconoscono peptidi ibridi formati da
frammenti di proinsulina e altri peptidi. La produzione di
peptidi ibridi o peptide splicing si verifica durante la degradazione degli antigeni da parte del proteasoma. Alcune linee di ricerca ipotizzano che l’affollamento
molecolare di peptide nei granuli di secrezione possa essere alla base della comparsa di reazioni di transpeptidazione, in grado di determinare la creazione di peptidi
ibridi. La modificazione di peptidi naturali li rende “stranieri” per il sistema immunitario e quindi target di cellule T autoreattive. Poiché è molto improbabile che
peptidi ibridi siano prodotti nel timo, le cellule T saranno
sfuggite alla selezione clonale negativa e quindi ai meccanismi di tolleranza-self, e potranno poi svolgere un
ruolo nell’autoimmunità cellulare. L’identificazione di
peptidi ibridi dell’insulina offre quindi una possibile spiegazione di come cellule T CD4+ possano sfuggire alla selezione clonale timica, e possano poi subire una potente
attivazione quando arrivano in presenza degli ibridi nelle
β-cellule.
In ogni caso, quale che sia l’antigene primario nell’induzione dei fenomeni autoimmuni nel diabete, la questione
più dibattuta rimane quella del perché e in che modo si
viene a perdere il fisiologico meccanismo di tolleranza
verso molecole cosiddette “self”. Esistono tre ipotesi principali per spiegare questo fenomeno, nel diabete come in
altre malattie autoimmuni organo-specifiche: un difetto
nella selezione del repertorio linfocitario a livello timico;
un aggiramento dell’anergia periferica (mimetismo molecolare) e un’alterazione dei meccanismi soppressori.
Mancata selezione clonale timica
Una caratteristica fondamentale del sistema immunitario
consiste nel mantenimento di uno stato fisiologico di tolleranza nei confronti della maggior parte degli antigeni
self. Questo stato di tolleranza è controllato principalmente a livello del timo, dove avviene la selezione del repertorio linfocitario, attraverso meccanismi basati sul
riconoscimento di antigeni autologhi che prevengono la
maturazione o l’attivazione dei linfociti potenzialmente
autoreattivi. I linfociti che possiedono un TCR specifico
per antigeni self vanno incontro in questo modo a selezione negativa, cioè vengono inattivati o mediante
delezione clonale (morte cellulare dipendente dall’attivazione) o mediante l’anergia clonale (sopravvivenza
185
Incani M e Baroni MG
delle cellule autoreattive che però non vengono attivate
dal legame con l’antigene) o mediante indifferenza clonale (mantenimento di competenza funzionale senza risposta agli antigeni specifici in vivo).
È stato quindi ipotizzato che nel diabete possa esistere
un’alterazione nel processo di selezione negativa dei linfociti T potenzialmente autoreattivi. I meccanismi biochimici che controllano la selezione timica sono ancora
in gran parte sconosciuti, anche se recentemente è stato
dimostrato che un ruolo molto importante viene svolto
dalle molecole HLA, le quali hanno la funzione di presentare gli antigeni self ai linfociti T immaturi che, riconoscendoli, vanno incontro a selezione negativa. Nel
topo NOD è stato dimostrato che le molecole codificate
dagli alleli MHC di suscettibilità al diabete legano i peptidi derivati dagli antigeni insulari con bassa affinità, mediando un’inefficiente presentazione degli autoantigeni
alle cellule T autoreattive. Di conseguenza è stato ipotizzato che la debole affinità di legame MHC con i peptidi antigenici self potrebbe determinare una ridotta
capacità delle APC di mediare un’efficiente selezione negativa, che sarebbe alla base della persistenza di cellule
autoreattive che in questo modo hanno la possibilità di
raggiungere la periferia(3). Un esempio di possibile mancata selezione clonale viene dall’osservazione dell’espressione del VNTR di classe I del gene dell’insulina,
che risulta poco espresso a livello timico (determinando
un segnale debole di riconoscimento, soprattutto in copresenza di HLA di rischio) e molto di più a livello delle
β-cellule, dove potrebbe indurre una maggiore risposta
antigenica(42).
Mimetismo molecolare
Un altro meccanismo proposto per spiegare l’attivazione
e l’espansione delle cellule autoreattive che raggiungono
la periferia è quello del mimetismo molecolare. Questo
consiste in una risposta immunitaria nei confronti di un
antigene esogeno, come potrebbe essere una proteina
virale che possiede una sequenza di aminoacidi in comune con una proteina β-cellulare. Quindi, allorché questa proteina viene presentata ai linfociti T, questi vanno
incontro ad attivazione ed espansione clonale, ma poiché riconoscono anche l’autoantigene omologo espresso
dalle β-cellule, sono capaci di reagire anche nei confronti
di esse causandone la distruzione.
A questo proposito è stato dimostrato che il virus Coxsakie B4 possiede un’omologia di sequenza con la GAD(43),
e che risposte nei confronti di questi due antigeni sono
state descritte in pazienti con DMT1(44,45). Questo potrebbe quindi costituire un esempio di come i meccanismi di tolleranza potrebbero essere bypassati o aggirati
dall’induzione di una risposta immunitaria contro una
proteina esogena.
186
Deficit nella funzione soppressoria
Un ulteriore meccanismo invocato per spiegare l’induzione di autoreattività T cellulare nel diabete è quello di
un deficit nella funzione soppressoria.
Un difetto di attività soppressoria è ritenuto essere implicato nello sviluppo del diabete nel topo NOD. Infatti,
dallo studio dell’insulite in questo modello animale si è
visto che la risposta diabetogenica consiste in una serie di
stadi successivi che culminano con la distruzione massiva
delle β-cellule e con la comparsa del diabete. Nelle fasi
iniziali, a livello delle isole normali, cominciano a comparire le prime cellule infiltranti che dalla quarta settimana circa formano un infiltrato, limitato alla periferia
dell’isola, definito peri-insulite o insulite non distruttiva,
poiché si accompagna alla relativa conservazione della
massa β-cellulare. Successivamente, con il progredire
della risposta immunoinfiammatoria, le cellule infiltranti
penetrano nella compagine dell’isola dando luogo a
quella che viene definita insulite distruttiva che è appunto
caratterizzata da perdita significativa della massa β-cellulare. Il fatto che non tutti gli animali progrediscano dalla
fase di insulite non distruttiva a quella di insulite distruttiva, e in particolare che la mancata progressione è associata a protezione dalla malattia, ha condotto all’ipotesi
dell’esistenza di meccanismi di soppressione che controllano la progressione dell’insulite.
Nell’uomo, in presenza di condizioni fisiologiche normali,
la maggior parte delle cellule self autoreattive sono eliminate nel timo attraverso il meccanismo descritto in precedenza di “selezione clonale”, oppure possono essere
attivamente soppresse da cellule Treg. I linfociti Treg, subset di cellule T, hanno suscitato particolare interesse essendo caratterizzati dalla capacità di calibrare l’attivazione
e l’espansione di cloni di linfociti T autoreattivi durante la
risposta immunitaria(46,47), sopprimendo le risposte effettrici di altre cellule e costituendo un importante “selfcheck” insito nel sistema immunitario, capace di prevenire
reazioni eccessive una volta che l’antigene è stato eliminato, limitando così il danno tessutale. Le Treg derivano
da diversi tipi cellulari, alcune esprimono la glicoproteina
di membrana CD8, altre CD4-CD25 e Foxp3, altre si differenziano da tipi a funzione soppressoria. Si riconoscono
per le citochine prodotte, TGF-β, IL-10, per la scarsa attitudine proliferativa, per una bassa produzione di citochine
linfotrope (in particolare IL-2 e INF-γ) e per la capacità di
sopprimere la produzione di queste citochine anche in
cellule effettrici attivate come CD8+ (CTL), CD4+ (a funzione Th1 o Th2), NK, DC e macrofagi.
Linfociti CD4
Anche se la natura e l’interazione di questi meccanismi
non sono del tutto note, è sempre più chiaro che la dif-
La patogenesi autoimmune del diabete di tipo 1
Th1
Th2
Interferone-γ
Interleuchina-2
Induzione di immunità cellulomediata con infiammazione
distruttiva
Th1
Th2
Interleuchina-4
Interleuchina-5
Interleuchina-10
Ridotta reattività cellulare (anergia)
Attivazione delle β-cellule e
immunoglobune IgE
Risposte degli eosinofili
Figura 3 Linfociti T helper Th1 e Th2 e loro effetti.
In conclusione si può affermare che, data la patogenesi
multifattoriale e l’eterogeneità della malattia, le varie ipotesi presentate non si escludono a vicenda e quindi diversi meccanismi potrebbero concorrere a determinare
l’espressione completa del DMT1.
Inoltre, non è necessario che le alterazioni debbano essere uguali in tutti gli individui affetti. Quello che è certo
è che una volta chiarito quale sia veramente il contributo
di ciascuna di queste alterazioni alla patogenesi della malattia, allora sarà possibile offrire nuove opportunità terapeutiche più selettive e mirate a eliminare le cellule
autoreattive o a renderle inoffensive.
Conflitto di interessi
Nessuno.
ferenziazione cellulare dei linfociti T CD4 comporta profonde conseguenze nella successiva produzione di citochine e nel diverso potenziale migratorio. Diversi studi
hanno valutato il ruolo delle sottoclassi dei linfociti T helper Th1 e Th2 e dello sbilanciamento dei rapporti di queste sottoclassi nei meccanismi patogenetici che portano
al DMT1. Le cellule Th1 producono IFN-γ, linfotossina e
IL-2 (Fig. 3), e sono essenzialmente coinvolte nello stimolo di potenti reazioni immunitarie cellulo-mediate,
mentre le cellule Th2 che producono IL-4, IL-5, IL-6,
IL-9 e IL-10, sono più attive nello stimolare la produzione di anticorpi e inibiscono invece l’attività cellulomediata(48,49) (Fig. 3).
I primi modelli di differenziazione delle cellule T sono stati
incentrati principalmente sulla dicotomia tra cellule Th1
e Th2 che mostra il DMT1 come una patologia Th1mediata. È stato dimostrato che nel topo NOD livelli elevati di INF-γ si riscontrano a livello degli infiltrati caratterizzati da insulite distruttiva, mentre elevati livelli di IL-4,
che rappresentano l’espressione di una maggiore attivazione delle cellule Th2, sono rilevabili a livello dei topi
maschi caratterizzati da insulite non distruttiva. Nonostante il numero considerevole di dati prodotti a supporto di questa teoria, manca una consistente evidenza
a favore di questa conclusione, tanto che, del tutto in
contrasto, alcuni studi sul topo NOD hanno mostrato un
ruolo importante nella distruzione β-cellulare della linea
cellulare Th2(50) e altri lavori hanno invece concluso che
potrebbero essere coinvolti entrambi i tipi di risposta(51).
Dati recenti suggeriscono che la differenziazione delle
cellule T sia ancora più varia di quanto dimostrato fin
ora(52), con la possibilità di una vasta selezione di fenotipi
funzionali: viene proposta una visione più sfumata di differenziazione delle cellule T nel DMT1 che non si concentra esclusivamente sulle cellule Th1, ma comprende
anche il possibile coinvolgimento di altre cellule T come
le Tfh (follicular helper T cell) che producono IL-21, e le
cellule T co-produttrici di INF-γ e IL-17(53-55).
Bibliografia
1. Eisenbarth GS, Connelly J, Soeldner JS. The “natural” history of
type I diabetes. Diabetes Metab Rev 1987;3:873-91.
2. Field LL. Genetic linkage and association studies of type I diabetes:
challenges and rewards. Diabetologia 2002;45:21-35.
3. Pociot F, Lernmark A. Genetic risk factors for type 1 diabetes. Lancet 2016;387:2331-9.
4. Spoletini ML, Zampetti S, Campagna G, Marandola L, Capizzi
M, Buzzetti R. Temporal trends of HLA, CTLA-4, and PTPN22 genotype frequency among type 1 diabetes in continental Italy. PLoS
One 2013;8:e61331.
5. Carrasco-Marin E, Shimizu J, Kanagawa O, Unanue ER. The class
II MHC I-Ag7 molecules from non-obese diabetic mice are poor peptide binders. J Immunol 1996;156:450-8.
6. Atkinson MA, Eisenbarth GS, Michels AW. Type 1 diabetes. Lancet 2014;383:69-82.
7. Gale EA. The rise of childhood type 1 diabetes in the 20th century.
Diabetes 2002;51:3353-61.
8. Vehik K, Hamman RF, Lezotte D, Norris JM, Klingensmith G,
Bloch C et al. Increasing incidence of type 1 diabetes in 0- to 17year-old Colorado youth. Diabetes Care 2007;30:503-9.
9. Elding Larsson H, Vehik K, Gesualdo P, Akolkar B, Hagopian W,
Krischer J et al. Children followed in the TEDDY study are diagnosed with type 1 diabetes at an early stage of disease. Pediatr Diabetes 2014;15:118-26.
10. Knip M, Veijola R, Virtanen SM, Hyöty H, Vaarala O, Akerblom
HK. Environmental triggers and determinants of type 1 diabetes.
Diabetes 2005;54(suppl. 2):S125-36.
11. Fohlman J, Friman G. Is juvenile diabetes a viral disease? Ann Med
1993;25:569-74.
12. See DM, Tilles JG. Pathogenesis of virus-induced diabetes in mice.
J Infect Dis 1995;171:1131-8.
13. Frisk G, Nilsson E, Tuvemo T, Friman G, Diderholm H. The possible role of Coxsackie A and echo viruses in the pathogenesis of
type I diabetes mellitus studied by IgM analysis. J Infect 1992;
24:13-22.
14. Andreoletti L, Hober D, Hober-Vandenberghe C, Fajardy I, Belaich S, Lambert V et al. Coxsackie B virus infection and beta cell
autoantibodies in newly diagnosed IDDM adult patients. Clin
Diagn Virol 1998;9:125-33.
15. Richardson SJ, Leete P, Bone AJ, Foulis AK, Morgan NG. Expression of the enteroviral capsid protein VP1 in the islet cells of patients with type 1 diabetes is associated with induction of protein
kinase R and down regulation of Mcl-1. Diabetologia 2013;
56:185-93.
187
Incani M e Baroni MG
16. Richardson SJ, Leete P, Dhayal S, Russell MA, Oikarinen M, Laiho
JE et al. Evaluation of the fidelity of immunolabelling obtained with
clone 5D8/1, a monoclonal antibody directed against the enteroviral capsid protein, VP1, in human pancreas. Diabetologia
2014;57:392-401.
17. Cavallo MG, Fava D, Monetini L, Barone F, Pozzilli P. Cellmediated immune response to beta casein in recent-onset insulindependent diabetes: implications for disease pathogenesis. Lancet
1996;348:926-8.
18. Nielsen DS, Krych L, Buschard K, Hansen CH, Hansen AK. Beyond genetics. Influence of dietary factors and gut microbiota on
type 1 diabetes. FEBS Lett 2014;588:4234-43.
19. Knip M, Siljander H. The role of the intestinal microbiota in type
1 diabetes mellitus. Nat Rev Endocrinol 2016;12154-67.
20. Goodrich JK, Waters JL, Poole AC, Sutter JL, Koren O, Blekhman
R et al. Host genetics and the gut microbiome can both influence
metabolic phenotypes. Cell 2014;159:789-99.
21. Bingley PJ, Christie MR, Bonifacio E, Bonfanti R, Shattock M,
Fonte MT et al. Combined analysis of autoantibodies improves
prediction of IDDM in islet cell antibody-positive relatives. Diabetes 1994;43:1304-10.
22. Maclaren N, Lan M, Coutant R, Schatz D, Silverstein J, Muir A
et al. Only multiple autoantibodies to islet cells (ICA), insulin,
GAD65, IA-2 and IA-2 predict immune-mediated (type 1) diabetes
in relatives. J Autoimm 1999;12:279-87.
23. Krischer JP, Schatz D, Riley WJ, Spillar RP, Silverstein JH, Schwartz
S et al. Insulin and islet cell autoantibodies as time-dependent covariates in the development of insulin-dependent diabetes: a prospective study in relatives. J Clin Endocrinol Metab 1993;
77:743-9.
24. Bingley PJ. Clinical applications of diabetes antibody testing. J Clin
Endocrinol Metab 2010;95:25-33.
25. Wenzlau JM, Juhl K, Yu L, Moua O, Sarkar SA, Gottlieb P et al.
The cation efflux transporter ZnT8 (Slc30A8) is a major autoantigen in human type 1 diabetes. Proc Natl Acad Sci USA 2007;
104:17040-5.
26. Kambe T, Narita H, Yamaguchi-Iwai Y, Hirose J, Amano T, Sugiura N et al. Cloning and characterization of a novel mammalian
zinc transporter, zinc transporter 5, abundantly expressed in pancreatic beta cells. J Biol Chem 2002;277:19049-55.
27. Clifford KS, MacDonald MJ. Survey of mRNAs encoding zinc transporters and other metal complexing proteins in pancreatic islets of
rats from birth to adulthood: similar patterns in the SpragueDawley and Wistar BB strains. Diabetes Res Clin Pract 2000;49:
77-85.
28. Chimienti F, Devergnas S, Favier A, Seve M. Identification and
cloning of a beta-cell-specific zinc transporter, ZnT-8, localized into
insulin secretory granules. Diabetes 2004;53:2330-7.
29. Nokoff N, Rewers M. Pathogenesis of type 1 diabetes: lessons from
natural history studies of high-risk individuals. Ann N Y Acad Sci
2013;1281:1-15.
30. Atkinson MA, Eisenbart GS, Michels AW. Type 1 diabetes. Lancet
2014;383:69-82.
31. Richardson SJ, Morgan NG, Foulis AK. Pancreatic pathology in
type 1 diabetes mellitus. Endocr Pathol 2014;25:80-92.
32. Lehuen A, Diana JZ, Zaccone P, Cooke A. Immune cell crosstalk
in type 1 diabetes. Nat Rev Immunol 2010;10:501-13.
33. Kakleas K, Soldatou A, Karachaliou F, Karavanaki K. Associated
autoimmune diseases in children and adolescents with type 1 diabetes mellitus (T1DM). Autoimmun Rev 2015;14:781-97.
34. Naumov YN, Bahjat KS, Gausling R, Abraham R, Exley MA, KoezukaY et al. Activation of CD1d-restricted T cells protects NOD mice
from developing diabetes by regulating dendritic cell subsets. Proc
Natl Acad Sci USA 2001;98:13838-43.
35. O’Brien BA, Huang Y, Geng X, Dutz JP, Finegood DT. Phagocy-
188
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
47.
48.
49.
50.
51.
52.
53.
54.
55.
tosis of apoptotic cells by macrophages from NOD mice is reduced. Diabetes 2002;51:248-88.
Roep BO. T-cell responses to autoantigens in IDDM. The search
for the Holy Grail. Diabetes 1996;45:1147-56.
Kaufman DL, Clare-Salzler M, Tian J, Forsthuber T, Ting GS, Robinson P et al. Spontaneous loss of T-cell tolerance to glutamic
acid decarboxylase in murine insulin-dependent diabetes. Nature
1993;366:69-72.
Tisch R, Yang XD, Singer SM, Liblau RS, Fugger L, McDevitt HO.
Immune response to glutamic acid decarboxylase correlates with insulitis in non-obese diabetic mice. Nature 1993;366:72-5.
Tisch R, McDevitt H. Insulin-dependent diabetes mellitus. Cell
1996;85:291-7.
Mauvais FX, Diana J, van Endert P. Beta cell antigens in type 1 diabetes: triggers in pathogenesis and therapeutic targets. F1000Res
2016;22:728.
Delong T, Wiles TA, Baker RL, Bradley B, Barbour G, Reisdorph
R et al. Pathogenic CD4 T cell in type 1 diabetes recognize epitopes formed by peptide fusion. Science 2016;351:711-4.
Pugliese A, Zeller M, Fernandez A Jr, Zalcberg LJ, Bartlett RJ, Ricordi C et al. The insulin gene is transcribed in the human thymus
and transcription levels correlated with allelic variation at the INS
VNTR-IDDM2 susceptibility locus for type 1 diabetes. Nat Genet
1997;15:293-7.
Tian J, Lehmann PV, Kaufman DL. T cell cross-reactivity between coxsackievirus and glutamate decarboxylase is associated with
a murine diabetes susceptibility allele. J Exp Med 1994;180:1979-84.
Atkinson MA, Bowman MA, Campbell L, Darrow BL, Kaufman
DL, Maclaren NK. Cellular immunity to a determinant common
to glutamate decarboxylase and coxsackie virus in insulin-dependent diabetes. J Clin Invest 1994;94:2125-9.
Jones DB, Crosby I. Proliferative lymphocyte responses to virus antigens homologous to GAD65 in IDDM. Diabetologia 1996;
39:1318-24.
Bach JF. Regulation T cells under scrutiny. Nature Rev Immunology 2003;3:189-18.
Chatenoud L, Salomon B, Bluestone JA. Suppressor T cells they’re
back and critical for regulation of autoimmunity! Immunol Rev
2001;182:149-63.
Mosmann TR, Sad S. The expanding universe of T-cell subsets:
Th1, Th2 and more. Immunol Today 1996;17:138-46.
Liblau RS, Singer SM, McDevitt HO. Th1 and Th2 CD4+ T cells
in the pathogenesis of organ-specific autoimmune diseases. Immunol Today 1995;16:34-8.
Anderson JT, Cornelius JG, Jarpe AJ, Winter WE, Peck AB. Insulin-dependent diabetes in the NOD mouse model. II. Beta cell destruction in autoimmune diabetes is a TH2 and not a TH1
mediated event. Autoimmunity 1993;15:113-22.
Azar ST, Tamim H, Beyhum HN, Habbal MZ, Almawi WY. Type
I (insulin-dependent) diabetes is a Th1- and Th2-mediated autoimmune disease. Clin Diagn Lab Immunol 1999;6:306-10.
Becattini S, Latorre D, Mele F, Foglierini M, De Gregorio C, Cassotta A et al. T cell immunity. Functional heterogeneity of human
memory CD4(1) T cell clones primed by pathogens or vaccines.
Science 2015;347:400-6.
Ferreira RC, Simons HZ, Thompson WS, Cutler AJ, Dopico XC,
Smyth DJ et al. IL-21 production by CD4 effector T cells and frequency of circulating follicular helper T cells are increased in type
1 diabetes patients. Diabetologia 2015;58:781-90.
Kenefeck R, Wang CJ, Kapadi T, Wardzinski L, Attridge K, Clough
LE et al. Follicular helper T cell signature in type 1 diabetes. J Clin
Invest 2015;125:292-303.
Xu X, Shi Y, Cai Y, Zhang Q, Yang F, Chen H et al. Inhibition of
increased circulating Tfh cell by anti-CD20 monoclonal antibody
in patients with type 1 diabetes. PLoS One 2013;8:e79858.