Lezione 10
Termodinamica
Argomenti della lezione:
relazione di Mayer
trasformazioni adiabatiche
trasformazioni isoterme
macchine termiche
ciclo di Carnot
secondo principio della termodinamica
cenni sull entropia
Gas ideali
Un gas è un particolare fluido caratterizzato da non avere forma e
volume propri e tale da essere facilmente compresso.
pV = costante
Legge di Boyle
p
T1 T2
T3 > T2 > T1
T3
V
Isoterme del gas ideale.
Gas ideali
Legge di Gay Lussac
p
Isocore del gas ideale.
p
= costante
T
V
Legge di Gay Lussac
p
Isobare del gas ideale.
p
= costante
V
V
Tipi di Trasformazione
Isoterma T = cost.
Isobara
p = cost.
Isocora
V = cost.
Adiabatica
q=0
Isoentropica
S = cost.
...
Marina Cobal - Dipt.di Fisica - Universita' di Udine
Trasformazioni notevoli
Trasformazione adiabatica
Trasformazione isocora
Trasformazione isobara
Q = 0 ⇒ ΔU = − L
L = 0 ⇒ ΔU = Q
(
L = p V f − Vi
)
⇒ Q = ΔU + L
Trasformazione isoterma
ΔU = 0 ⇒ Q = L
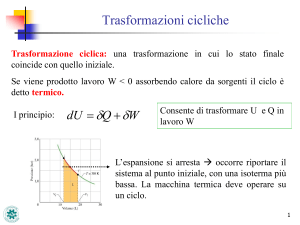
Trasformazione ciclica
ΔU = 0 ⇒ Q = L
Calori specifici
Nel caso di una trasformazione infinitesima isocora:
dQ = ncV dT
Nel caso di una trasformazione infinitesima isobara:
dQ = nc p dT
Definiamo il calore specifico molare a volume o pressione costante
1 dQ
cV =
n dT V
QV = ncV ΔT
1 dQ
cp =
n dT p
Q p = nc p ΔT
Unità: J/(mol K)
Calori specifici
Supponiamo di effettuare una trasformazione fra gli stessi estremi di
temperatura prima a volume costante e poi a pressione costante.
QV = ncV ΔT = ΔU
W =0
Q p = nc p ΔT = ΔU + pΔV
Ma
ossia
ΔU
è la stessa nei due casi per cui
Q p > QV
c p > cV
Nel caso infinitesimo
dQ = dU + dW
dQV = ncV dT = dU
dQ p = nc p dT + pdV > dQV
Energia interna di un gas ideale
Espansione libera di Joule.
Pareti rigide diatermiche che dividono un contenitore in due parti. Il
contenitore è a sua volta in un contenitore adiabatico.
Si apre divisione (rubinetto) e si lascia espandere il gas liberamente
Gas inizialmente a sinistra
La temperatura finale del
processo è pari a T
temperatura di equilibrio
Osserviamo che si ha:
Q=0
W = 0 ⇒ ΔU = 0
Notiamo che nel processo la temperatura non varia mentre variano
pressione e volume, perciò l energia interna deve essere solo funzione
della temperatura
Energia interna di un gas ideale
Determiniamo ora esplicitamente l espressione dell energia interna.
p
C
AC isocora e AB isoterma
B
A
ΔU = U B − U A = U B − U C + U C − U A = U C − U A
U B = UC
V
Applichiamo ora il primo principio della termodinamica alla
trasformazione isocora
ΔU = Q
a vol costante
ΔU = U B − U A = ncV (TB − TA ) = ncV ΔT
Per trasformazioni infinitesime
dU = ncV dT
Relazione di Mayer
In una trasformazione isobara infinitesima
dW = pdV
dQ = nc p dT
dQ = dU + dW
nc p dT = ncV dT + pdV
Differenziamo l equazione di stato dei gas ideali
pV = nRT ⇒ pdV + Vdp = nRdT
Ma per un isobara
Vdp = 0
nc p dT = ncV dT + nRdT
E in definitiva
⇓
c p − cV = R
Relazione di Mayer
Abbiamo ricavato
c p − cV = R
Rapporto γ
γ =
cp
cV
Valori sperimentali
Gas ideali monoatomici
(He, Ar, vapori metallici di Na, Hg)
3
cV = R
2
5
cp = R
2
5
γ=
3
Gas ideali biatomici
(H2, N2, NO, CO)
5
cV = R
2
7
cp = R
2
7
γ=
2
Riassunto
I gas che considereremo saranno sempre mono o bi atomici
ΔU = ncV ΔT
per qualsiasi trasformazione
ΔQ = ncV ΔT
se V = costante
ΔQ = nc p ΔT
se p = costante
pV = nRT
equazione dei gas perfetti
c p − cV = R
relazione di Mayer
ΔU = Q − W
primo principio della termodinamica
Trasformazioni adiabatiche generale
Se il gas è contenuto in un contenitore con pareti adiabatiche può
scambiare con l esterno solo lavoro
WAB = −ΔU
γ =
W AB
ma
ΔU = ncV (T2 − T1 )
cp
cV
c p − cV = R
cV
1
( p 2V2 − p1V1 ) =
= ncV ( p 2V 2 − p1V1 )
=
nR c p − cV
1
( p 2V2 − p1V1 )
=
1− γ
Trasformazioni adiabatiche reversibile
Se il gas è contenuto in un contenitore con pareti adiabatiche può
scambiare con l esterno solo lavoro
dU + dW = ncV dT + pdV = 0
nRT
ncV dT +
dV = 0
V
(
nRT
p=
V
Separando le variabili
)
dT n c p − cV
ncV
+
dV = 0
T
V
dT c p − cV
dT
dV
+
dV =
+ (γ − 1)
=0
T
cV V
T
V
(
)
Trasformazioni adiabatiche reversibile
dV
dT
(γ −1) = −
V
T
Integrando fra stati A e B
VB
VB
TA
(γ − 1)ln = ln ⇒ ln
VA
TB
VA
VB
VA
γ −1
γ −1
TA
= ln
TB
TA
γ −1
γ −1
(
)
(
)
=
⇒ TB VB
= TA V A
TB
Trasformazioni adiabatiche reversibile
Considerando l equazione di stato dei gas perfetti si ottiene
T (V )γ −1 = costante
pV γ = costante
1−γ
T (p)
γ
= costante
Trasformazioni isoterme
Considerando l equazione di stato dei gas perfetti si ottiene
Q =W
ΔU = 0
pV = costante
nel caso di isoterma reversibile
B
W AB =
∫
A
B
pdV =
∫
A
VB
nRT
dV = nRT ln
V
VA
Macchine termiche
Una macchina termica è un dispositivo che trasforma calore in
lavoro.
Contiene una sostanza che, in maniera ciclica, assorbe una
quantità di calore Q1, cede una quantità di calore Q2 e compie
un lavoro W.
Rendimento di una macchina termica:
W
η=
Q1
Il funzionamento è ciclico, quindi per il 1° principio
ΔU = Q − W = 0
(Q1 − Q2 ) − W = 0 ⇒ ΔU = Q − W = 0 ⇒ W = (Q1 − Q2 )
Q1 − Q2
η=
Q1
Macchine termiche
Schema di una generica
macchina termica:
W
Rendimento: η =
Q1
Schema di una generica
macchina frigorifera:
Efficienza:
Q2
ε=
W
Ciclo di Carnot
p
Trasformazione ciclica
ABCD
A
T2
Trasformazione isoterma AB
alla temperatura T2.
Espansione isoterma
B
D
T1
C
V
Trasformazione isoterma CD
alla temperatura T1.
Compressione isoterma
Trasformazione adiabatica DA.
Compressione adiabatica
Trasformazione adiabatica BC.
Espansione adiabatica
Scopo:
W
Rendimento: η =
QC
Ciclo di Carnot
p
Nella espansione isoterma AB
A
T2
ΔU AB = 0 QAB = WAB
pV = costante
B
B
W AB =
D
T1
C
A
B
V
Nella espansione adiabatica BC
QBC = 0
∫ pdV =
=
∫
A
nRT2
VB
dV = nRT2 ln
V
VA
ΔU BC = −WBC
WBC = −ΔU BC = −ncV ΔT = −ncV (T2 − T1 )
Ciclo di Carnot
p
Nella compressione isoterma CD
A
T2
ΔU CD = 0 QCD = WCD
pV = costante
B
D
WCD =
D
T1
C
C
D
V
Nella compressione adiabatica DA
QDA = 0
∫ pdV =
=
∫
C
nRT1
VD
dV = nRT1 ln
V
VC
ΔU DA = −WDA
WDA = −ΔU DA = −ncV ΔT = −ncV (T1 − T2 )
Ciclo di Carnot
p
Riassumendo:
A
T2
QAB = WAB
VB
= nRT2 ln
>0
VA
QCD = WCD
VD
= nRT1 ln
<0
VC
B
D
T1
C
V
Per cui il lavoro totale è dato da:
W = W AB + WBC + WCD + WDA = nRT2 ln
VB
VD
= nR T2 ln
+ T1 ln
VA
VC
ΔU BC = −ΔU DA
WBC = −WDA
VB
V
− WDA + nRT1 ln D + WDA =
VA
VC
Ciclo di Carnot
p
Ma il rendimento è dato dal
rapporto fra lavoro e calore
assorbito.
In questo caso il lavoro è stato
appena calcolato, il calore viene
assorbito durante l espansione
isoterma AB
A
T2
B
D
T1
C
QAB + QCD
W
η=
=
=
QAB
QAB
V
VB
VD
nR T2 ln
+ T1 ln
VA
VC
=
VB
nRT2 ln
VA
=
VB
VD
T2 ln
+ T1 ln
VA
VC
VB
T2 ln
VA
Ciclo di Carnot
p
Osserviamo che le trasformazioni
BC e DA sono di tipo adiabatico,
per cui:
A
T2
T (V )γ −1 = costante
B
D
T1
C
V
T2 (VB )γ −1 = T1 (VC )γ −1
γ −1
T1 (VD )
γ −1
= T2 (V A )
T2 VC
=
T1 VB
γ −1
T2 VD
=
T1 V A
γ −1
VC
VB
γ −1
VD
=
VA
γ −1
Ciclo di Carnot
p
A
E in definitiva
T2
VC
VB
B
D
T1
C
V
VD
=
VA
VD
⇒
V
C
VA
=
V
B
V
V
T2 ln B + T1 ln D
VA
VC
η=
VB
T2 ln
VA
VB
VA
T2 ln
+ T1 ln
VA
VB (T2 − T1 )
T1
η=
=
= 1−
VB
T2
T2
T2 ln
VA
Secondo principio della termodinamica
Può essere espresso in molti modi equivalenti:
Non è possibile realizzare una trasformazione il cui unico
risultato sia la conversione integrale di calore assorbito in
lavoro (enunciato di Kelvin).
Non è possibile realizzare una trasformazione il cui unico
risultato sia il trasferimento di calore da una sorgente a
temperatura più bassa ad una sorgente a temperatura più alta
(enunciato di Clausius).
Non è possibile realizzare una macchina termica con
rendimento η = 100%.
Non è possibile realizzare una macchina frigorifera che non
assorba lavoro.
Trasformazioni reversibili e irreversibili
Entropia
Una trasformazione si dice reversibile se è costituita dalla
successione di infiniti stati di equilibrio.
In questo caso il sistema può essere riportato allo stato iniziale
ripercorrendo all indietro la stessa trasformazione.
In una trasformazione irreversibile il sistema passa per stati di non
equilibrio e non può essere invertita perfettamente.
Consideriamo una trasformazione reversibile in ciascun elemento
della quale una quantità di calore dQrev viene scambiata ad una
temperatura T. Si definisce variazione di entropia:
f
dQrev
ΔS =
T
∫
i
Entropia e secondo principio
In un sistema isolato, in cui ci sono solo trasformazioni reversibili,
l entropia rimane costante (Δ S=0).
In un sistema isolato, in cui ci sono trasformazioni irreversibili,
l entropia aumenta sempre (Δ S>0).
Quindi l entropia determina il verso delle trasformazioni irreversibili:
un sistema evolverà sempre in modo che l entropia aumenti.
Significato probabilistico dell entropia:; esprime il grado di disordine
microscopico di un sistema.
Un sistema isolato evolve quindi sempre verso stati più disordinati.