Complessi alchilici e arilici
Composti organometallici con legami singoli M-C.
E
M-C
= 125-270 KJ/mole in un generico complesso LxM-CRy
(M metallo di transizione)
E
E-C
= 140-360 KJ/mole in un generico composto E-CRy
(E metallo dei main groups)
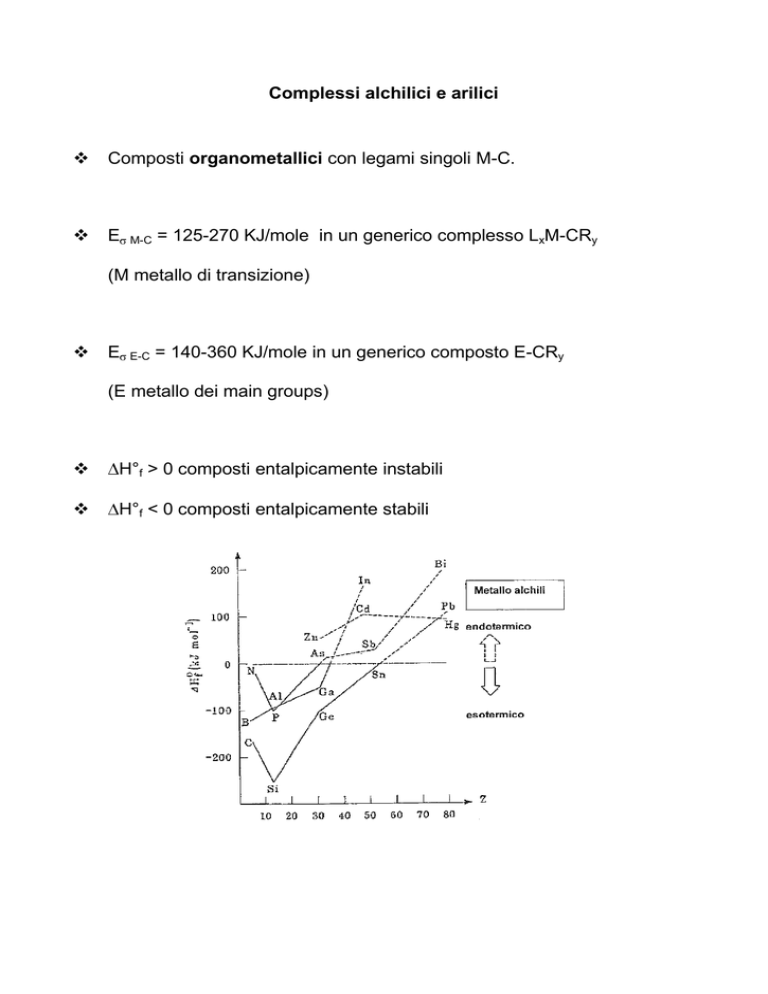
H°f > 0 composti entalpicamente instabili
H°f < 0 composti entalpicamente stabili
Tipi di legame M-C
legame M +-C - molto polare (es. K+[CPh3]- , litio acetiluro Li+C CH- ,
solido ionico insolubile nei solventi organici ma solubile in NH3 liquida),
legame M-C molto covalente (es. LiCH3, Be(CH3)2, Al(CH3)3 , etil litio
Li-CH2CH3 , solido bassofondente solubile in n-esano e volatile).
N.B. Per aumentare la stabilità dei complessi alchilici è più facile bloccare
eventuali vie di decomposizione piuttosto che aumentare la forza intrinseca del
legame M-C.
Applicazioni catalitiche dei complessi alchilici
Ziegler (1954) ottenne il polietilene usando come catalizzatore la miscela
TiCl4 - AlEt3 (1:5).
Natta (1955) ottenne il polipropilene isotattico (moplen) usando come
catalizzatore stereospecifico la miscela TiCl3 – AlEt3 .
[Al(C2H5)Cl( 2-Cl)2Ti(C2H5)( 5-C5H5)2]
Metodi di sintesi dei complessi alchilici e arilici
1. Metallazione (metallo + composto organico con H acido)
M
Na
+
+
RH
MR
Na+[C5H5]-
C5H6
+
+
½ H2
½ H2
2. Metallazione (metallo + alogenuro alchilico o arilico):
2M
2 Li
+
+
C2H5Br
RX
LiC2H5
MR
+
+
MX
LiBr
3. Addizione ossidativa (metallo o complesso + alogenuro alchilico)
M
Mg
+
C2H5Br
+
RX
RMX
C2H5MgBr
4. Attacco elettrofilo di R+ (complesso + alogenuro alchilico)
[MLn]
[Mn(CO)5]-
+
+
C2H5I
RX
[MRLn]+
[Mn(C2H5)(CO)5]
+
+
XI-
5. Doppio scambio metallo-metallo (metatesi) (organometallo +
alogenuro metallico)
MR
3 LiCH3
+
SbCl3
+
M’X
Sb(CH3)3
M’R
+
+
3 LiCl
MX
6. Scambio semplice metallo-metallo (transmetallazione) (metallo +
organometallo)
M
Mg
+
+
Hg(CH3)2
M’R
MR
Mg(CH3)2
+
+
M’
Hg
7. Inserzione di un alchene nel legame M-H (metallo-idruro + alchene)
[MHLn]
[MoH( 5-C5H5)2]+
+
+
CH2=CH2
CH2=CH2
+
PR3
[M(CH2CH3)Ln]
[Mo(CH2-CH3)( 5-C5H5)2 (PR3)]+
Meccanismi di rottura del legame M-C
se il metallo è in uno stato di ossidazione ad elevato potere ossidante e
il radicale organico è stabile (evolve facilmente), il legame M-C si rompe
omoliticamente:
[LxM-CRy]
[LxM]
+ [CRy]
se il metallo è in uno stato di ossidazione a basso potere ossidante e
l’anione organico è stabile, il legame M-C si rompe eteroliticamente:
[LxMn+-CRy]
[LxM(n+1)+]+ + [CRy]-
I composti organici, HCRy, più acidi hanno un anione [CRy]- più stabile
ed un radicale CRy meno stabile.
Meccanismi di decomposizione dei complessi alchilici
1. Rottura omolitica del legame M-C:
M-CRy
M
+
CRy
2 CRy
Pb(CH3)4
Pb
+
C2R2y
2 C2H6
2. Rottura eterolitica del legame M-C:
M-CRy
-
CRy
+
M
H2O
+
+
-
HCRy
3. Reazione di -hydrogen transfer
CRy
+
OH-
-eliminazione da complesso
metallo-alchilico:
a) H in posizione
sull’alchile coordinato,
b) sito vacante con un orbitale vuoto sul metallo in cis all’alchile, che
possa accettare la coppia elettronica del legame C-H, interazione agostica
c) orbitale pieno sul metallo che possa donare la coppia elettronica al
legame C-H,
d) coplanarità degli atomi M-C-C-H.
4. Eliminazione riduttiva: distacco del gruppo alchilico e di un altro
gruppo X coordinato (X: idrogeno, alogeno, alchile), es.
[MCH3XLn]
[MLn]
+
CH3X
Struttura di un complesso organometallico di Li
Alo stato solido, il metillitio, LiCH3 , è un tetramero; la struttura presenta un
impaccamento cubico a corpo centrato di unità (LiCH3)4, in cui ci sono 4
atomi di Li (ibridizzati sp3) ai vertici un tetraedro e 4 gruppi metilici a ponte
triplo sulle facce del tetraedro.
- 1 orbitale sp3 assiale con l’asse ternario del tetraedro (utilizzato per
l’interazione debole con un C metilico di un’unità vicina oppure per
l’interazione con gruppi -donatori (solvente, basi di Lewis).
- 3 orbitali sp3 tangenziali puntano verso la normale alle facce del
tetraedro (utilizzati per l’interazione con orbitali sp3 del C metilico (4c-2e-).
Altri modi di coordinazione dei leganti alchilici
a ponte doppio ( 2- 1) o ( 2- 2) (legame a 3c-2e-) (legame a 4c-2e-)
[Al( 2-CH3)(CH3)2]2
a ponte triplo ( 3- 1) (legame a 4c-2e-)
a ciclo (effetto chelante) (k2) (2 legami a 2c-2e-)
reductive extrusion
oxidative coupling
Strutture dei complessi organometallici di Mg
Allo stato solido, il dietilmagnesio, Mg(C2H5)2 , è un polimero con i gruppi
etilici a ponte doppio.
Allo stato solido, i Grignard RMgX cristallizzano come monomeri con
struttura tetraedrica coordinando 2 molecole di solvente (etere).
In soluzione i Grignard, RMgX danno l’equilibrio di Schlenk:
Complessi acilici
Composti organometallici con legami singoli M-C(=O)-R
Metodi di sintesi dei complessi acilici
1. inserzione del CO nel legame M-C di un alchile
[Mn(CH3)(CO)5]
+
CO
[Mn C(=O)-CH3 (CO)5]
2. attacco nucleofilo di R- su un metallo-carbonile
[W(CO)6]
+
LiR
[W C(=O)R (CO)5]-
+
Li+