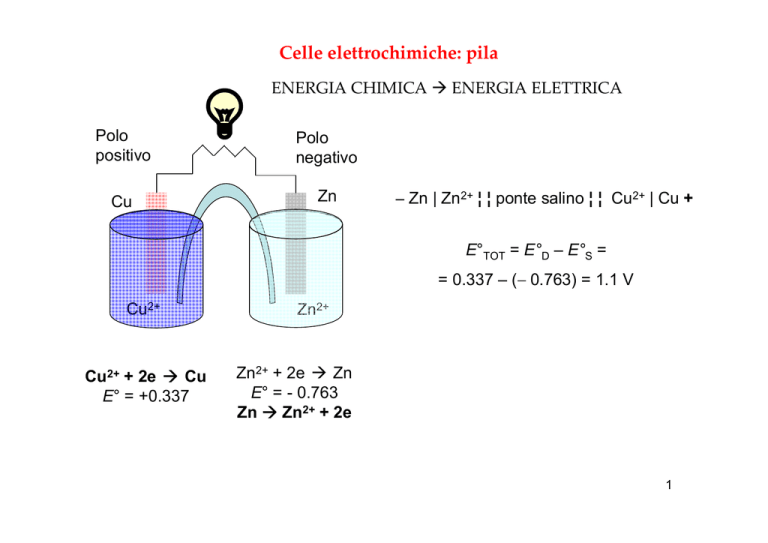
Celle elettrochimiche: pila
ENERGIA CHIMICA
Polo
positivo
Polo
negativo
Cu
Zn
ENERGIA ELETTRICA
Zn | Zn2+ ¦ ¦ ponte salino ¦ ¦ Cu2+ | Cu +
E°TOT = E°D – E°S =
= 0.337 – ( 0.763) = 1.1 V
Cu2+
Cu2+ + 2e
Cu
E° = +0.337
Zn2+
Zn2+ + 2e
Zn
E° = - 0.763
Zn
Zn2+ + 2e
1
Elettrodi di riferimento
-
Valore di potenziale accuratamente conosciuto
-
Potenziale costante e insensibile a variazioni di composizione della soluzione
analitica
-
Potenziale costante anche durante il passaggio di piccole correnti
-
Facile da costruire e gestire
-
Stabile nel tempo
-
Riproducibile
-
Reversibile
2
Elettrodi di riferimento
SCE (Satured Calomel Electrode): elettrodo a calomelano
Pt | Hg | Hg2Cl2 | KCl saturo (4.8 m) ¦ ¦
Hg2Cl2 + 2e
E=E
2Hg + 2Cl-
RT
ln aCl2
2F
Hg
E% = + 0.26804 V (SHE) a 298 K
ESCE = 0.2444 V (SHE) a 298 K
estremamente stabile
potenziale abbastanza variabile con la
temperatura, non utilizzabile per T > 75°C
3
Elettrodi di riferimento
Elettrodo ad argento | argento cloruro, Ag | AgCl
Pt | Ag | AgCl | KCl saturo (4.8 m) ¦ ¦
AgCl + e
E=E
Ag + Cl-
RT
ln aCl
F
EӨ = 0.22234 V (SHE) a 298 K
EAg/AgCl/KCl sat = 0.1987 V (SHE) a 298 K
Molto compatto e miniaturizzabile; usato negli elettrodi combinati
Usabile nei solventi organici con meno problemi del precedente
estremamente stabile, anche ad alte temperature (> 80°C)
fotosensibili: AgCl + h
ATTENZIONE
Ag + Cl- + e
Ag/AgCl/1.0 M KCl
+0.235 V (SHE)
Ag/AgCl/0.6 M KCl
+0.25 V (SHE)
Ag/AgCl (Seawater)
+0.266 V (SHE)
Preparazione: METODO BIELETTROLITICO
• I deposizione galvanica su fili di Pt (condotta in KAg(CN)2): Ag+ + e
• II deposizione galvanica (condotta in soluzione di HCl): Ag + Cl-
Ag
AgCl + e
4
Casistica degli Elettrodi
0. Redox o metallici
metallo inerte in contatto con una soluzione contenente una coppia redox
(Pt|Ce3+ + Ce4+): reversibile alla coppia redox.
1. I specie
metallo in contatto con una soluzione contenente ioni della stessa specie
(Ag|Ag+): reversibile allo ione (Ag+)
2. II specie
Metallo ricoperto di un suo sale o di un complesso stabile ed immerso in una
soluzione contenente il controione (Ag|AgCl|Cl-): reversibile al controione
(Cl-)
3. III specie
Metallo ricoperto di un suo sale o di un complesso stabile, sale o complesso
poco solubile di un altro metallo, immerso in una soluzione contenente lo
ione del secondo metallo (Pb|Pb ossalato|Ca ossalato|Ca2+): reversibile al
secondo ione (Ca2+)
4. ISE (Ion Selective Electrode): ionoselettivi (basati su membrane)
5
Elettrodi indicatori
Rispondono rapidamente e riproducibilmente a cambiamenti di concentrazione dell’analita.
Elettrodi di I specie
metallo in contatto con una soluzione contenente ioni della stessa specie
n+
Me (aq) + ne
Me(s)
0
Eind = EMe
+
n+
/Me
RT
0.0592
0
ln aMe n+ = EMe
+
log aMe n+
n+
/Me
nF
n
molto semplici da usare
l’elettrodo non è molto sensibile, risponde anche ad altri ioni interferenti (es. Cu non può
essere usato per sentire Cu2+ in presenza di Ag+)
molti metalli non possono lavorare in soluzioni acide (Zn, Cd)
molti metalli sono così facilmente ossidabili che bisogna lavorare in assenza di O2
molti metalli forniscono potenziali misti poco riproducibili
Ag/Ag+ Hg/Hg2+ (in soluzioni neutre)
Cu/Cu2+ Zn/Zn2+ Cd/Cd2+ Bi/Bi3+ Tl/Tl+ Pb/Pb2+ (in soluzioni deareate)
6
Elettrodi di II specie
Metallo ricoperto di un suo sale o di un complesso stabile ed immerso in una
soluzione contenente il controione
Ag|AgCl:
AgCl (s) + e
Ag +
Cl-
(aq)
E=E
RT
ln aCl = E
F
k log aCl
problemi di interferenze con CN-, SCN-, S2-, Br-, Ifotosensibili: AgCl + h
Ag + Cl- + e
Ag|AgBr Ag|AgI
Hg|HgY2- (dove Y=EDTA):
HgY2-
+ 2e
Hg +
Y4-
E = cost.
k
log aY 4
2
7
Elettrodi Redox
metallo inerte (Pt, Au, Pd, C) in contatto con una soluzione contenente una
coppia redox. Gli elettrodi scambiano elettroni reversibilmente con gli elementi
della coppia redox, senza subire processi redox o di corrosione.
aCe3+
k
0
Eind = ECe
+
log
4+
/Ce 3+
n
aCe 4+
(Ce4+/Ce3+; Fe3+/Fe2+; Mn2+/MnO4-; ….).
Elettrodi di III specie
Metallo ricoperto di un suo sale o di un complesso stabile, sale o complesso poco
solubile di un altro metallo, immerso in una soluzione contenente lo ione del
secondo metallo.
Pb|Pb ossalato|Ca ossalato|Ca2+
8
ISE: elettrodi ionoselettivi
Elettrodi che mostrano una risposta Nernstiana verso un singolo ione in soluzione
EISE
k
= U + log aX = U
zi
k
paX
zi
Costante di Nernst:
k = RT/(nF) ln (10) = 0.0591597 (a 298 K, per n = 1)
pX = - log(X)
PRIMARI
• elettrodi a membrana di vetro (“glass electrodes”)
• elettrodi a membrana cristallina o a stato solido (“crystalline or solid state
electrodes”)
• elettrodi a membrana liquida o polimerica
A MEMBRANA MULTIPLA
• a base molecolare, gas-sensibili, ad enzima
• ISFET
9
Membrana selettiva allo ione di
interesse i: i = 1
Funzionamento degli ISE
Potenziale di membrana Em ed
equilibrio di Donnan
Em =
EPILA = ED
k
a
log i
zi
ai
Em = cost +
E S + Em + E j
k
log ai
zi
Per comodità si considera l’ISE quale polo positivo della pila indipendentemente dalla polarità vera
dell’ISE rispetto al riferimento
- Elettrodo di riferimento | ponte salino ¦ ¦ soluzione incognita | ISE +
EPILA = ED + Em ES = EISE
ANIONE
CATIONE
E=U
ERIFERIMENTO (“convenzione dei costruttori”)
(k/|zi|) log(a’i,X) = U + (k/|zi|) pai,X
E = U + (k/zi) log(a’i,X) = U
EISE = U +
(k/zi) pai,X
k
log aX = U
zi
k
paX
zi
Equazione operazionale
10
Utilizzo della equazione operazionale
Calibrazione con uno standard
EISE = U +
k
log aX = U
zi
k
paX
zi
EISE
k/zi
S1
ES1 = U
(k/zi)paS1 + EL,S1’ + EL,S1”
EX = U
(k/zi)paX+ EL,X’ + EL,X”
paX = paS1
(EX ES1) / (k/zi)
paX
Calibrazione monostandard
11
Utilizzo della equazione operazionale
Calibrazione con due standard: forcella degli standard
EISE = U +
EISE
k
log aX = U
zi
k
paX
zi
S1
ES1 = U
(k/zi)paS1 + EL,S1’ + EL,S1”
ES2 = U
(k/zi)paS2 + EL,S2’ + EL,S2”
EX = U
(k/zi)paX+ EL,X’ + EL,X”
S2
paX = paS1 + (EX ES1) (paS2
paS1) / (ES2
ES1)
paX
Forcella degli standard
12
Utilizzo della equazione operazionale
Curva di calibrazione
EISE = U +
k
log aX = U
zi
k
paX
zi
Caratteristiche di un ISE
EISE
1) Grado di idealità
2) Limite di rilevabilità, LOD (detection limit)
3) Tempo di risposta
4) Selettività
paX
Curva di calibrazione o retta di taratura
13
Grado di idealità
EISE = U
EISE
EISE = U
k
paX
zi
i
zi
k
paX = U
Q
paX
zi
Q/zi
Q si determina sperimentalmente dalla retta di calibrazione
k = RT/(ziF) ln(10)
paX
G.I. % = Q/k * 100
poiché
.1
G.I.% ≤ 100%
14
Limite di rilevabilità o detection limit (LOD)
EISE
Attività di ione primario aiD alla
quale questa viene sentita come
uguale al rumore di fondo, ar
E = U + (k/zi)log ai,DL (retta)
E’ = U + (k/zi)log(ai,DL + ar ) (curva)
paX
in particolare, al detection limit si ha: ai,DL + ar = 2 ai,DL e quindi
E’ = U + (k/zi)log(2 ai,DL )
perciò il detection limit è situato dove
|E’ E| = distanza tra la curva e la retta = (k/zi) log(2)
ovvero, disponendo della pendenza sperimentale dell’elettrodo Q,
paDL
|E’ E| = distanza tra la curva e la retta = Q log(2)
15
Elettrodo a vetro per il pH
1906
Isolante
Basato su una membrana vetrosa (di spessore 50100 µm) avente H+ 0 1
Ag ricoperto con AgCl
Corning 015 Glass
Strato idrato
del vetro. Gel.
Conduzione
dovuta a Na+
ed a Li+.
Spessore di
circa 0.1 µm.
72%SiO2
6% CaO
22%Na2O
HCl
Sol. interna
Strato secco del vetro. Conduzione dovuta
solo a Na+. Spessore di circa 0.1 mm
Sol. esterna
Vetro non poroso:
non si formano potenziali interliquidi Ej
alta resistenza del sistema: necessità di determinare piccole correnti
16
Disposizione sperimentale per la determinazione del pH
Elettrodo a vetro per pH ed “elettrodo” combinato
( ) Pt|Hg|Hg2Cl2|KCl 4,8 m(sat.) ¦¦ Elettrodo “a vetro” pH-metrico (+)
ELETTRODO A
VETRO
“ELETTRODO”
COMBINATO
17
Titolazioni potenziometriche
Misura del potenziale di un elettrodo indicatore in funzione del volume di titolante
2 ottenimento della curva di titolazione completa
dati più accurati per soluzioni sia diluite sia concentrate
non c’è necessità di tarare lo strumento (misura indiretta)
molto utile per titolazioni critiche (soluzioni torbide
o colorate)
sistema automatizzabile (titolatori automatici)
maggior tempo richiesto per la titolazione
E/V
p.e.
VTit
18
Determinazione del punto finale
E/V
1) Stima visiva del punto di flesso
1)
2) Calcolo della derivata prima
3) Calcolo della derivata seconda
4) Gran’s Plot
E/V
p.e.
VTit
E/V
2)
3)
p.e.
VTit
p.e.
VTit
19
Titolazione pH-metrica acido forte/base forte
pH
7
punto finale
VT
20
Titolazione pH-metrica acido debole/base forte
pH
>7
pH
pKa
p.f./2
p.f.
VT
21
Titolazione pH-metrica acido forte + acido debole/base forte
5000
14
13
4500
12
11
4000
10
3500
9
pH
2500
7
6
2000
5
4
1500
3
1000
2
Derivata I
3000
8
500
1
0
0
0.01
0.02
0.03
V T/dm
0.04
0.05
0
0.06
3
22
Titolazioni complessometriche
Durezza delle acque
+ Ca2+ 2
(Mg2+)
-Elettrodo di riferimento | ponte salino ¦ ¦ soluzione incognita | ISE Ca2+/Mg2+ +
Titolante: EDTA (tamponare a pH 9)
EISE
Ca2+
Ca2+ + Mg2+
VEDTA
23
Durezza delle acque
• Durezza totale: ioni dei metalli alcalino terrosi (Ca2+, Mg2+, Sr2+, Ba2+) presenti nell’acqua
in combinazione con anioni di acidi forti e deboli
• Durezza temporanea: ioni dei metalli alcalino terrosi presenti nell’acqua in combinazione
con anione bicarbonato (HCO3-)
Ca(HCO 3 ) 2
ebollizione
Ca(CO) 3
+ CO 2 + H 2 O
• Durezza permanente: ioni dei metalli alcalino terrosi presenti nell’acqua in combinazione
con anioni di acidi forti (Cl-, SO42-, NO3-, …)
Determinazione sperimentale:
1) Durezza totale: titolazione complessometrica
del Ca2+ e del Mg2+ con EDTA ed ISE Ca2+/Mg2+
pH
2) Durezza temporanea: titolazione pH-metrica
dei bicarbonati (base debole) con HCl
4
3) Durezza permanente: dalla differenza dei
primi due
Gradi francesi:
mg (CaCO3 )
f°=
100 g (soluzione)
Gradi tedeschi:
mg (CaO)
d° =
100 g (soluzione)
VHCl
24
Titolazioni argentimetriche
AgNO3 + X 2 AgX 9 + NO3
AgX
KS
Ag + + X
K S = aAg+ aX
Ag+ + e 2 Ag
0
E = EAg
k log
+
/Ag
1
aAg +
( )
0
0
= EAg
+
=
+ k log
k
log
a
E
+
+
/Ag
Ag
Ag + /Ag
KS
=
aX
0
= EAg
+ k log( K S ) k log(aX ) = cost. k log(aX )
+
/Ag
E/V
I + Cl
E/V
Miscela di
alogenuri:
I- e ClVAgNO3
I
VAgNO3
25
Titolazioni argentimetriche
AgNO3 + X 2 AgX 9 + NO3
Ag+ + e 2 Ag
- Elettrodo di riferimento | ponte salino esente da alogenuri ¦ ¦ soluzione incognita | filo di Ag +
Elettrodo di prima specie
- Pt | Hg | Hg2Cl2 | KCl sat. ¦ ¦ KNO3 ¦ ¦ soluzione incognita | filo di Ag |Pt +
2 Necessità di una doppia camicia per contenere il secondo ponte salino
26
Titolazioni redox
Sfruttano reazioni di ossidoriduzione ed utilizzano come elettrodo indicatore un
elettrodo redox (inerte) che sente le coppie redox in gioco
5 Fe 2+ + MnO -4 + 8H +
5Fe3+ + Mn 2 + + 4H 2 O
Prima del punto finale: coppia Fe3+/Fe2+
Fe3+ + 1 e -
Fe 2+
0
E = EFe
3+
/Fe 2+
k log
E/V
aFe 2+
0
EMn
2+
/MnO -
aFe3+
4
Dopo il punto finale: coppia Mn2+/MnO4-
Mn 2+
MnO 4 + 5 e 0
E = EMn
2+
/MnO -
4
0
EFe
3+
/Fe 2+
p.f.
VKMnO4
a 2+
k
log Mn
5
aMnO
4
27
Titolazioni redox
5 Fe 2+ + MnO -4 + 8H +
5Fe3+ + Mn 2 + + 4H 2 O
- Elettrodo di riferimento | ponte salino ¦ ¦ soluzione incognita | filo di metallo inerte +
- Pt | Hg | Hg2Cl2 | KCl sat. ¦ ¦ soluzione incognita | filo di Pt o Au +
Necessità di mantenere l’acidità per la reazione
(aggiungere acido solforico)
Elettrodo redox
28