Chimica Fisica I - AA 2015/2016
25 gennaio 2016
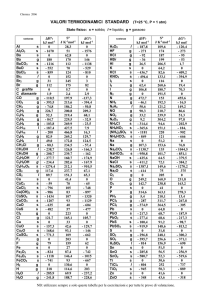
1. È stata suggerita la seguente reazione per al sintesi della α-cianopiridina C4H6 (g) + C2N2(g) = C6H4N2 (s) + H2 (g) e sono noti i seguenti
parametri termodinamici
S (298 K) J mol-1 K-1
f H (298 K) kJ mol-1
butadiene (g)
111.91
cianogeno (g)
300.49
α-cianopiridina (s)
300.08
idrogeno (g)
0
Calcolate la costante di equilibrio per la sintesi proposta della α-cianopiridina a 298 K
321.47
241.16
322.54
130.58
2. Calcolate la costante di dissociazione dell’acido nitrico in acqua a 70 C note le energie libere standard di formazione dell’acido
nitrico in soluzione acquosa (-111.25 kJ mol-1) e dello ione nitrato (-108.74 kJ mol-1), e loro entropie standard (146.4 J mol-1 K-1 e
146.4 J mol-1 K-1).
3. per una cella Ag|AgCl | HCl(aq) | Hg2Cl2, Hg la forza elettromotrice E vale 45.5 mV a 25 C ed il coefficiente di temperatura dE/dT vale
0338 mv/C. Scrivete la reaizone di cella e determinate r G, r H , r S .
4. L’enzima ribonucleasi catalizza la degradazione dell’acido ribonucleico seguendo la cinetica di Michaelis-Menten
k1
k k
k3
ES
E S
E P sapendo che k3 7.9 102 s-1 e K m 2 3 7.9 103 M e che la concentrazione di ribonucleasi
k2
k1
iniziale è E0 1.5 10 1 M, calcolate la velocità massima di catalisi.
5. La reazione 2A + B 2D procede secondo il meccanismo
k'
A B
C
k ''
C A
2D
Chimica Fisica I - AA 2015/2016
Applicando l’ipotesi dello stato stazionario all’intermedio C, determinate l’ordine di reazione e la relativa costante di velocità
dell’equazione cinetica per la comparsa di D.
Costante dei gas R
-1
-1
8.314390 J mol K
8.31439 Pa m3 mol-1 K-1
82.05670 atm cm3 mol-1 K-1
0.08205670 atm l mol-1 K-1
83.14390 bar cm3 mol-1 K-1
62.36310 torr l mol-1 K-1
1.987190 cal mol-1 K-1
Chimica Fisica I - AA 2015/2016