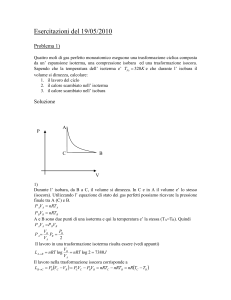
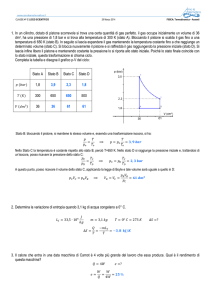
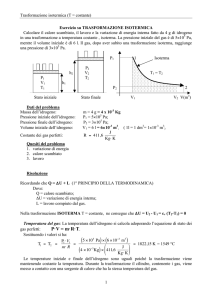
1
1. Problema di: Termodinamica - n◦ 39
Testo
(a) Il rendimeno di un qualunque ciclo termodinamico è: X) minore o uguale a 1; Y) maggiore o
uguale a 1; Z) uguale a 1; W) nessuna delle precedenti.
(b) La legge dei gas perfetti: X) non contiene il volume del gas; Y) non contiene la temperatura
del gas; Z) non contiene l’energia interna del gas; W) non contiene la pressione del gas.
(c) Di un gas, durante una trasformazione isocora, non cambia: X) il volume; Y) la temperatura;
Z) la pressione; W) l’energia interna.
(d) Di un gas, durante una trasformazione isoterma, non cambia: X) la temperatura; Y) il volume; Z) la pressione; W) l’energia interna.
(e) Di un gas, durante una trasformazione isobara, non cambia: X) il volume; Y) la temperatura;
Z) la pressione; W) l’energia interna.
(f) Il rendimeno di un ciclo di Carnot: X) è sempre maggiore di 1; Y) dipende solo dalla temperatura finale del gas; Z) dipende dalle temperature a cui viene scambiato il calore; W) dipende
solo dalla temperatura iniziale del gas.
(g) Il calore scambiato ad alta temperatura, rispetto a quello scambiato a bassa temperatura è:
X) più pregiato; Y) meno pregiato; Z) egualmente pregiato; W) dipende dai casi.
(h) Per aumentare la tempratura di un gas è sufficiente: X) comprimerlo; Y) farlo espandere; Z)
aumentarne la pressione; W) aumentarne l’energia interna.
(i) Per aumentare l’energia interna di un gas è sufficiente: X) comprimerlo; Y) fargli compiere
una trasformazione isocora; Z) farlo espandere; W) fargli compiere una espansione isobara.
(j) Un gas compie sicuramente del lavoro se: X) viene compresso; Y) si espande; Z) si scalda; W)
nessuna delle precedenti.
(k) C’è scambio di calore durante una compressione isoterma? X) si; Y) no; Z) forse; W) a volte.
Spiegazione A tutte queste domande è possibile rispondere conoscendo pochi semplici concetti
di termodinamica.
(a) la legge fondamentale dei gas perfetti
P V = N KT
(b) le quattro principali trasformazioni termodinamiche: isoterma, isocora, isobara ed adiabatica
(c) la legge fondamentale della termodinamica
∆U = δQ − δL
(d) il legame tra variazione di volume e lavoro fatto: se il gas si espande fa lavoro verso l’esterno;
se si comprime riceve lavoro dall’esterno
(e) il legame tra temperatura ed energia interna: queste due variabili di stato sono direttamente
correlate tra loro, se varia una, varia in proporzione anche l’altra.
Svolgimento
(a) Il rendimeno di un qualunque ciclo termodinamico è: W) nessuna delle precedenti: minore di 1
i. Questo viene affermato nella seconda legge della termodinamica.
(b) La legge dei gas perfetti: Z) non contiene l’energia interna del gas
i. Basta leggere la formula della legge dei gas perfetti P V = N KT
(c) Di un gas, durante una trasformazione isocora, non cambia: X) il volume
i. Questa è la definizione di trasformazione isocora
(d) Di un gas, durante una trasformazione isoterma, non cambia: X) la temperatura
i. Questa è la definizione di trasformazione isoterma
(e) Di un gas, durante una trasformazione isobara, non cambia: Z) la pressione
2
i. Questa è la definizione di trasformazione isobara
(f) Il rendimeno di un ciclo di Carnot: Z) dipende dalle temperature a cui viene scambiato il calore
i. Oltre ad essere un principio valido in linea generale, basta guardare la formula del rendimento del ciclo di Carnot: ηCarnot = 1 − TTbassa
alta
(g) Il calore scambiato ad alta temperatura, rispetto a quello scambiato a bassa temperatura è:
X) più pregiato;
i. Con il calore scambiato ad alta temperatura è possibile ottenere cicli con rendimenti maggiori.
(h) Per aumentare la tempratura di un gas è sufficiente: W) aumentarne l’energia interna
i. Energia interna di un gas e temperatura sono strettamente legati insieme, in particolare
sono tra loro direttamente proporzionali
(i) Per aumentare l’energia interna di un gas è sufficiente: W) fargli compiere una espansione isobara
i. Se un gas compie un’espansione isobara, osservando il grafico o la legge dei gas perfetti,
si nota che la temperatura aumenta e quindi aumenta l’energia interna.
(j) Un gas compie sicuramente del lavoro se: Y) si espande
i. il lavoro prodotto da un gas è sempre legato alla variazione di volume di quel gas. Nel
caso di espansione il gas cede sempre lavoro all’esterno
(k) C’è scambio di calore durante una compressione isoterma? X) si
i. In una compressione il gas riceve lavoro, ma visto che l’energia interna non cambia durante un’isoterma, allora quell’energia in ingresso deve immediatamente uscire sotto forma di calore.