Esercitazioni del 19/05/2010
Problema 1)
Quattro moli di gas perfetto monoatomico eseguono una trasformazione ciclica composta
da un’ espansione isoterma, una compressione isobara ed una trasformazione isocora.
Sapendo che la temperatura dell’ isoterma e’ TFe 320K e che durante l’ isobara il
volume si dimezza, calcolare:
1. il lavoro del ciclo
2. il calore scambiato nell’ isoterma
3. il calore scambiato nell’ isobara
Soluzione
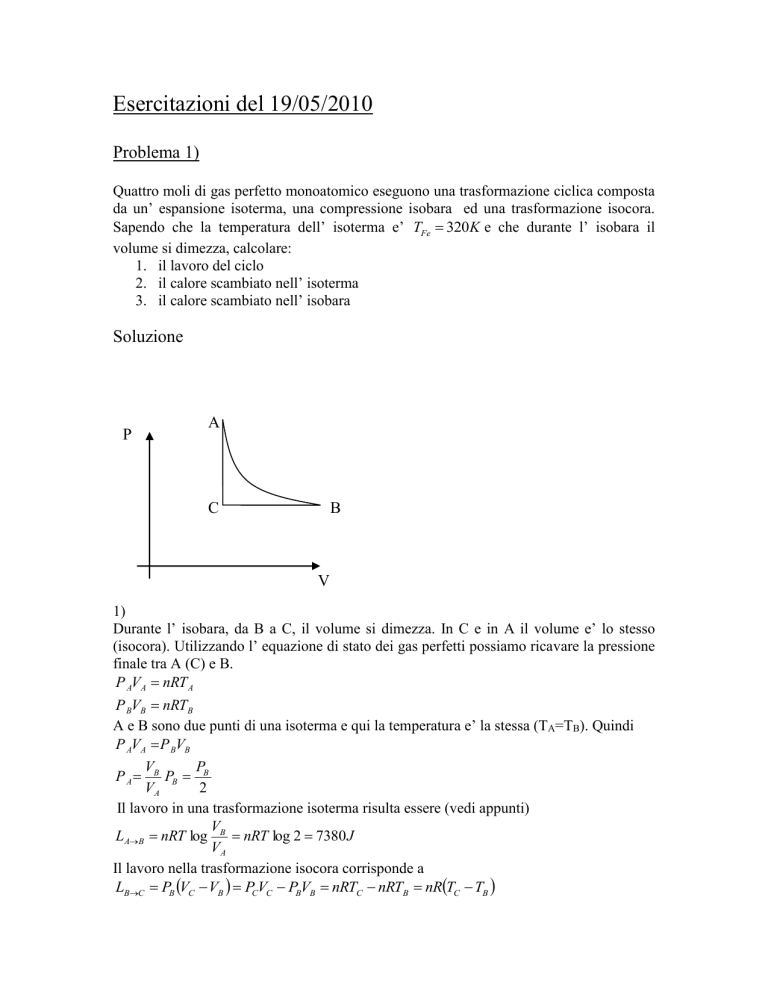
P
A
C
B
V
1)
Durante l’ isobara, da B a C, il volume si dimezza. In C e in A il volume e’ lo stesso
(isocora). Utilizzando l’ equazione di stato dei gas perfetti possiamo ricavare la pressione
finale tra A (C) e B.
P AVA nRT A
P BVB nRTB
A e B sono due punti di una isoterma e qui la temperatura e’ la stessa (TA=TB). Quindi
P AVA P BVB
VB
P
PB B
VA
2
Il lavoro in una trasformazione isoterma risulta essere (vedi appunti)
V
LAB nRT log B nRT log 2 7380 J
VA
Il lavoro nella trasformazione isocora corrisponde a
LBC PB VC VB PCVC PBVB nRTC nRTB nRTC TB
P A
Dobbiamo calcolare la temperatura in C. Sempre dall’ equazione dei gas perfetti
P
(ricordandoci che VC VA ; P C PB A ) abbiamo
2
P CVC nRTC
PA
1
VA nRT A
2
2
TC TA / 2 160 K
Quindi il lavoro corrisponde a
LBC nRTC TB 5320 J
P CVC
Nella isocora il lavoro e’ nullo.
Nell’ intero ciclo abbiamo percio’
Lciclo LAB LBC LC A 7380 J 5320 J 0 2060 J
2)
Dal primo principio sappiamo che
Q L U
In una trasformazione isoterma la temperatura e’ costante e quindi non vi e’ variazione di
energia interna
U AB 0
QAB LAB 7380 J
3)
Il calore scambiato in una isobara e’
QBC ncP TC TB
dove (per un gas monoatomico)
3
5
cP cV R R R R
2
2
Quindi otteniamo
5
QBC n RTC TB 13300 J
2
Problema 2)
Un blocco di ferro di massa mFe 900 g a temperatura TFe 10o C viene immerso in un
recipiente isolato termicamente contenente 2 litri d’ acqua a temperatura Tac 80o C . Si
calcoli la temperatura finale dell’ acqua e del ferro i cui calori specifici sono:
cac 4186 J /( kgK ) e cFe 444 J /( kgK )
Soluzione
All’ equilibrio acqua e ferro hanno la stessa temperatura che viene raggiunta scambiando
calore. Poiche’ le pareti del recipiente sono isolanti il sistema e’ isolato termicamente e il
calore ceduto dall’ acqua deve essere uguale (a meno di un segno) a quello che acquisito
dal ferro.
Il calore nei due casi vale
Qac cac mac (T f Tac )
QFe cFemFe (T f TFe )
Imponendo dunque che i due calori siano uguali in modulo e opposti in segno abbiamo
Qac QFe
cac mac (T f Tac ) cFemFe (T f TFe )
da cui
T f (cac mac cFemFe ) cFemFeTFe cac macTac
che da’
c m T c m T
T f Fe Fe Fe ac ac ac 77 0C
cac mac cFe mFe
Problema 3) (casa)
Si consideri un gas contenuto in un cilindro chiuso da un pistone mobile di sezione
S=40cm2. Il cilindro e’ un buon conduttore termico e si trova in un ambiente a
temperatura T=200C e pressione p0=1,013 105 Pa. Inizialmente sul pistone e’ posto un
blocco di massa M=1.2kg e il pistone si trova ad un’ altezza h=8cm dal fondo del
cilindro. Successivamente il gas compie il seguente ciclo: 1) la massa M viene tolta ed il
gas si espande raggiungendo l’ equilibrio termico; 2) la massa viene rimessa sul pistone,
il gas viene compresso e ritorna nello stato iniziale. Si calcoli il calore scambiato nel
ciclo.
Soluzione
Il ciclo e’ fatto da due trasformazioni, entrambe a pressione costante. Si tratta di
trasformazioni irreversibili. Il lavoro per una trasformazione a pressione costante si
calcola come
L PV1 Vi
Nella prima espansione la pressione e’ quella atmosferica. Nella compressione invece
essa corrisponde alla pressione atmosferica con l’ aggiunta della pressione dovuta alla
forza peso della massa M. Quindi
L1 P0 V1 Vi
L2 P0 Mg / S Vi V1
La variazione di volume si calcola dall’ equazione dei gas perfetti. Infatti il cilindro e’ un
buon conduttore e dopo la prima trasformazione il sistema sara’ di nuovo alla
temperatura iniziale. Percio’
P0 Mg / S Vi nRT
da cui
P 0V1 nRT
V 1 P0 Mg / S Vi / P0 Sh Mgh / P0
Quindi il lavoro risulta valere
L1 P0 V1 Vi Mgh
Per il secondo tratto
M 2 g 2h
L2 P0 Mg / S Vi V1 Mgh
P0 S
Nel ciclo dunque abbiamo
M 2 g 2h
Lciclo L1 L2
P0 S
La temperature finale e’ uguale a quella iniziale quindi la variazione di energia interna e’
nulla ( U 0) . Dal primo principio otteniamo
U ciclo 0
Qciclo Lciclo
M 2 g 2h
0.027 J
P0 S
Questo lavoro (negativo) coincide con il lavoro fatto dalla forza peso (Lext) per spostare la
massa dalla quota h alla quota h’ cambiato di segno.