4^B/C
7/02/2011
Temperatura e calore: la visione macroscopica
1. La Torre Eiffel, costruita nel 1889 da Alexandre Eiffel, è un’imponente struttura in traliccio di ferro. Sapendo che la torre è
alta 301 m alla temperatura di 22° C, calcola quanto varia la sua altezza se la temperatura scende fino a 0°C.
α = 12 ⋅ 10− 6 K − 1
Lo = 301 m
To = 22° C
T = 0° C
∆L ?
L = Lo (1 + α ∆ T ) , perciò:
∆ L = L − Lo = Lo α ( T − To ) =
Per la formula della dilatazione lineare:
− 7,9 cm
2. Supponi che la pressione di una palla da basket sia di 173 kPa, a una temperatura di 293 K e che il suo diametro sia di
30 cm. Quante moli di aria contiene una palla da basket gonfia?
p = 173 ⋅ 103 Pa
T = 293 K
d = 30 ⋅ 10 − 2 m
⇒
r = 15 ⋅ 10− 2 m
n ?
Secondo l’equazione di stato dei gas perfetti,
n=
p V = n R T e da questa si ricava:
p V 173 ⋅ 103 Pa ⋅ 4 / 3 ⋅ π (15 ⋅ 10 − 2 m )3
=
=
RT
8,314 J /( mol K ) ⋅ 293 K
1 mol
3. Se sono necessari 4 kJ di energia termica per innalzare la temperatura di un oggetto di ferro di 45 K, qual è la sua
massa?
Q = 4 ⋅ 103 J
c = 460 J / kg K
Per l’equazione fondamentale della termologia,
∆ T = 45 K
Q = c m ∆ T , perciò:
Q
m=
= 193 g
c ∆T
4. Quanto calore è necessario per fondere 2 kg di ghiaccio?
Q = m L f = 2 kg ⋅ 335,2 ⋅ 103 J / kg =
670 400 J
m ?
4^B/C
7/02/2011
Temperatura e calore: la visione macroscopica
5. Versi 550 g di acqua a 32° C in una scatola di alluminio (calore specifico 880 J/kg K) di 250 g che si trova a una
temperatura iniziale di 15° C. Trova la temperatura finale del sistema, supponendo che non venga scambiato calore con
l’ambiente circostante.
31° C
m1 = 0,55 kg
m2 = 0,25 kg
T1 = 32° C
T2 = 15° C
c1 = 4186 J / kg K
c2 = 880 J / kg K
Te ?
Il calore Q1 che l’acqua cede all’alluminio è negativo. Il calore Q2 che l’alluminio riceve dall’acqua è positivo e contribuisce ad
aumentare la sua temperatura. La somma delle due energie dà un risultato nullo: il calore ceduto dall’acqua è uguale al calore
ricevuto dall’alluminio, ovvero:
Q1 + Q2 = 0
Tramite l’equazione fondamentale della termologia:
c1 m1 ( Te − T1 ) + c2 m2 ( Te − T2 ) = 0
Risolvendo l’equazione in funzione della temperatura di equilibrio, soddisfo la richiesta del problema:
c1 m1 Te − c1 m1 T1 + c2 m2 Te − c2 m2 T2 = 0
Te ( c1 m1 + c2 m2 ) = c1 m1 T1 + c2 m2 T2
Te =
c1 m1 T1 + c2 m2 T2
=
c1 m1 + c2 m2
30,52° C
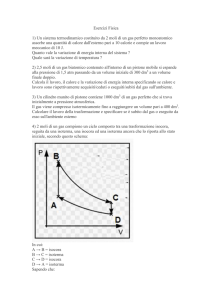
6. Illustra sul piano di Clapeyron gli andamenti delle trasformazioni dei gas studiate (isoterma, isobara, isocora), mettendo in
risalto le loro differenze.
p
Trasformazione isobara
Trasformazione isocora
Trasformazione isoterma
V
Nel caso di una trasformazione isobara, si mantiene costante la pressione, perciò in un grafico Vp si ottiene un segmento di retta
parallelo all’asse delle ascisse (V).
V
T
=
Vo To
Nel caso di una trasformazione isocora, si mantiene costante il volume, perciò in un grafico Vp si ottiene un segmento di retta
parallelo all’asse delle ordinate (p).
p
T
=
po To
Nel caso di una trasformazione isoterma, pressione (p) e volume (V) sono inversamente proporzionali, ovvero otteniamo un ramo di
iperbole, tanto più vicino all’origine minore è la temperatura.
p V = cos t.