Nome ……………………..Cognome………………………..
classe 4D
12 aprile 2011
VERIFICA di FISICA
Domande
1)
Dai la definizione di calore specifico e calore molare. Nel caso di un gas ideale indica e
ricava i possibili valori del calore molare, dandone una spiegazione.
2)
Spiega come si determina il lavoro compiuto da un gas ideale, durante una generica
trasformazione termodinamica reversibile.
Se un gas in uno dato stato termodinamico triplica il suo volume, in quale delle seguenti
trasformazioni compirà maggior lavoro e perché ? A) isoterma B) isobara C) adiabatica. Per
rispondere è necessario specificare di che tipo di gas si tratta ?
3)
Enuncia il principio di equipartizione dell’energia e da quello ricava l’espressione della
velocità quadratica media delle molecole di un gas perfetto, in funzione della massa molare del gas
e della temperatura. Considera elio ed ossigeno ad una temperatura T fissata, calcola, se è possibile,
vqm ( He)
E c ( He)
il rapporto tra le velocità quadratiche medie
e tra le energie medie
, motivando
vqm (O2 )
Ec (O2 )
tutti i passaggi.
4)
Indica se le seguenti affermazioni sono vere o false, specifica il perché.
a) In una trasformazione adiabatica reversibile la temperatura diminuisce.
b) In una trasformazione isocora, a parità di calore scambiato, una mole di gas
biatomico aumenta la sua temperatura più che in un'isobara.
c) In una trasformazione isoterma il calore scambiato è nullo perché non c'è variazione
di temperatura.
Problema
3 moli di gas perfetto monoatomico alla pressione P=1 atm occupano un volume V=40 dm3. Il gas
descrive un ciclo termodinamico reversibile costituito da:
un’espansione adiabatica che ne raddoppia il volume,
una compressione isoterma che lo riporta al volume iniziale e
un’isocora
Rappresenta il ciclo in n piano P-V. Determina calore, lavoro e variazione di energia interna in
ciascuna trasformazione. Calcola il lavoro complessivamente compiuto nel ciclo e il calore
assorbito.
Verifica di fisica 12 Aprile
1
Soluzioni verifica 12 Aprile
1)
Dai la definizione di calore specifico e calore molare. Nel caso di un gas ideale indica e
ricava i possibili valori del calore molare, dandone una spiegazione.
Nelle trasformazioni in cui il calore scambiato produce una variazione di temperatura, c’è
proporzionalità diretta tra Q e ∆T , la costante di proporzionalità C che si chiama capacità termica,
è a sua volta direttamente proporzionale alla massa o al numero di moli.
Quindi
Q
Q
cspecifico =
cmolare =
m∆T
n∆T
tali grandezze dipendono dal particolare gas e dalla specifica trasformazione.
I calori molari possono avere i seguenti valori:
f
per una trasformazione a volume costante: cV = R
2
f
per una trasformazione a pressione costante: cP = R + R
2
dove f sono i gradi di libertà pari a 3 per i gas monoatomici e 5 per quelli biatomici.
I valori sopra riportati si ricavano dal primo principio e dalla teoria cinetica dei gas:
per le trasformazioni isocore L = 0 quindi Q = ∆U , sostituendo le espressioni corrispondenti:
f
f
ncV ∆T = n R∆T si ricava cV = R
2
2
per le trasformazioni isobare L = nR∆T , da
Q = L + ∆U , sostituendo le espressioni
corrispondenti:
f
f
ncP ∆T = nR∆T + n R∆T si ricava cP = R + R
2
2
2) Spiega come si determina il lavoro compiuto da un gas ideale,
durante una generica trasformazione termodinamica reversibile.
P
Un gas ideale compie lavoro quando applicando una forza sul
pistone mobile del cilindro nel quale è contenuto produce uno
spostamento, cioè se si espande o si comprime. Nel caso semplice
di trasformazione isobara, la forza applicata dal gas sul coperchio è
costante,
lo
spostamento
prodotto
rettilineo,
quindi
r r
L = F ⋅ ∆r = F∆r , ricordando il legame tra forza e pressione
L = pS∆r cioè L = p∆V . Per una trasformazione generica,
V
N
reversibile L = ∑ pi ∆Vi che graficamente è rappresentata dal ± area della regione di piano
i =1
individuata dalla trasformazione nel piano p-V, secondo la
convenzione adottata + nel caso di espansione e ù nel caso di
compessione.
Se un gas in uno dato stato termodinamico triplica il suo volume,
in quale delle seguenti trasformazioni compirà maggior lavoro e
perché ? A) isoterma B) isobara C) adiabatica. Per rispondere è
necessario specificare di che tipo di gas si tratta ?
Osservando le aree sotto le tre corrispondenti trasformazioni,
indipendentemente dal tipo di gas si ha che il lavoro maggiore è
quello compiuto nell’isobara.
Verifica di fisica 12 Aprile
P
isobara
isoterma
adiabatica
V
2
3)
Enuncia il principio di equipartizione dell’energia e da quello ricava l’espressione della
velocità quadratica media delle molecole di un gas perfetto, in funzione della massa molare del gas
e della temperatura. Considera elio ed ossigeno ad una temperatura T fissata, calcola, se è
vqm ( He)
E c ( He)
possibile, il rapporto tra le velocità quadratiche medie
e tra le energie medie
,
vqm (O2 )
Ec (O2 )
motivando tutti i passaggi.
Il principio di equipartizione dell’energia dice che in un gas perfetto ogni molecola dà un contributo
1
all’energia interna pari a kT per ogni grado di libertà, dove k è la costante di Boltzmann definita
2
R
J
come k =
≈ 1,38 ⋅ 10 − 23
. I gradi di libertà f di una molecola rappresentano il numero di
NA
K
coordinate indipendenti necessarie ad individuare la posizione della molecola nello spazio.
L’energia cinetica media traslazionale di una qualunque molecola vale:
3kT
3RT
1
3
Ec = mv 2 = kT quindi v 2 = vqm =
=
2
2
m
M
dove m= massa di una molecola
M= massa molare
Per le molecole monoatomiche l’unica energia possibile è quella cinetica traslazionale, f=3 e di
3
conseguenza Ec = kT
2
Le molecole biatomiche invece hanno f=5, l’energia media di una molecole, che è sia traslazionale
5
sia rotazionale vale: Ec = kT
2
3RT
M O2
vqm ( He)
M He
32 g / mol
Quindi:
=
=
=
= 8 ≈ 2,8
vqm (O2 )
M He
4 g / mol
3RT
M O2
3
kT
E c ( He) 2
3
=
= ≈ 0,6
Ec (O2 ) 5 kT 5
2
4)
Indica se le seguenti affermazioni sono vere o false, specifica il perché.
a) In una trasformazione adiabatica reversibile la temperatura diminuisce.
L’affermazione è falsa, infatti si ha un raffreddamento nel caso di espansione mentre un
riscaldamento in caso di compressione.
Il primo principio applicato ad un’adiabatica dice infatti che ∆U = − L , quindi quando si ha
un’espansione, cioè L>0 si otterrà ∆U < 0 cioè ∆T < 0 viceversa in una compressione L<0 si
otterrà ∆U > 0 cioè ∆T > 0
b) In una trasformazione isocora, a parità di calore scambiato, una mole di gas biatomico
aumenta la sua temperatura più che in un'isobara.
Q
L’affermazione è vera, infatti da Q = ncx ∆T si ricava ∆T =
poiché per la relazione di Mayer
ncx
cP > cV si deduce che a parità di calore scambiato ∆Tisocora > ∆Tisobara . Il motivo di tale differente
variazione di temperatura sta nel fatto che in un’isobara parte dell’energia assorbita sotto forma di
Verifica di fisica 12 Aprile
3
calore viene utilizzata per compiere lavoro e non per aumentare l’energia interna e quindi la
temperatura.
c) In una trasformazione isoterma il calore scambiato è nullo perché non c'è variazione di
temperatura.
L’affermazione è falsa perché il primo principio ricorda che il calore scambiato da un sistema non
produce necessariamente una variazione di temperatura, ma può anche esser trasformato in lavoro.
Nell’isoterma infatti Q = L , c’è calore scambiato pur non essendoci variazione di temperatura.
Problema
3 moli di gas perfetto monoatomico alla pressione P=1 atm occupano un volume V=40 dm3. Il gas
descrive un ciclo termodinamico reversibile costituito da:
un’espansione adiabatica che ne raddoppia il volume,
una compressione isoterma che lo riporta al volume iniziale
un’isocora
Rappresenta il ciclo in n piano P-V. Determina calore, lavoro e variazione di energia interna in
ciascuna trasformazione. Calcola il lavoro complessivamente compiuto nel ciclo e il calore
assorbito.
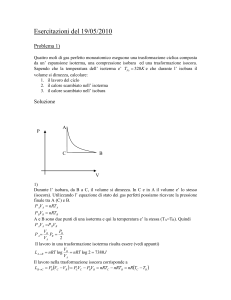
p(atm)
1
n=3 f=3
P (atm)
1
0,3
0,6
A
B
C
V(dm3)
40
80
40
T(K)
162
97
97
A
C
B
Usando l’equazione di stato (ricorda che 1 dm3=1
pV
1atm ⋅ 40 l
l) TA = A A =
= 162 K
atm ⋅ l
nR
3⋅ 0,0821
K ⋅ mol
Dall’equazione di Poisson:
40
80 V(dm3)
γ
V
pV
p AVA = pBVB ⇒ PB = A PA ≈ 0,3 atm e dall’equazione di stato: TB = TC = B B = 97 K
nR
VB
nRTC
Dalla legge di Boyle o dall’equazione di stato: PC =
= 0,6 atm
VC
Si possono quindi calcolare Q, L, ∆U per ogni trasformazione:
f
AB (adiabatica) Q, = 0
∆U = n R∆TAB ≈ −2431 J
L = − ∆U ≈ +2431 J
2
V
BC (isoterma ) ∆U = 0
Q = L = nRTB ln C ≈ −1676 J
VB
f
CA (isocora)
Q = ∆U = n R∆TCA ≈ +2431 J L = 0 Q = L + ∆U ≈ +4051 J
2
Nel ciclo si ha complessivamente:
Ltotale = LAB + LBC + LCA ≈ 755 J (che rappresenta l’area della regione di piano delimitata dal ciclo)
γ
γ
Qassorbito = QCA ≈ 2431 J
Verifica di fisica 12 Aprile
4