€
€
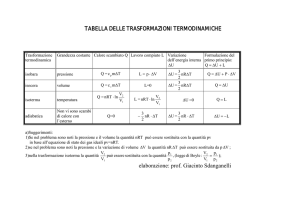
Formulario di Termodinamica • Calore ∂Q
(Calore specifico) mdt
∂Q
(Capacità termica) Ct =
dt
R
(Calore specifico lungo una politropica) C k = CV +
1− k
Cs =
€
€
€
€
€
€
€
• Primo principio della termodinamica Q − L = ΔU (Primo principio) Q = ΔU (Trasformazione isocora) L = −ΔU (Trasformazione adiabatica) Q − L = 0 (Trasformazione isoterma) ΔU = nC v ΔT • Secondo principio della termodinamica ed Entropia €
L
η = (Rendimento di una macchina termica ‐ 1) Qc
| Qf |
η = 1−
| Qc | (Rendimento di una macchina termica – 2) €
€
€
€
€
€
€
€
€
Tf
η = 1− (Rendimento di una macchina di Carnot) Tc
| Qf |
COP =
| L | (Coefficiente di prestazione – 1) | Qf |
COP =
| Qc | − | Qc | (Coefficiente di prestazione – 2) Tf
COP =
Tc − T f
(COP di una macchina di Carnot) | Qf |
Tf
1−
≤ 1− (Teorema di Carnot) | Qc |
Tc
n
Qi
∑ T ≤ 0 (Disuguaglianza di Clausius) i=1
i
B
∫
A
δQ
= S(B) − S(A) = ΔS (Definizione di Entropia) T
V f
ΔS = nR ln (Variazione di entropia lungo un’isoterma) Vi
Tf
ΔS = nc v ln (Variazione di entropia lungo un’isocora) Ti
Tf
ΔS = nc p ln (Variazione di entropia lungo un’isobara) Ti
• Lavoro V f
L = nRT ln (Trasformazione isoterma) Vi
€
€
€
€
L = PΔV (Trasformazione isobara) L = 0 (Trasformazione isocora) 1
L=
(Pf V f − Pi Vi ) (Trasformazione politropica) k −1
• Calore Q = mcΔT (Calore scambiato da una generica sostanza) Q = nc v ΔT (Trasformazione isocora) €
Q = nc p ΔT (Trasformazione isobara) €
V f
Q = nRT ln (Trasformazione isoterma) Vi
€
• Leggi dei gas perfetti €
€
€
€
PV = nRT (Equazione di stato dei gas perfetti) PV = c (Legge di Boyle) V
V = 0 T (Prima legge di Gay ‐ Lussac) T0
P=
P0
T (Seconda legge di Gay ‐ Lussac) T0
PV γ = c (Trasformazione adiabatica) PV k = c (Trasformazione politropica) €
€
• Altro €
a
P + 2 (V − b) = nRT (Equazione di Van Der Waals: gas reali)
V
Cp
γ = CV
€
C P = CV + R o Per un gas monoatomico €
3
5
5
CV = R C P = R γ = 2
2
3
€
o Per un gas biatomico €
5
7
7
CV = R C P = R γ = €2
€ 2
5
J
cal
dm 3 ⋅ atm
R = 8, 31451
= 1,98722
= 0,0820578
mol ⋅ K
mol ⋅ K
mol ⋅ K
€ €
€
1J = 0,239cal
1cal = 4,18J
1atm = 1, 013 ×10 5 Pa = 1, 013bar = 760mmHg 1l = 1dm 3 = 10 −3 m 3