Farmacologia
Anestetici
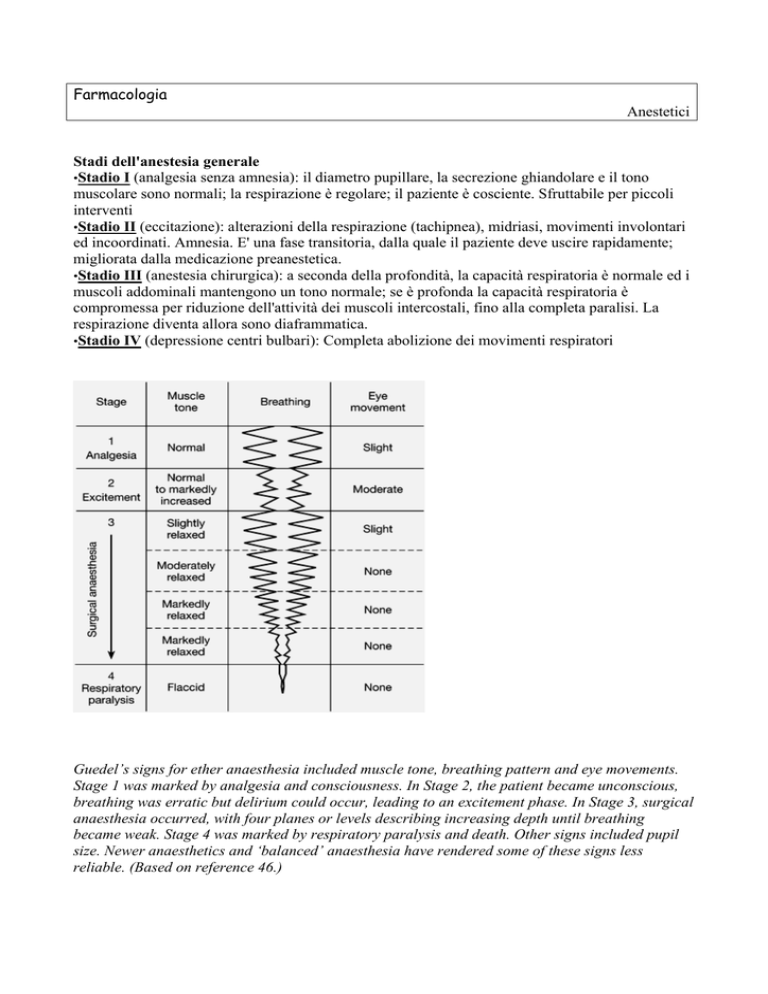
Stadi dell'anestesia generale
•Stadio I (analgesia senza amnesia): il diametro pupillare, la secrezione ghiandolare e il tono
muscolare sono normali; la respirazione è regolare; il paziente è cosciente. Sfruttabile per piccoli
interventi
•Stadio II (eccitazione): alterazioni della respirazione (tachipnea), midriasi, movimenti involontari
ed incoordinati. Amnesia. E' una fase transitoria, dalla quale il paziente deve uscire rapidamente;
migliorata dalla medicazione preanestetica.
•Stadio III (anestesia chirurgica): a seconda della profondità, la capacità respiratoria è normale ed i
muscoli addominali mantengono un tono normale; se è profonda la capacità respiratoria è
compromessa per riduzione dell'attività dei muscoli intercostali, fino alla completa paralisi. La
respirazione diventa allora sono diaframmatica.
•Stadio IV (depressione centri bulbari): Completa abolizione dei movimenti respiratori
Guedel’s signs for ether anaesthesia included muscle tone, breathing pattern and eye movements.
Stage 1 was marked by analgesia and consciousness. In Stage 2, the patient became unconscious,
breathing was erratic but delirium could occur, leading to an excitement phase. In Stage 3, surgical
anaesthesia occurred, with four planes or levels describing increasing depth until breathing
became weak. Stage 4 was marked by respiratory paralysis and death. Other signs included pupil
size. Newer anaesthetics and ‘balanced’ anaesthesia have rendered some of these signs less
reliable. (Based on reference 46.)
Un anestetico ideale
•Stabile, non infiammabile e non esplosivo quando miscelato con l’aria, ossigeno o il protossido
d’azoto;
•Potente, usabile a bassa concentrazione;
•Rapida e gradevole insorgenza dell'anestesia e pronta reversibilità degli effetti;
•Facile somministrazione ed agevole controllo in rapporto alla profondità dell'anestesia;
•Nessuna o scarse interferenze con le funzioni fisiologiche;
•Alto indice terapeutico;
•Assenza di effetti tossici e non irritante per le vie respiratorie.
Anestetici inalatori:
•gassosi (protossido di azoto);
•volatili (alotano, enflurano, isoflurano)
Meccanismo d'azione:
•La potenza anestetica si correla alla loro lipofilia e per questo più che ad un sito specifico dei
differenti recettori, sembrano interagire con zone aspecifiche, forse di contatto, fra proteine di
membrana e fosfolipidi
•Sembrano modificare proteine recettoriali di neurotrasmettitori eccitatori e inibitori (GABAA ?),
modificandone la risposta agli agonisti (potenziamento e inibizione).
Effetti collaterali
•Inotropismo negativo e sensibilizzazione agli effetti delle catecolamine (soprattutto alotano);
•Depressione centro respiratorio;
•Riduzione del flusso ematico epatico e renale;
•Rilassamento muscolatura scheletrica;
•Stimolazione della CTZ
Anestetici endovenosi:
•GABAA-ergici (midazolam, lorazepam, tiopentale, propofol)
•Altri recettori del SNC: glutammatergici (ketamina); oppioidi (fentanil, remifentanil);
dopaminergici (droperidolo).
Meccanismo d’azione delle BZP
e di altri farmaci agonisti del GABAAR
•L’iperpolarizzazione della membrana postsinaptica diminuisce l’eccitabilità cellulare
determinando una ridotta liberazione di neurotrasmettitori (= ↓ degli input sensoriali,
dell’attivazione circuiti neuronali, etc.):
•Sedazione;
•Riduzione dell’ansia;
•Induzione del sonno;
•Attività anticonvulsivante.
Midazolam
•Usato comunemente nella premedicazione anestetica; nell’induzione dell’anestesia e nelle Unità di
terapia Intensiva
•Può essere anche somministrato i.m.
•Emivita = 2 h
•La dose …………….
Midazolam: effetti collaterali
Avramov et al., Anesthesiology 85:1283-1289 , 1996
Tiopentale (pentothal)
• GABA
R
S
H
O
N
R
N
R
O
Barbiturici
Tiopentale
•Nell’induzione dell’anestesia: 3-5mg/kg che può essere ridotta fino al 50% se si usa
benzodiazepine, oppioidi o alpha2-agonisti nella medicazione preanestetica.
•Effetti collaterali: riduzione metabolismo cerebrale con diminuzione del consumo di O2,
diminuzione della p.a. per venodila-tazione e tachicardia riflessa, depressione del centro respiratorio
fino a apnea.
Propofol
•Somministrazione e.v. (1% in emulsione)
•La preparazione è molto soggetta a contaminazione batterica
• Effetti collaterali: riduzione metabolismo cerebrale con diminuzione del consumo di O2,
diminuzione della p.a. per venodila-tazione e tachicardia riflessa, depressione del centro respiratorio
fino a apnea.
Effetti collaterali
•Inotropismo negativo (escluso ketamina);
•Tachicardia (ketamina);
•Depressione centro respiratorio (molto accentuata con fentanil e remifentanil)
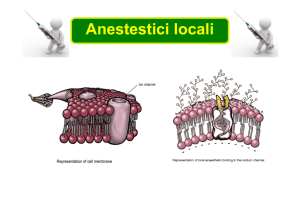
Anestetici locali
•Bloccano o riducono la generazione e la propagazione del potenziale d'azione lungo la membrana
eccitabile neuronale. Ciò si ottiene per stabilizzazione del canale del sodio in una conformazione
chiusa; il blocco selettivo dei canali del sodio è voltaggio-dipendente ed è tanto più efficace quanto
più elevata è la frequenza di stimolazione della fibra nervosa (blocco uso-dipendente).
Struttura del canale del sodio
•Come in tutti i canali voltaggio-dipendenti, si può identificare una struttura voltaggio-sensibile e
una struttura operante la inattivazione del canale
•Il blocco si ottiene sia sulle fibre sensitive che su quelle motorie, ma le fibre amieliniche (sensitive
dolorifiche) sono le più sensibili (seguono quelle del freddo, caldo, tattili, pressorie ed infine
motorie).
•Il blocco della generazione e della conduzione del potenziale d’azione si ottiene per
stabilizzazione del canale del sodio in una conformazione chiusa; il blocco selettivo dei canali del
sodio è voltaggio-dipendente ed è tanto più efficace quanto più elevata è la frequenza di
stimolazione della fibra nervosa (blocco uso-dipendente).
Locai anaesthetics reduce firing frequency in small dorsal root ganglia neurones
•. (A) Trains of tetrodotoxin (TTX)-resistant action potentials elicited by a 750 ms 400 pA current
stimulus are reduced in firing frequency by increasing concentrations of lidocaine. (B) Similar
effects as in (A) seen with bupivacaine in another neurone. Extracellular solution in bath
containing TTX 200 nM; high KI in pipette; 22–23°C.
Anestetici locali
•Esteri: Cocaina, procaina, benzocaina;
•Amidici: Lidocaina, bupivacaina
•Gli esteri sono metabolizzati da esterasi plasmatiche (psuedocolinoesterasi),
•le amidi a livello epatico.
•Il metabolismo (e quindi la scomparsa dell’effetto anestetico) e la tossicità sono influenzate dalla
rapidità con la quale l’anestetico raggiunge il circolo sistemico.
•In associazione con
-agonisti (adrenalina, fenilefrina)
Effetti collaterali:
•Centrali: brividi, tremori, fino a convulsioni e spasmi della glottide;
•Periferici: (cuore) effetto inotropo negativo, riduzione della velocità di conduzione con blocco
atrio-ventricolare;
•Periferici: (circolazione) ipotensione e collasso cardiocircolatorio.
Medicazione preanestetica
Obiettivi:
•Sedazione e amnesia (benzodiazepine, morfina, scopolamina);
•Inibizione degli effetti mediati dal vago (aumento delle secrezioni –salivari, bronchiali, gastriche;
bradicardia, aumento dei movimenti peristaltici; atropina e scopolamina)
Altri farmaci usati durante l'anestesia:
•Miorilassanti: Curari naturali e di sintesi (competitivi)
•Effetto: blocco della trasmissione colinergica a livello della placca neuromuscolare (recettori
nicotinici) con conseguenza paralisi flaccida.
Organizzazione placca motrice
ACh
AChE
(≈104s)
Vescicole ACh
(≈ 5000 molecole)
AChN2R
AChN2Recettore-canale per il sodio. Il legame (0.5ms) apre il canale e
determina una depolarizzazione della membrana muscolare postsinaptica
con conseguenza aumento Ca2+ nel citosol e contrazione
Curari naturali:
•Antagonisti competitivi del recettori nicotinico (N2) della placca neuromuscolare: d-tubocurarina,
pancuronio, atracurium, mivacurium. (L'azione paralizzante inizia dai muscoli oculari e delle mani,
gli ultimi sono i muscoli intercostali e diaframmatici).
+
(CH3)3N_CH2CH2OCOCH3
Curari
•Onset: 5 min (2 min - mivacurium); durata da 15 min (mivacurium) fino a 60 min (pancuronio)
•Un azoto quaternario rende le molecole polari (non passano la barriera ematoencefalica)
•Mivacurium: metabolizzato dalle esterasi plasmatiche
Proprietà farmacocinetiche di curari
competitivi
Molecola
“onset”
(min) *
Durata
(min)
Eliminazione
e metabol.
Tubocurarina
4-6
80-120
Rene, fegato
Pancuronio
4-6
120-180
Rene
Vecuronio
2-4
60-90
Fegato, rene
Atracurio
2-4
30-60
Pl.ester, rene
Mivacurio
1-2
15-20
Plasma ester
* 90% riduzione twitch muscolare
Curari: indicazioni terapeutiche
•Miorilassamento negli interventi chirurgici;
•Per facilitare la ventilazione meccanica (medicina intensiva: tetano, crisi epilettiche gravi, crisi
asmatiche, ecc.)
Effetti collaterali:
•Blocco dei recettori nicotinici (N1) a livello gangliare (d-tubocurarina) e dei recettori muscarinici
cardiaci (pancuronio);
•Possono provocare release di istamina (broncospasmo, ipotensione, aumento secrezioni salivari e
bronchiali);
•In associazione con gli anestetici, possono scatenare una crisi di ipertermia maligna
•Antidoti: essendo antagonisti "competitivi" l'aumento dell'agonista ne riduce l'azione
(anticolinoesterasici reversibili neostigmina in associazione con atropina)
Curari depolarizzanti
•Succinilcolina (suxametonio) = agonista nicotinico che depolarizza persistentemente la fibra
muscolare e quindi la desensibilizza alla successiva attivazione da parte dell'ACh.
•L’”onset” della succinilcolina è rapido (1 min), la durata ultrabreve (5-10 min).
•La succinilcolina è degradata da pseudocolino-esterasi quali la butirrocolinaesterasi (enzimi
plasmatici) Soggetti carenti geneticamente dell'enzima = apnea da sovradosaggio e tachicardia
•L'azione è sinergizzata da anticolinoesterasici.
•In anestesia, in associazione con alotano alcuni casi di ipertermia maligna (malattia genetica con
modificazione del recettore della ryanodina)
+
(CH3)3N_CH2CH2OCOCH3
Berchtold et al., Physiol. Rev. 80: 1215-1265, 2000
Mechanisms for the development of malignant hyperthermia (MH).
•Part of a muscle fiber (longitudinal section) is shown, with sarcolemma, sarcoplasmic reticulum
(SR), and mitochondria as shown in Figure 4. In addition, a transverse tubule (TT) system with the
L-type Ca2+ channel consisting of 4 subunits ( 1, 2/ , , ) and the ryanodine receptor (RyR) are
shown. Mutations in the RyR (1) or the 1-subunit of the Ca2+ channel (2) are responsible for the
susceptibility for MH (MHS1, MHS5). The application of certain anesthetics during general
anesthesia can lead to excessive Ca2+ release from the SR. If the Ca2+ control mechanisms cannot
compensate for the release, the excess of cytoplasmic Ca2+ causes sustained muscle contraction
and rigidity, increased energy production and consumption, as well as ADP, CO2, and heat
production. Finally, the activation of degradative enzymes leads to membrane damage and cell
death. Brody's disease (3) is caused by mutations in SERCA1, which can lead to a complete loss of
SERCA1 function. The disease is characterized by slowing muscle relaxation.
Ipertermia Maligna
•Modificazione su base genetica del recettore RYR1 (muscolo scheletrico) o del canale al calcio
voltaggio dipendente di tipo L. Si conoscono almeno 20 mutazioni (anche puntiformi) del gene che
codifica il recettore RYR1 responsabili della malattia.
•La maggior parte dei pazienti affetti non manifesta segni clinici dell’alterazione genetica in
assenza della somministrazione di anestetici
•La diagnosi dopo biopsia del muscolo scheletrico (funzionale) può diagnosticare l’alterazione
genetica.
•L’incidenza di ipertermia maligna fulminante è stimata tra 1 / 14.000 nella popolazione pediatrica
e 1 / 50.000 in quella adulta.
•E’ un evento potenzialmente fatale (70% dei casi non trattati), dovuto alla somministrazione di
alcuni anestetici (soprattutto alotano ed altri anestetici volatili alogenati) in associazione con
bloccanti neuromuscolari.
•Si manifesta nel corso dell’anestesia con contrattura muscolare, rigidità e produzione di calore da
parte dei muscoli scheletrici che determina ipertermia severa, aumento del metabolismo muscolare,
acidosi metabolica e tachicardia. Il primo sintomo è un aumento della CO2 alla fine dell’espirazione
ed in alcuni casi rigidità del massetere.
•Sintomi postumi comprendono iperkaliemia, ipocalcemia, rabdomiolisi con aumento della
creatinin kinasi serica e mioglobinuria, coagulazione intravascolare disseminata, convulsioni,
edema cerebrale ed edema polmonare acuto.
•Il trattamento farmacologico comprende iperventilazione con O2 e somministrazione di dantrolene.
•Può essere necessario disperdere il calore raffreddando il paziente, l’uso di antiaritmici
(procainamide) ed il controllo dell’acidosi metabolica.
Dantrolene
•La molecola inibisce il rilascio di calcio dal reticolo sarcoplasmatico, legandosi selettivamente al
recettore RYR1.
•Dosi: da 1 mg/kg fino a 10 mg/kg per via endovenosa nelle emergenze anestesiologiche.
•Con l’introduzione del dantrolene nel trattamento della MH, la mortalità nei soggetti predisposti è
diminuita dal 70 al 5% dei soggetti.
Altre sindromi su base genetica indotte da bloccanti neuromuscolari
•La succinilcolina negli individui geneticamente predisposti può indurre rigidità del m. massetere
con difficoltà nell’inserzione del tubo endotracheale.
•Questa sindrome sembra correlata ad una alterazione di una subunità del canale del sodio
voltaggio-dipendente.