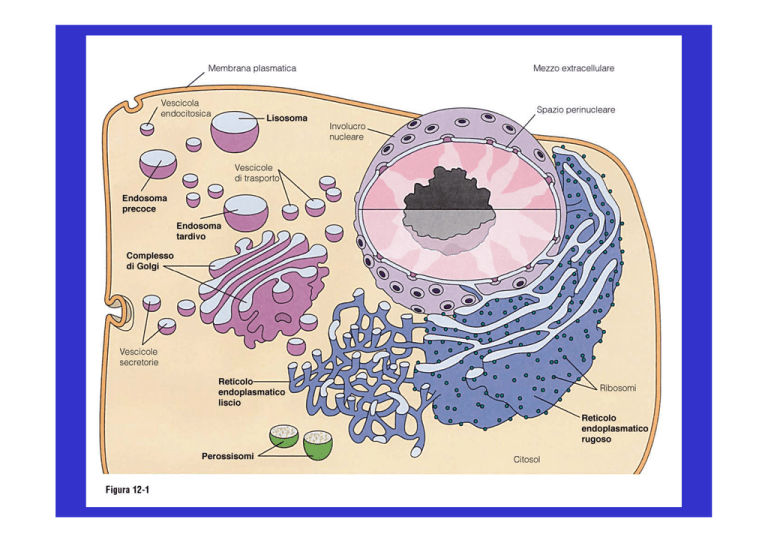
I trasportatori citoplasmatici sono vescicole di trasporto
Via biosintetica o via secretoria
(secr. regolata, secr. costitutiva)
Via endocitica
ALCUNI APPROCCI ALLO STUDIO DELLE
ENDOMEMBRANE:
autoradiografia (George Palade)
analisi biochimica delle frazioni subcellulari (C. De
Duve, A. Claude)
uso di sistemi acellulari
uso di mutanti
L’autoradiografia permette di determinare la
posizione del materiale marcato radioattivamente
all’interno della cellula. Con questa tecnica le sezioni
di tessuto che contengono gli isotopi radioattivi sono
ricoperte con uno strato sottile di emulsione
fotografica che è esposta alle radiazioni che emanano
dal tessuto. I siti nelle cellule che contengono la
radioattività sono rivelati al microscopio dai grani di
argento, dopo lo sviluppo dell’emulsione radiografica
sovrapposta.
Cellula acinosa di pancreas
incubata per 3 min con aa
radioattivi
Analisi biochimica delle frazioni subcellulari (C. De Duve, A. Claude)
USO DEI SISTEMI ACELLULARI
Questi studi permisero di capire che la
membrana microsomale rugosa non serviva ad
incorporare gli aa ma a sequestrare le proteine
di secrezione appena sintetizzate all’interno
delle cisterne del reticolo.
USO DI MUTANTI Identificazione per geni che codificano per SEC
Mutante per il gene sec12
Mutante per il gene sec17
I ricercatori hanno isolato una dozzina di mutanti
differenti che, nell’insieme, mostrano interruzioni in
ogni tappa nel percorso secretorio. Molti dei geni
responsabili di questi difetti sono stati clonati e
sequenziati e le proteine da essi codificate sono state
isolate. L’isolamento delle proteine dal lievito ha
permesso la ricerca di proteine omologhe nei
mammiferi (cioè proteine con sequenze correlate).
Le attività dinamiche dei componenti del sistema delle
endomembrane sono altamente conservate. Non solo il
lievito, le piante e le cellule umane usano processi simili,
ma utilizzano anche proteine notevolmente simili. In
molti casi, proteine da specie ampiamente divergenti
sono intercambiabili.
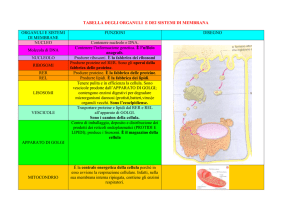
RETICOLO ENDOPLASMATICO
Reticolo “sistema”, Endoplasmatico “dentro il plasma”
Rappresenta il 50-90% della totalità delle membrane di una cellula di mammifero
Fu osservato per la prima volta verso la fine del 19°sec come regione che si
colorava intensamente con coloranti basici (ergastoplasma)
Solo nel 1950 con l’uso della ME si riuscì a capire la struttura e il ruolo del RE
Differiscono nella struttura e nella funzione, nonostante siano interconnessi
Nella cellula esiste una consistente variazione delle quantità relative
Reticolo endoplasmatico rugoso
RER : sito di sintesi di proteine di secrezione
Cellule del pancreas
Cellule caliciformi dell’intestino
Cellule endocrine
Plasmacellule
Alcuni polipeptidi sono sintetizzati sui ribosomi attaccati al RER:
(Meccanismo co-traduzionale)
proteine secrete dalla cellula, proteine integrali di membrana, proteine
che risiedono nei compartimenti delle endomembrane e in lisosomi,
endosomi e vescicole
Altri polipeptidi sono sintetizzati sui ribosomi “liberi”:
(Meccanismo post-traduzionale)
proteine destinate a rimanere nel citosol (es.enzimi, proteine del
citoscheletro),
proteine destinate a nucleo, perossisomi, cloroplasti, mitocondri.
IMPORTAZIONE CO-TRADUZIONALE= trasferimento di
polipeptidi nel RE. Il movimento dei polipeptidi attraverso o
all’interno della membrana del RE è accoppiato al processo
traduzionale.
IMPORTAZIONE POST-TRADUZIONALE I ribosomi che
sintetizzano polipeptidi destinati al citosol o ai mitocondri,
cloroplasti, perossisomi, nucleo, rimangono liberi nel citosol.
Dopo che la traduzione è stata completata, i polipeptidi sono
rilasciati nel citosol e da qui seguono le diverse destinazioni.
Ipotesi del segnale G. Blobel
Nobel per la Medicina 1999
Sintesi di proteine secretorie e lisosomali sui ribosomi legati al RER
SRP= particella di riconoscimento del segnale (“etichetta”). Nelle cellule
dei mammiferi consiste in 6 distinti polipeptidi e una piccola molecola di
RNA 7S.
Come una proteina neo-sintetizzata viene processata nel
RE
Appena un polipeptide nascente entra nelle cisterne del
RER si trova ad interagire con una moltitudine di
enzimi localizzati sia nella membrana che nel lume del
RER: 1) peptidasi del segnale rimuove la porzione Nterminale contenente il peptide segnale; 2)
oligosaccariltrasferasi aggiuge carboidrati; 3) proteine
chaperon (BiP, Disolfuroisomerasi) riconoscono e si
legano alle proteine non ripiegate o ripiegate male e
danno loro l’opportunità di assumere la corretta
struttura tridimensionale.
Sintesi di proteine integrali di membrana sui ribosomi legati al RER
Glicosilazione nel RER
Quasi tutte le proteine prodotte sui ribosomi
legati al RER diventano glicoproteine. Il
processo di glicosilazione inizia nel RE e si
completa nel complesso del Golgi.
I gruppi carboidratici hanno un ruolo chiave
nella funzionalità delle glicoproteine, in
particolare come siti di interazione con altre
macromolecole.
Essi inoltre aiutano le proteine a ripiegarsi
correttamente
N-glicosilazione: implica l’aggiunta di una
specifica unità oligosaccaridica al gruppo
di
residui
di
ammino-terminale
asparagina.
Il dolicolo fosfato è il
trasportatore
delle
unità
oligosaccaridiche da trasferire
all’asparagina
durante
la
glicosilazione
del
core
oligosaccaridico
Oligosaccaril transferasi
Negli eucarioti meno evoluti, gli oligosaccaridi
rimangono così come sono stati appena sintetizzati.
L’evoluzione degli organismi più complessi è stata
accompagnata dalla diversificazione dei carboidrati
uniti alle proteine.
La modifica dell’oligosaccaride di base inizia nel RE
con la rimozione di due delle tre unità di glucosio da
parte di una glucosidasi
Controllo di qualità
(calreticulina)
Risposta alle proteine non ripiegate
(Unfolded Protein Response, UPR )
1) Sintesi di proteine capaci di
contrastare lo stress:
- Chaperoni che aiutano le proteine
anormali
- Proteine che trasportano le proteine
anormali al di fuori del RE
- Proteine coinvolte nella distruzione di
proteine anormali
2) Fosforilazione di eIF2α, per
rallentare la sintesi proteica
Malattie da ripiegamento errato delle proteine
Encefalopatia spongiforme (Morbo della “mucca pazza” nei bovini)
malattia trasmessa da agenti infettivi proteici detti prioni
La proteina risultante, ripiegata in modo non corretto, induce estesi danni ai neuroni
cerebrali, portando a movimenti muscolari incontrollati e alla morte.