catene idrofobiche
fase acquosa
testa polare
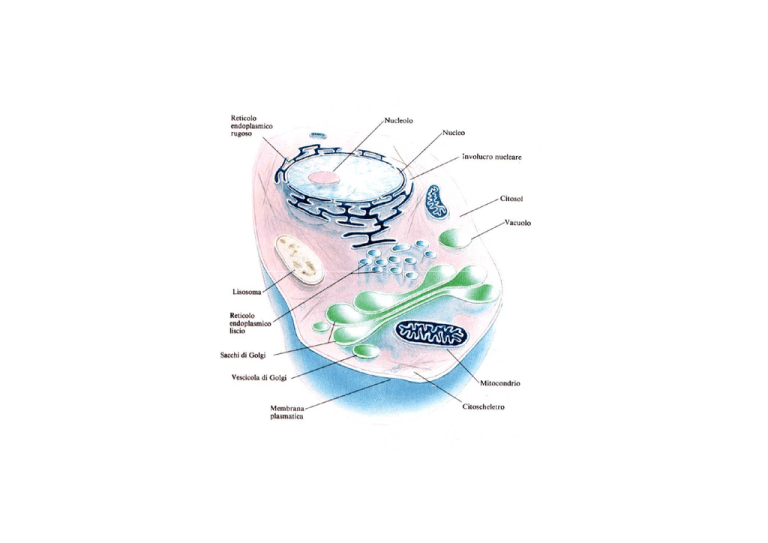
Dimensioni della cellula e delle strutture cellulari
cellula eucariota
25 µm
nucleo
5 µm
mitocondrio
1 µm
ribosoma
25 nm
emoglobina
6.4 nm
membrana plasmatica (diam.) 5 nm
DNA (larghezza)
2.4 nm
amminoacido
~ 1 nm
H20
0.4 nm
1 µm = 10-6 m
1 nm = 10-9 m
Costituenti chimici delle cellule
costituente
H20
Ioni inorganici:
Na+, K+, SO42-,
HCO3-, Ca2+, Mg2+...
Piccole molecole organiche:
carboidrati, amminoacidi
lipidi, nucleotidi
Macromolecole:
proteine, polisaccaridi
acidi nucleici
peso atomico o molecolare
18
23-100
100-700
50 x 103 - 1 x 109
Bioelementi
C
H
O
N
P
S
Na
K
Mg
Ca
Cl
Fe
Cu
Zn
Mn
Co
I
Mo
Se
Elementi più abbondanti nel corpo umano
(% del numero totale di atomi)
H
O
C
N
Ca
P
Cl
K
63
25.5
9.5
1.4
0.31
0.22
0.08
0.06
Le funzioni biologiche di alcuni elementi
Fe
Cu
Co
Se
I
Trasportatore di elettroni nelle reazioni di ossidoriduzione
Trasporto di O2 da parte dell’emoglobina
Componente di ossidasi mitocondriali
Componente della vitamina B12
Componente dell’enzima glutatione reduttasi
Componente degli ormoni tiroidei
Mn, Zn, Mo, V, Ni, Mg
Cofattori di enzimi
protone
neutrone
elettrone
+
1,673 x 10-24
1,675 x 10-24
massa (grammi)
+ 1,602 x 10-19
0
carica elettrica (Coulomb)
9,110 x 10-28
-1,602 x 10-19
principali particelle atomiche
particella
massa (g)
massa (uma)
carica
(coulomb)
protone
1,673 ⋅ 10-24
1
+1,6 ⋅ 10-19
neutrone
1,675 ⋅ 10-24
1
0
nucleo
elettrone
9,11 ⋅ 10-28
0
-1,6 ⋅ 10-19
10-12 cm
elettroni
dimensioni atomiche
10-8 cm
Teoria quantistica
Gli elettroni sono cariche elettriche
puntiformi ruotanti attorno al nucleo
su orbite definite per forma ed energia.
Teoria ondulatoria
Non è possibile definire la posizione
esatta dell’elettrone attorno al nucleo
ma si deve considerare la probabilità che
l’elettrone si trovi in una determinata
regione di spazio attorno al nucleo.
53 pm
53 pm
l’orbitale
rappresenta
la zona
dello spazio
in cui è
massima
la probabilità
di trovare
l’elettrone
probabilità
probabilità
l’orbita
rappresenta
il moto
dell’elettrone
attorno
al nucleo
...... . ..
.
.
.
.
... ........................................................ ..
.
............................
............................. .......
.
....................
..............................
..................
.... .....................
...................
.
.
.
.
.
.
....
. ........
..
..........
..........................
..
.
.
.............
.
.. ..........
.
.
.
.
.
.............
.
.
.. ....................
..
.
.
.
... .................
.. ............
.
.
.
.
........
........................... . .. . ................................
. ...........
..............................................................
..........
... ...
..........
.....
distanza dal nucleo
distanza dal nucleo
La regione di spazio attorno al nucleo
dove è probabile trovare l’elettrone è
definita da una funzione matematica
chiamata
orbitale
gli orbitali si rappresentano
graficamente come zone di carica
attorno al nucleo dove è più elevata la
probabilità di trovare l’elettrone
l’elettrone..
Nelle equazioni che definiscono forma ed energia degli orbitali sono
contenuti coefficienti numerici che possono assumere soltanto valori
discreti. Questi coefficienti sono chiamati numeri quantici
• n: numero quantico principale
• l: numero quantico secondario
• m: numero quantico magnetico
I numeri quantici possono assumere solamente i valori che
rispettano le seguenti regole:
n = 1, 2, 3, 4, …n
n -l
l = 0, … nm = 0, …...±
…...± l
numero
quantico
l
n
principale secondario
1, 2, 3, …∞
∞ 0 ÷ n -1
m
magnetico
-l ÷ +l
n°massimo
di elettroni
-3 -2 -1 0 +1 +2 +3
4
3
2
1
3
4f
14
2
4d
10
1
4p
6
0
4s
2
2
3d
10
1
3p
6
0
3s
2
1
2p
6
0
2s
2
0
1s
2
tipo
di orbitale
z
y
x
l'orbitale s
Si costruiscono idealmente gli atomi disponendo
nel nucleo i protoni e disponendo negli orbitali un
ugual numero di elettroni, questo processo viene
chiamato Aufbau che prevede che siano rispettate
queste Regole:
l'elettrone occupa l'orbitale a più bassa energia
disponibile
ciascun orbitale può contenere al massimo due
elettroni hanno spin antiparallelo.
in caso di orbitali con la stessa energia vale il
principio della massima molteplicità, vengono cioè
occupati il maggior numero possibile di orbitali
NUMERO ATOMICO Z
Numero di protoni contenuti nel nucleo
Il numero atomico identifica un elemento
NUMERO DI MASSA A
Numero di protoni + neutroni contenuti nel
nucleo
L'idrogeno è l'atomo che contiene nel nucleo
un solo protone
L'unico elettrone dell'atomo di idrogeno
può occupare uno degli orbitali
disponibili
Z=1
simbolo:
elemento: idrogeno
Configurazione elettronica : 1s
n
1
2
3
4
5
l
0
1
2
3
H
Z=2
elemento:
simbolo:
elio
Configurazione elettronica : 1s2
n
1
2
3
4
5
l
0
1
2
3
He
Z=3
simbolo:
elemento: litio
Configurazione elettronica : 1s2,
n
1
2
3
4
5
2s
l
0
1
2
3
Li
Z=4
simbolo:
elemento: berillio
Configurazione elettronica : 1s2,
n
1
2
3
4
5
2s2
l
0
1
2
3
Be
8s
7s
7p
6s
6p
6d
5s
5p
5d
5f
4s
4p
4d
4f
3s
3p
3d
2s
2p
1s
Z=5
simbolo:
elemento: boro
Configurazione elettronica : 1s2,
n
1
2
3
4
5
2s2px
l
0
1
2
3
B
Z=6
simbolo:
elemento: carbonio
Configurazione elettronica : 1s2,
n
1
2
3
4
5
2s2pxpy
l
0
1
2
3
C
Z=7
simbolo:
elemento: azoto
Configurazione elettronica : 1s2,
n
1
2
3
4
5
2s2pxpypz
l
0
1
2
N
3
Z=8
simbolo:
elemento: ossigeno
Configurazione elettronica : 1s2,
n
1
2
3
4
5
2s2px2pypz
l
0
1
2
O
3
la successione degli orbitali
energia
5s
4p
3d
4s
3p
3s
2p
2s
1s
6s ... ... ...
5s 5p 5d 5f ...
4s 4p 4d 4f
3s 3p 3d
2s 2p
1s
orbitale
numero
atomico
elemento
nome
configurazione elettronica
1s
1
2
H
He
Idrogeno
Elio
1s1
1s2
2s
3
4
Li
Be
Litio
Berillio
[He] 2s1
___ 2s2
2p
5
6
7
8
9
10
B
C
N
O
F
Ne
Boro
Carbonio
Azoto
Ossigeno
Fluoro
Neon
___
___
___
___
___
___
3s
11
12
Na
Mg
Sodio
Magnesio
[Ne] 3s1
___ 3s2
3p
13
14
15
16
17
18
Al
Si
P
S
Cl
Ar
Alluminio
Silicio
Fosforo
Zolfo
Cloro
Argon
___
___
___
___
___
___
2s2 2p1
2s2 2p2
2s2 2p3
2s2 2p4
2s2 2p5
2s2 2p6
3s2 3p1
3s2 3p2
3s2 3p3
3s2 3p4
3s2 3p5
3s2 3p6
1°
Gruppi
2°
3°
5°
6°
7°
8°
1
2
H
He
4
Li Be
5
6
7
8
9
10
B
C
N
O
F
Ne
11
13
14
15
16
17
18
Al
Si
P
S
Cl Ar
3
Periodi
4°
12
Elementi di Transizione
Na Mg
24
25
26
27
28
29
30
V
31 32 33 34 35 36
Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
41
42
43
44
45
46
47
48
19
20
21
22
23
K
Ca Sc
Ti
37
38
39
40
Rb
S
Y
Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te
49
50
51
52
53
54
I
Xe
I
VIII
1
H
2
He
1s
II
III IV
3
Li
4
Be
5
B
6
C
7
N
8
O
9
F
10
Ne
2s
2s2
2s2p
2s2p2
2s2p3
2s2p4
2s2p5
2s2p6
11
Na
12
Mg
13
Al
14
Si
15
P
16
S
17
Cl
18
Ar
3s
3s2
3s2p
3s2p2
3s2p3
3s2p4
3s2p5
3s2p6
19
K
20
Ca
21
Sc
22
Ti
23
V
24
Cr
25
Mn
26
Fe
27
Co
28
Ni
29
Cu
30
Zn
31
Ga
32
Ge
33
As
34
Se
35
Br
36
Kr
4s
4s2
3d,4s2
3d2,4s2
3d3,4s2
3d5,4s
3d5,4s2
3d6,4s2
3d7,4s2
3d8,4s2
3d10,4s
3d10,4s2
4s22p
4s22p22
4s22p33
4s22p44
37
Rb
38
Sr
39
Y
40
Zr
41
Nb
42
Mo
43
Tc
44
Ru
45
Rh
46
Pd
47
Ag
48
Cd
49
In
50
Sn
51
Sb
52
Te
53
I
54
Xe
5s
5s2
4d,5s2
4d2,5s2
4d3,5s2
4d5,5s
4d5,5s2
4d6,5s2
4d7,5s2
4d8,5s2
4d10,5s
4d10,5s2
5s2p
5s2p2
5s2p3
5s2p4
5s2p5
5s2p6
55
Cs
56
Ba
57
La
72
Hf
73
Ta
74
W
75
Re
76
Os
77
Ir
78
Pt
79
Au
80
Hg
81
Tl
82
Pb
83
Bi
84
Po
85
At
86
Rn
6s
6s2
5d,6s2
5d2,6s2
5d3,6s2
5d5,6s
5d5,6s2
5d6,6s2
5d7,6s2
5d8,6s2
5d10,6s
5d10,6s2
6s2p
6s2p2
6s2p3
6s2p4
6s2p5
6s2p6
87
Fr
88
Ra
89
Ac
[Rn]
[Rn]
[Ra]
7s
7s2
6d
58
Ce2
59
Pr3
60
Nd4
ELEMENTI DI TRANSIZIONE
61
Pm
5
62
Sm
6
4f
5do6s2
4f
5do6s2
4f
5do6s2
4f
5do6s2
4f
5do6s2
90
Th
91
Pa
92
U
93
Np
94
Pu
[Ra]
6d2
[Ra]
5f26d1
[Ra]
5f36d1
[Ra]
5f46do
[Ra]
5f66do
63
Eu7
4f
5do6s2
64
Gd
7
4f
5d16s2
95 96
Am Cm
[Ra]
5f76do
[Ra]
5f96d0
65
Tb9
5d10
66
Dy
10
5d10
67
Ho
11
4f
5do6s2
4f
5do6s2
4f
5do6s2
97
Bk
98
Cf
99
Es
[Ra]
5f96d0
[Ra]
5f106d0
[Ra]
5f116do
V VI VII
5d10
68
Er
12
4f
5do6s2
5d10
69
Tm
13
4f
5do6s2
100 101
Fm Md
[Ra]
5f126do
[Ra]
5f136do
1s2
4s22p55 4s22p66
5d10
70
Yb
14
4f
5do6s2
5d10
71
Lu
14
4f
5d16s2
102 103
No Lw
[Ra]
5f146do
[Ra]
5f146d1
I
H
0
II
III
IV
V
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Ga
Ge
As
Se
Br
Kr
Rb
Sr
In
Sn
Sb
Te
I
Xe
Tl
Pb
Bi
Po
At
Rn
Cs
Ba
VI
VII
He
Gli elementi del I gruppo perdono facilmente un elettrone per
dare cationi monovalenti
Li
Li +
+
Na
Na +
+
K
K+
+
Rb
Rb +
+
Cs
Cs +
+
Gli elementi del II gruppo perdono facilmente due elettroni per
dare cationi bivalenti
Be
Be2+
+ 2
Mg
Mg2+
+ 2
Ca
Ca2+
+ 2
Sr
Sr2+
+ 2
Ba
Ba2+
+ 2
Gli elementi del VII gruppo acquistano facilmente un elettrone
per dare anioni monovalenti
F
+
F
F-
Cl
+
Cl
Cl-
Br
+
Br
Br-
I
+
I
I-
At
+
At
At-
Fra due atomi di idrogeno agiscono forze repulsive ed
attrattive.
a) repulsione fra elettroni
b) repulsione fra nuclei
c) attrazione fra protone ed elettrone di atomi diversi
e-
a
e-
c
+
b
+
energia (KJ / mole)
molecola H2
orbitale 1s
repulsione
+
74
energia
totale
attrazione
H =1s 1s
H•
distanza
internucleare
(pm)
legame σ
H •• H
_
H H
Legame Chimico
Interazione fra due atomi che dà
luogo alla formazione di aggregati
stabili (molecole).
Due atomi formano un legame
covalente quando mettono in
compartecipazione una coppia
di elettroni.
Fra i due atomi di idrogeno si è instaurato un legame
covalente omopolare di tipo σ: i due elettroni di legame
sono ugualmente condivisi fra i due atomi.
legame σ
H••H
H
H
Fra due atomi di cloro si stabilisce
un legame covalente.
Ciascun atomo di cloro partecipa alla
formazione del legame con il suo
elettrone spaiato.
Cl + Cl
Cl2
Cl + Cl
Cl
Cl
Fra due atomi di azoto si formano
tre legami covalenti.
N + N
N2
N + N
N
N
σ
π
N
N
Gli elettroni di legame σ sono lungo l’asse
che congiunge i nuclei, mentre gli elettroni di
legame π sono più esterni.
Legame σ
Legame π
L’elettronegatività di un elemento è la tendenza di
questo ad attirare su di sé gli elettroni di legame.
L’elettronegatività è una proprietà dell’elemento che si
manifesta quando esso forma un legame con un altro
atomo.
H
2.1
Li
1.0
Be
1.5
B
2.0
C
2.5
N
3.0
O
3.5
F
4.0
Na
0.9
Mg
1.2
Al
1.5
Si
1.8
P
2.1
S
2.5
Cl
3.0
K
0.8
Ca
1.0
Sc
1.3
Ti
1.5
Y
1.6
Cr
1.6
Mn
1.5
Fe
1.8
Co
1.9
Rb
0.8
Sr
1.0
Y
1.2
Zr
1.4
Nb
1.6
Mo
1.8
Tc
1.9
Ru
2.2
Rh
2.2
Cs
0.7
Ba
0.9
La
1.0
Hf
1.3
Ta
1.5
W
1.7
Re
1.9
Os
2.2
Ir
2.2
Fr
0.7
Ra
0.9
Ac
1.1
Th
1.3
Pa
1.4
U
1.4
Np
1.4
Ni
1.9
Cu
1.9
Zn
1.6
Ga
1.6
Ge
1.8
As
2.0
Se
2.4
Br
2.8
Pd
2.2
Ag
1.9
Cd
1.7
In
1.7
Sn
1.8
Sb
1.9
Te
2.1
I
2.5
Au
2.4
Hg
1.9
Tl
1.8
Pb
1.9
Bi
1.9
Po
2.0
At
2.2
Pt
2.2
Gli angoli di legame sono di circa 105°.
Poiché l’ossigeno è molto più elettronegativo
dell’idrogeno, i legami fra ossigeno ed idrogeno
sono polarizzati.
La molecola dell’acqua è un dipolo.
2δ 104.5°
- 0.82
δ+
+ 0.41
δ+
+ 0.41
δN
H
H
H
δ+
Poiché l’azoto è più elettronegativo dell’idrogeno, i
legami fra azoto ed idrogeno sono polarizzati.
L’atomo di azoto presenta una frazione di carica
negativa, gli atomi di idrogeno presentano una
frazione di carica positiva.
La molecola dell’ammoniaca è un dipolo.
L'ibridazione è un fenomeno chimico per
cui orbitali atomici di forma diversa si
combinano linearmente per creare un
numero identico di nuovi orbitali, tutti uguali
fra loro per forma ed energia, ma diversi da
ciascuno degli orbitali di partenza: per
questa loro caratteristica, i nuovi orbitali
sono detti ibridi
CH4 (metano) - Il Carbonio forma 4 legami
covalenti di tipo σ
promozione
s
ibridazione
p
s
3
sp
C
p
sp3
H
C
H
H
H
H
H C H
H
Il metano è una molecola apolare
C2H6
CH3CH3 etano
Ciascun Carbonio forma 4 legami covalenti di tipo σ
1 con un altro atomo di carbonio e
3 con 3 atomi di idrogeno
H
H C
H
H
C H
H
legame π
Etene C2H4
H
H
C
C
H
H
legami σ
Ogni Carbonio forma tre legami σ e un legame π
Gli elettroni di legame σ sono lungo l’asse che
congiunge i nuclei, mentre gli elettroni di legame π
sono più esterni.
Attorno al doppio legame C-C non può aversi
rotazione.
La molecola dell’etene è planare.
CO2 anidride carbonica
Il Carbonio lega due atomi di ossigeno con
doppio legame, un legame σ ed un legame π
legami π
O
C
O
legami σ
Nonostante la differenza di elettronegatività
esistente fra C e O, la molecola della CO2 non
è polare perché è lineare.
LEGAME DATIVO
O-H
O
S
O
O-H
H2SO4
Acido solforico
O
O
H
P
O
O
H
H
H3PO4
Acido ortofosforico
I due elettroni di legame sono forniti da uno soltanto dei due atomi
Quando l’atomo di H è legato
covalentemente ad un atomo più
elettronegativo assume una frazione
di carica positiva, può quindi formare un
legame elettrostatico, comunemente
chiamato legame idrogeno,
con un altro atomo più elettronegativo
Fra molecole di acqua si formano
legami idrogeno
l’H di una molecola forma un legame idrogeno con
l’O di una seconda molecola.
L’O di una molecola forma due legami idrogeno con
l’H di due molecole.
Complessivamente ogni molecola di acqua forma 4
legami idrogeno con altre 4 molecole di acqua.
legame idrogeno
legame covalente
0.177 nm
0.099 nm
L’energia del legame idrogeno è
di circa 5 Kcal/mole
rispetto ai 110 Kcal/mole
del legame covalente -OH
(1 cal = 4.18 J)
Legami elettrostatici: legame di van der Waal’s
E’ un legame debole che si instaura fra un dipolo
istantaneo, causato da una polarizzazione
temporanea di un legame in una molecola, e un altro
dipolo, indotto dal dipolo istantaneo.
δ+
δ-
dipolo istantaneo
δ+
δdipolo indotto
Legami elettrostatici: legame ionico
-
-
NaCl
-
-
-
Cristallo di NaCl
esempio di legame ioneione-ione
L’acqua possiede inusuali proprietà solventi
Questa proprietà è un riflesso del carattere
dipolare delle molecole dell’acqua e della
capacità dell’acqua di formare legami
idrogeno con le molecole in essa disciolte
Miscele omogenee di due o più
sostanze, composte da solvente e
soluto
Nelle soluzioni acquose il solvente è
l’acqua ed i soluti sono ioni o molecole
in grado di interagire con le molecole
d’acqua
-
Cl-
+
Na+
+
ioni
δ+
H 2O
δ-
-
+
+
+
-
+
+
-
+
-
+
-
-
-
+
+
+
-
+
-
+
-
reticolo cristallino
+
ioni idratati
Soluzione acquosa di NaCl
Ioni circondati
da molecole di acqua
Na+
Cl-
Legami elettrostatici: legame ione-dipolo
CH2OH
O
HO
HO
OH
OH
Anche il glucosio è solubile in acqua, a
causa dei forti legami idrogeno che si
possono contrarre fra l’acqua e i gruppi
ossidrile.
Alcuni esempi di molecole polari
CH2OH
O
CH2OH
H
OH
OH
OH
C
OH
CH2OH
OH
glicerolo
a-D-glucosio
+
H3N
COO
C
-
H
H
glicina
Le molecole apolari non sono solubili in
acqua, ma sono solubili in solventi
organici, come cloroformio o benzene.
Il colesterolo è una molecola apolare
Alcuni esempi di molecole non polari
O
O
CH3(CH2)14
CH2O C
H H
(CH2)7 C
C
(CH2)7 CH3
C O C H
CH2O C
O
un trigliceride
O
CH3(CH2)14
una cera
(CH2)14CH3
C O
H H
(CH2)8 C C
(CH2)7 CH3
Alcuni esempi di molecole anfipatiche
O
O
H H
CH2O C
(CH2)7 C C
C O C H O-
CH3(CH2)14
CH2O C
P
un trigliceride
+
H3N
COO
C
-
O
O
H H
CH3
(CHC2)14C
CH3N CH3
O
CH3
H H
fosfatidilcolina
H
CH2
fenilalanina
(CH2)7 CH3
Unità di concentrazione
- % (p/p; p/v; v/v)
NaCl 0.9% (p/v): 0.9 g di NaCl in 100 ml di soluzione
-Molarità (M)
moli di soluto contenute in un litro di soluzione
moli
M=
V(litri)
Si definisce mole “la quantità di una sostanza che
contiene un numero di molecole pari al numero
di Avogadro (N) ”
N = 6.022 x
23
10
Contiene = 6.022 x 1023 molecole e
corrisponde ad una massa in g pari al peso
molecolare (PM)
H2O (PM =18) 1 mole = 18 g
C6H12O6 (glucosio, PM = 180) 1 mole = 180g
Dire che una soluzione di glucosio è 1M significa che
in un litro di soluzione è disciolta una mole di glucosio.
Glucosio C6H12O6
PM glucosio :
6 x 12 = 7 2+
12 x 1 = 12 +
6 x 16 = 9 6
180
In 1 litro di soluzione sono disciolti 180 g di glucosio
180,0 g
18,0 g
glucosio
acqua
1 mole
1 mole
I soluti modificano le proprietà dell’acqua
• punto di congelamento
• punto di ebollizione
• pressione di vapore
• pressione osmotica
Stati della materia
Le interazioni che possono stabilirsi fra le molecole di una
sostanza ne determinano lo stato fisico.
Se la forza di legame intermolecolare supera le energie cinetiche
possedute dalle molecole, la sostanza si trova allo
stato solido
Se l’energia cinetica posseduta dalle molecole è superiore alla
forza dei legami intermolecolari, la sostanza si trova allo
stato gassoso
Se le due forze si bilanciano la sostanza si trova allo
stato liquido
L’energia cinetica delle molecole aumenta
all’aumentare della temperatura
Lo stato fisico di una sostanza dipende
quindi dalla temperatura
Passaggi di stato
sublimazione
fusione
solidificazione
evaporazione
condensazione
brinamento
acqua
punto di fusione
punto di ebollizione
0°C
100°C
metanolo
-98°C
65°C
acetone
-95°C
56°C
etanolo
-117°C
78°C
vapore
liquido
Nel liquido puro si instaura
un equilibrio tra il liquido ed
il vapore generando una
tensione di vapore.
In presenza di molecole di
soluto diminuisce il numero di
molecole che possono
evaporare quindi si avrà una
minore tensione di vapore .
-a-
-b-
membrana
semipermeabile
membrana
semipermeabile
h
solvente
solvente
soluzione
La presenza di molecole di soluto ostacola il flusso di solvente dalla
soluzione al solvente puro, ma non viceversa. Si raggiunge un
equilibrio quando la pressione esercitata dalla colonna
di liquido (h) impedisce il flusso di solvente dal solvente puro
verso la soluzione.
soluzione B è ipertonica (quindi contiene
più soluti) rispetto all'altra (ipotonica)
per osmosi il solvente passa da A a B
La pressione osmotica (π) della soluzione è la pressione
che occorre esercitare per contrastare il passaggio di
solvente dal comparto di destra al comparto di sinistra
Soluzione
acquosa
H2O
π=MxRxT
ELETTROLITI
Sostanze che disciolte in acqua o in altri solventi si
dissociano in ioni, dotati di carica elettrica positiva
o negativa.
Gli elettroliti possono essere forti o deboli a seconda
del maggiore o minor grado di dissociazione, cioè a
seconda del numero degli ioni dissociati formatisi
O
Glucosio + H2O
O
Cl-
NaCl 0.1 M = 0.2 osmolare
NaCl + H2O
Na+
Na+
Na+
Na3PO4
PO43-
Na+
Na3PO4 0.1 M = 0.4 osmolare
a) glucosio
NON ELETTROLITA
b) NaCl
c) Na3PO4
ELETTROLITI
ELETTROLITI FORTI
NaCl
Na3PO4
HCl
NaOH
Na+ + Cl3
+
Na
+
H
+
Na
+
3PO4
+
Cl
+
OH
Gli elettroliti forti si dissociano completamente
in ioni
L’osmolarità (o tonicità) di una soluzione è data
dalla molarità delle particelle ed è indipendente
dalla loro natura. Per calcolare la pressione osmotica
delle soluzioni di elettroliti la concentrazione della
soluzione va moltiplicata per un fattore i che indica il
numero di particelle originate dalla dissociazione del
soluto durante il passaggio in soluzione.
π=i•M•R•T
Soluzioni aventi la stessa osmolarità hanno la stessa
pressione osmotica e si definiscono isotoniche.
Nei liquidi di cui è composto l'organismo
sono presenti elettroliti, gli ioni che ne
derivano sono quindi fondamentali per
regolare i movimenti dell'acqua e per
mantenerne costante il pH.
La misurazione della quantità di elettroliti
nel sangue è indicata per la valutazione del
metabolismo idrosalino, che viene alterato
in caso di disidratazione o di patologie renali.
Il solvente passa dalla soluzione più diluita ( minore π) a
quella più concentrata (maggiore π)
una cellula
in una soluzione:
ipo tonica
iso tonica
iper tonica
π minore
π uguale
π maggiore
DEFINIZIONI DI ACIDI E BASI
Secondo Arrhenius :
acidi sono sostanze che in soluzione acquosa rilasciano ioni H+
basi sono sostanze che in soluzione acquosa rilasciano ioni OH-
Secondo Lewis :
acidi sono sostanze capaci di ricevere un doppietto elettronico
basi sono sostanze capaci di cedere un doppietto elettronico
Secondo Brönsted-Lowry
Acidi sono i composti che
cedono un protone al partner
di reazione.
Basi sono i composti che
acquistano un protone dal partner
di reazione
CH3COOH + H2O
acido
base
NH3 + H2O
base
H3O+ + CH3COO-
acido
NH4+ + OH-
CH3COOH +
H2O
acido
base
NH3 + H2O
base
acido
H3O+ +
acido
coniugato
CH3COObase
coniugata
NH4+ + OHacido
base
coniugato coniugata
Gli acidi e le basi che non si dissociano completamente in
acqua , ma danno luogo ad un equilibrio, sono detti deboli
aA + bB
cC + dD
[C]c · [D]d
=
Keq
[A]a · [B]b
All’equilibrio è costante il rapporto fra il prodotto delle
concentrazioni dei prodotti e il prodotto delle concentrazioni dei
reagenti, ciascuno elevato al proprio coefficiente stechiometrico.
Keq è definita costante di equilibrio.
La parentesi [ ] indica la concentrazione molare dei componenti
CH3COOH + H2O
Ka =
H3O+ + CH3COO-
[CH3COO-] · [H3O+]
[CH3COOH]
Ka è definita costante di acidità
ed indica la forza di un acido
NH3 + H2O
NH4+ + OH-
[NH4+] · [OH-]
Kb =
[NH3]
La Kb indica la forza di una
base
NH3 + H2O
base
NH4+ + OH-
acido
L’acqua si comporta
in alcune reazioni
come acido ed in
altre come base
HNO2 + H2O
acido base
H3O+ + NO2-
DISSOCIAZIONE DELL’ACQUA
Nell’acqua esistono ioni H3O+ o ( H+ ) e ioni OHQuesti ioni originano dalla reazione fra
due molecole di acqua, una delle quali si
comporta da acido, l’altra da base.
H2O + H2O
+
H3O
+
OH
La ionizzazione dell’acqua è definita
da una costante di equilibrio
(prodotto ionico dell’acqua)
Kw = [H3O+] [OH-] = 1 x 10-14
a 25°
25°C
[H+] = [OH-] = 1·10-7
L'acidità, la neutralità, la basicità di una soluzione
acquosa vengono espresse per comodità di calcolo in
termini di pH, ossia dal logaritmo negativo, in base 10,
della concentrazione degli ioni H3O+:
pH= -log[H3O+] cioè [H3O+] = 10 -pH
+:
La scala del pH individua le reali concentrazioni di ioni H+ e OH-.
Il pH (Potential of Hydrogen) viene definito come:
pH = -log10 [H+ ] in soluzione neutra a 25°C.
La scala del pH va da 0 a 14. Per valori di pH inferiori a 7 le soluzioni sono
definite acide, pertanto la concentrazione di ioni H+ sarà maggiore rispetto
alla concentrazione di ioni OH-.
Per valori superiori a 7 le soluzioni sono definite basiche, ovvero aventi
una concentrazione di ioni H+ inferiore alla concentrazione di ioni OH-.
Soluzione acida
[H+] > 1·10-7
[OH-] < 1·10-7
pH < 7
Soluzione neutra
+
[H ]
=
7
1·10
[OH ]
=
7
1·10
>
7
1·10
pH = 7
Soluzione basica
+
[H ]
<
7
1·10
pH > 7
[OH ]
Sali
Derivano dalla reazione di un acido con una base
a) acido forte + base forte
HCl + NaOH → NaCl + H2O
b) acido debole + base forte
CH3COOH + NaOH → CH3COONa + H2O
b) acido forte + base debole
HCl + NH3 → NH4Cl
In soluzione acquosa i sali sono completamente
dissociati in ioni
a)
NaCl → Na+ + Cl-
Gli ioni prodotti non hanno alcuna possibilità di reagire con
l’acqua. Nella soluzione non è modificata la concentrazione
di ioni H3O+ e OH-
La soluzione è quindi neutra.
CH3COONa → CH3COO- + Na+
CH3COO- + H2O
CH3COOH + OHLa soluzione è quindi basica.
b)
NH4Cl → NH4+ + ClNH4+ + H2O
NH3 + H3O+
La soluzione è quindi acida.
c)
Soluzioni tampone
Soluzioni che mantengono inalterato il loro
pH dopo aggiunta di piccole quantità di acidi
o di basi.
Le soluzioni tampone sono costituite da un
acido debole e dalla sua base coniugata
(sale dell’acido)












