Reazioni chimiche
Presupposti
1. Legge di conservazione della massa di Lavoisier: la massa dei
reagenti deve sempre corrispondere alla massa dei prodotti.
Quindi gli atomi in gioco sono sempre gli stessi, sia
qualitativamente, sia quantitativamente. Ciò che cambia è la
modalità con cui si riuniscono a formare nuove molecole.
2. Una reazione chimica è sempre accompagnata da una variazione
di energia chimica, associata ai legami rotti e formati.
1. Sono trasformazioni che comportano una variazioni della
composizione chimica delle sostanze coinvolte, che si
trasformano in nuove sostanze.
2. Non sono reversibili.
3. Le sostanze presenti all’inizio della trasformazione sono dette
REAGENTI; le sostanze che si ottengono alla fine si dicono
PRODOTTI.
Caratteristiche
A+B
reagenti
C+D
prodotti
4. I coefficienti numerici davanti alle specie chimiche indicano il
numero di molecole di quel composto, che partecipano alla
reazione
2 Mg + O2 2 MgO
In questa reazione reagiscono 2 molecole di Magnesio con 1 molecola di
Ossigeno, per dare 2 molecole di MgO
www.aiutoperstudiare.com
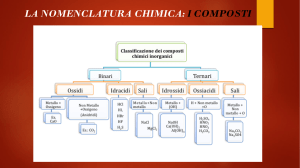
Classificazione delle reazioni:
1. Reazioni di sintesi:
due o più sostanze reagiscono tra loro
formandone una unica (composto)
Esempi
2 Mg + O2 2 MgO
Fe2O3 + 3 H2O 2 Fe(OH)3
CaO + SO2 CaSO3
A + B AB
2. Reazioni di decomposizione:
un unico composto si scinde in due o più
sostanze semplici (elementi o composti)
CaCO3 CaO + CO2
2 KClO3 2 KCl + 3 O2
AB A + B
3. Reazioni di scambio semplici:
un elemento sostituisce un altro elemento in
un composto
2 Al + 3 CuSo4 Al2(SO4)3 + 3 Cu
Mg + 2 HNO3 Mg(NO3)2 + H2
Ca + 2 H2O Ca(OH)2 + H2
A +BC AC + B
4. Reazioni di doppio scambio:
CrCl3 + 3 NaOH 3 NaCl + Cr(OH)3
comporta uno scambio di ioni tra due
composti
HCl + NaOH NaCl + H2O
AB + CD CB + AD
CaCO3 + 2 HCl CaCl2 + H2O + CO2
www.aiutoperstudiare.com