Fenotipi e patologie complesse
Variabilità genetica e malattia
Singolo gene Malattie “mendeliane”
Geni multipli Malattie complesse
Polimorfismi Suscettibilità a malattie non genetiche
Farmacogenetica Suscettibilità agli effetti dei farmaci
Malattie Mendeliane
Malattie complesse
•mutazioni altamente penetranti
•contribuiscono alla predisposizione
•spesso soggette a selezione negativa
(varianti rare)
•effetto deleterio sulla funzione della
proteina è spesso evidente (stop
codon, frameshift, mutaz splicing
etc)
alla malattia
•rischio relativo moderato
•non soggette a forte pressione
selettiva (varianti più comuni)
•varianti con effetti moderati sulla
funzione o regolazione
dell’espressione
•regioni non codificanti
La prevalenza di obesità e sovrappeso tra i bambini e gli
adulti è notevolmente aumentata nel corso degli ultimi decenni
nella maggior parte dei paesi sviluppati o in via di sviluppo
(Stein and Colditz., 2004; Wang et al., 2002).
Obesità
Essa sta assumendo proporzioni epidemiche
e rappresenta un importante fattore di
rischio per patologie quali
ipertensione, malattie
cardiovascolari, patologie
metaboliche, diabete, ecc.
OBESITY: A Huge Public Health Problem
Definition of obesity:
BMI>30
Definition of overweight:
BMI >25
BMI = weight (kg)/ height2 (m)
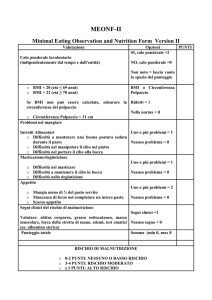
PRIMARIA: non dovuta a disfunzioni endocrino
metaboliche
SECONDARIA: causata da una disfunzione endocrina
o metaboliche
•DIFFUSA :
adipe presente in tutti i distretti del
corpo (tronco e arti)
adipe presente soltanto in alcune
zone (addome, glutei, fianchi e torace)
•DISTRETTUALE:
OBESITA’ ANDROIDE (UOMO) (adipe
localizzato principalmente nell’addome)
OBESITA’ GINOIDE (DONNA) (adipe
localizzato principalmente su glutei e
fianchi)
F.Monaco “Endocrinologia Clinica” III Ed-SEU
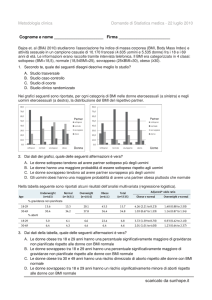
Secondo le linee guida europee la circonferenza vita non dovrebbe superare i 102 cm negli
uomini e gli 88 cm nelle donne. Il rapporto vita/fianchi dovrebbe essere inferiore a 0,95 per
gli uomini e 0,8 nelle donne.
La circonferenza della vita è rappresentativa del
grasso viscerale intraddominale mentre quella
dei fianchi del grasso sottocutaneo gluteofemorale.
La tabella sottostante ci mostra il rischio di malattie basato sulla relazione tra BMI e
circonferenza del giro vita tra i due sessi.
BMI
uomini ≤ 102 cm
donne ≤ 88 cm
uomini ≥ 102 cm
donne ≥ 88 cm
< 18.5
—
—
normopeso
18.5 – 24,9
—
—
sovrappeso
25 - 29.9
aumentato
alto
obesità I grado
30 - 34.9
alto
molto alto
obesità II grado
35 - 39.9
molto alto
molto alto
obesità III grado
≥ 40
estremamente alto
estremamente alto
sottopeso
F.Monaco “Endocrinologia Clinica” III Ed-SEU
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
www.cdc.gov
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
≥20%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
≥20%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
≥20%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
≥20%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
20%–24%
≥25%
Obesity Trends* Among U.S. Adults
BRFSS, 2002
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
20%–24%
≥25%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
20%–24%
≥25%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
20%–24%
≥25%
(*BMI ≥30, or ~ 30 lbs overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
20%–24%
25%–29%
≥30%
(*BMI ≥30, or ~ 30 lbs. overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
20%–24%
25%–29%
≥30%
(*BMI ≥30, or ~ 30 lbs. overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
20%–24%
25%–29%
≥30%
(*BMI ≥30, or ~ 30 lbs. overweight for 5’ 4” person)
No Data
<10%
10%–14%
15%–19%
20%–24%
25%–29%
≥30%
Attualmente il 5.7% della spesa sanitaria degli USA è
imputabile ai danni dell’obesit{. Si stima che ogni
anno vengano spesi 3,9 miliardi di dollari per spese
mediche legate all’obesit{. Altri 33 miliardi sono spesi
per prodotti e servizi per la perdita di peso.
Malattia Multifattoriale
Genotipo
Ambiente
40-70%
Obesità
Interazione tra
geni ed ambiente
GENI
AMBIENTE
Tasso spontaneo di mutazione
0.5% /milione di anni:
in 10,000 anni
~ 0.005% mutazioni
In 100 anni
radicali modifiche
di dieta e stile di vita
Il fenomeno può essere interpretato come una
risposta adattativa alla scarsità di energia disponibile
che ha caratterizzato per lungo tempo l’evoluzione
dell’uomo (Ulijaszek e Lofink, 2006).
Gli antenati dell’uomo moderno
sono stati in grado di sopravvivere
grazie alla capacità di sfruttamento
di nuovi alimenti e dalla
trasformazione dei sistemi
metabolici in grado di fornire
maggiori quantità di energia
necessaria.
I primi ominidi sono comparsi circa 6
milioni di anni fa nell’Africa orientale
(Tanzania, Kenia, Etiopia).
Dieta: foglie, radici, frutta, noci
(carboidrati)
Circa 2 milioni di anni fa:
•clima più secco e freddo,
•le foreste furono sostituite dalle prateria,
•Già con Homo erectus: cambio dieta (uso
di utensili, fuoco): > proteine e acidi
grassi insaturi. Aumento del cervello.
La dieta Paleolitica:
consumo di calorie giornaliero: ~ 3000 kcal
la carne: 35–50% della dieta
Neandertaliani:
Mangiavano prevalentemente carne, grassi e midollo
Consumo giornaliero: sino a 4000 kcal
Le carni degli animali selvatici: meno grassi saturi e più grassi polinsaturi.
Carne magra+frutta+ verdura +noci: ricca di antiossidanti.
Poco sale, più fibre e più vitamine e minerali.
I resti scheletrici delle popolazioni del Paleolitico superiore ci indicano
che gli individui erano di alta statura, buona ossatura e buoni denti
La dieta paleolitica è caratterizzata da periodi
alterni di abbondanza e di carestia.
L’abilit{ di immagazzinare grassi di
riserva durante i periodi di abbondanza
permetteva loro di avere adeguate
riserve energetiche durante i periodi di
carestia e sufficienti energie per lo
sviluppo del cervello.
L’obesit{ nel Paleolitico era sicuramente un rarit{.
“Venere”
Venere
del Paleolitico
dei giorni nostri
Steatopigia: accumulo di grasso senza
impedire la dispersione di calore
Secondo R. Pöch in periodi di fame e di sete
ritarderebbe la perdita di
albumina, consentendo al Boscimano e
all'Ottentotto di resistere alle cattive
condizioni di esistenza nel deserto.
Nascita dell’agricoltura (10.000): ancora cambiamenti nella dieta.
L’uomo diventa onnivoro.
Questa rivoluzione neolitica coincise con un peggioramento della
salute (malnutrizoine).
L’agricoltura creò dipendenza dai cereali che rimpiazzarono la carne
e la frutta come fonte primaria di energie.
Allergie alimentari. Persistenza della lattasi (unico adattamento
all’agricoltura e all’allevamento)
Rivoluzione industriale
Divenne più facile conservare il cibo
Il cibo era comunque disponibile per tutti.
Le macchine hanno diminuito lo sforzo fisico .
Teoria del genotipo di conservazione
Alcuni decenni fa Neel (1962; 1982)
propose che un “thrifty genotype”
(genotipo di conservazione) si sia evoluto
per proteggere le popolazioni umane dalla
fame, facilitando il rapido rilascio di
insulina (efficiente conversione di
zucchero) e l’accumulo di energia sotto
forma di grasso nei periodi di abbondanza
costituendo una riserva per i periodi di
magra.
Mentre i grassi di riserva permettevano l’immagazzinamento di energia
durante i periodi di carestia, nella società moderna, dove il cibo è sempre
disponibili e abbondante e l’attivit{ fisica sempre più ridotta, la funzione di
immagazzinare energia di questi geni è diventata una svantaggio
promuovendo l’accumulo di grasso, con conseguente obesità, produzione
eccessiva di insulina e sviluppo di insulina resistenza e diabete mellito
eccesso di calorie + riduzione attività motorie = incremento
obesità, diabete e malattie cardiovascolari,
mancando anche un adattamento genetico-biologico alle nuove condizioni
di vita e di alimentazione.
Inoltre, la vita moderna è spesso caratterizzata da stress e da una riduzione
di periodi di riposo e sonno. Elementi che sono stati associati con
l’aumento dell’obesit{ (Bjorntorp, 2001; Chaput et al., 2006).
Recentemente Speakman contestò questa ipotesi poiché non
poteva spiegare come moltissime persone attualmente
mantengono un normale peso corporeo.
Speakman suggerì che sicuramente antichi geni hanno
controllato il peso corporeo, ma con le mutazioni responsabili
dell’obesit{ che sono state selezionate contro il rischio di
predazione.
Gli obesi dovevano essere facili prede per ovvie ragioni, per cui
erano svantaggiati.
Per cui alcuni milioni di anni fa gli uomini svilupparono
strategie per difendersi dai predatori (fuoco, armi).
Da allora mutazioni casuali che determinavano l’aumento di
peso non sono state più rimosse dalla selezione naturale e
hanno cominciato a diffondersi per deriva genetica.
Quando il cibo è diventato largamente disponibile e l’attivit{
fisica limitata, il peso corporeo è cominciato ad aumentare
negli individui portanti tali geni.
Pliocene (6-2 milioni di anni)
Mutazioni
casuali
Mutazioni
casuali
X
Body
mass
X
Mutazioni
casuali
Speakman JR. A nonadaptive scenario explaining the genetic predisposition to obesity: the "predation
release" hypothesis. Cell Metab. 2007 Jul;6(1):5-12
Effetto interazione GENOTIPO-AMBIENTE
BMI
Ambiente
Obesogenico
Ambiente
Restrittivo
Resistenti
Predisposti
Predisposizione all’obesità
Adattato da Ravussin and Bouchard, 2000
Oggi sappiamo che la componente genetica è responsabile
della massa corporea dal 30 al 70% (Herbert et al., 2006).
la maggior parte delle forme
di obesità sono sotto un controllo poligenico di diversi
fattori biologici
Circa 135 geni candidati sono stati
associati all’obesit{.
Sono diffusi in tutto il genoma, ad
eccezione del cromosoma Y
Fattori genetici sono stati anche
associati all’attivit{ fisica
FATTORI PRECOCI DI RISCHIO PER OBESITA’
NELL’INFANZIA (BMJ 2005 ; 330)
OBESITA’ NEI
GENITORI
(se entrambi BMI >
30 , OR = 10,44; se
solo madre obesa OR
= 4,25; se solo padre
obeso OR = 2,54)
PESO ALLA
NASCITA
(OR = 1,05 per ogni
100 gr. di unità di
incremento)
INCREMENTO DI
PESO ECCESSIVO
NEL 1° ANNO DI
VITA (OR = 1.06 per
ogni 100 gr di unità di
incremento)
VERY EARLY
ADIPOSITY
REBOUND ( se < 43
mesi di età OR = 15 )
FUMO MATERNO
In gravidanza
+ 1 DS DEL PESO a 8
MESI ( OR = 3,13 ) e a
18 MESI (OR = 2,65)
CATCH UP
GROWTH NEL
PERIODO 0- 2 ANNI
(OR = 2,60)
> 8 ORE DI TV ALLA
SETTIMANA a 3
ANNI ( OR = 1,55 )
BREVE DURATA
DEL SONNO ( < 10.5
ORE PER NOTTE ) a
3 ANNI ( OR = 1,45 )
SVANTAGGIO SOCIOECONOMICO
Autore: Maurizio Iaia
BMI
Fonte: M. Iaia – “Cibo dei piccoli … salute dei grandi” – EDITEAM sas 2006
Esempio di
“early adiposity rebound”
BMI
Fonte: C.Maffeis – “Il bambino obeso e le comlicanze – SEE Firenze 2004
Dopo 1 anno di vita, i valori di BMI diminuiscono
per poi stabilizzarsi e riprendere ad aumentare
mediamente dopo i 5-6 anni. L'età alla quale si
raggiunge il valore minimo prima dell'aumento
fisiologico del BMI si chiama adiposity rebound. Un
incremento dei valori di BMI prima dei 5 anni:
adiposity rebound precoce = rischio di sviluppo di
obesità.
Alterazione dei meccanismi di controllo
della fame e della sazietà
Disfunzione dei meccanismi che regolano
la spesa energetica
SEGNALI
AFFERENTI
SEGNALI
AFFERENTI
NPY
MCH
CRH
GLP-1
CCK
GLP-1
BOMBESINA
GLUCOSIO
SEGNALI
EFFERENTI
OPPIOIDI
GHRH
SOMATOSTATINA
ADRENALINA
ESTROGENI
INSULINA
LEPTINA
NORADRENALINA
GLUCOCORTICOIDI
ANDROGENI
1: Rankinen T, Zuberi A, Chagnon YC, Weisnagel SJ, Argyropoulos G, Walts B, Pérusse L, Bouchard C. The
human obesity gene map: the 2005 update. Obesity (Silver Spring). 2006 Apr;14(4):529-644. Review.
2: Pérusse L, Rankinen T, Zuberi A, Chagnon YC, Weisnagel SJ, Argyropoulos G, Walts B, Snyder
EE, Bouchard C. The human obesity gene map: the 2004 update. Obes Res. 2005 Mar;13(3):381-490.
3: Snyder EE, Walts B, Pérusse L, Chagnon YC, Weisnagel SJ, Rankinen T, Bouchard C. The human obesity
gene map: the 2003 update. Obes Res. 2004 Mar;12(3):369-439. Review.
4: Chagnon YC, Rankinen T, Snyder EE, Weisnagel SJ, Pérusse L, Bouchard C. The human obesity gene
map: the 2002 update. Obes Res. 2003 Mar;11(3):313-67. Review.
5: Rankinen T, Pérusse L, Weisnagel SJ, Snyder EE, Chagnon YC, Bouchard C. The human obesity gene
map: the 2001 update. Obes Res. 2002 Mar;10(3):196-243. Review.
6: Pérusse L, Chagnon YC, Weisnagel SJ, Rankinen T, Snyder E, Sands J, Bouchard C. The human obesity
gene map: the 2000 update. Obes Res. 2001 Feb;9(2):135-69. Review.
7: Chagnon YC, Pérusse L, Weisnagel SJ, Rankinen T, Bouchard C. The human obesity gene map: the 1999
update. Obes Res. 2000 Jan;8(1):89-117. Review.
8: Pérusse L, Chagnon YC, Weisnagel J, Bouchard C. The human obesity gene map: the 1998 update. Obes
Res. 1999 Jan;7(1):111-29. Review.
9: Chagnon YC, Pérusse L, Bouchard C. The human obesity gene map: the 1997 update. Obes Res. 1998
Jan;6(1):76-92. Review.
10: Pérusse L, Chagnon YC, Dionne FT, Bouchard C. The human obesity gene map: the 1996 update. Obes
Res. 1997 Jan;5(1):49-61. Review.
11: Bouchard C, Pérusse L. Current status of the human obesity gene map. Obes Res. 1996 Jan;4(1):81-90.
Review.
SNPs showing polygenic effects on BMI
Geni correlati all’obesit{
TNF
LEP e LEPR
FTO
UCP1 e
UCP2
AdipoQ
Chromosome Region: 16q12.2
Unknown function
Fto: originally described in a mouse
with Fused toes (syndactyly)
HUGO Gene Nomenclature
Committee changed the name to
FTO: FaT mass and Obesity associated
2900 pazienti e 5100 controlli
Gli individui portatori del polimorfismo a
rischio hanno una probabilità di divenire
obesi del 22% superiore (sia adulti che
bambini) rispetto ai non portatori di tale
polimorfismo
13 coorti con 38759 partecipanti
Soggetti (16%) che sono omozigoti per l’allele a
rischio hanno un incremento di 1.67 volte della
possibilità di divenire obesi (1.30 se
eterozigoti) quando paragonati a quei pazienti
che non hanno ereditato l’allele a rischio.
Spesa Energetica
LEPTINA
( LEP )
Apporto Alimentare
Tessuto Adiposo
I livelli circolanti sono proporzionali
all’adiposità. Aumenta se vi è un incremento
ponderale e diminuisce nel digiuno e dopo
esercizio fisico.
E’ mediata, almeno in parte, dal neuropeptide y (NPY), un
potente stimolatore dell’assunzione del cibo, su cui agisce in
maniera soppressiva.
La totale mancanza o la resistenza, insensibilità, alla
leptina provoca iperfagia, obesità, diabete, ed una
varietà di anomalie neuroendocrine e disfunzioni del
sistema immunitario.
Risposte alle alterazioni del sistema leptina-recettore:
Mancata produzione di leptina (topi ob-/ob-)
Mancata produzione del recettore (topi db-/db-)
Comparsa precoce di obesità per mancato controllo di
assunzione di cibo
Nell'uomo l'assunzione di cibo è un
fenomeno assai complesso, perché mediato
da numerosi segnali biologici che si
integrano a livello ipotalamico ma anche da
fattori non energetici
(culturali, sociali, emozionali ecc.).
erapia sostitutiva
Risposta alla leptina nel
deficit congenito
CCK: (colecistochinina), ormone proteico secreto dall’intestino tenue, stimola la
secrezione di succo pancreatico e di enzimi digestivi, lo svuotamento della
colecisti, la motilità dell’intestino ed è un segnale di sazietà
GLP-1: Glucagon-like peptide-1 (GLP-1) ormone proteico secreto dall’intestino. E’
il risultato del taglio della molecola del proglucagone
BOMBESINA: nell’uomo peptide rilasciante la gastrina. Inibisce l'assunzione di cibo
(come la colecistochinina, è una delle principali molecole che controllano il senso della
fame) regola la contrattilità della muscolatura liscia, regola la secrezione esocrina ed
endocrina, la pressione arteriosa la produzione degli zuccheri e della crescita cellulare
NPY1: neuropeptide Y è un polipeptide molto diffuso nel sistema nervoso centrale e
nel sistema nervoso autonomo; svolge diverse azioni, tra cui l’aumento
dell’appetito e la modulazione della risposta vasocostrittrice innescata dai
neuroni noradrenergici è un potente stimolatore dell’appetito ed ha uno spiccato
effetto anti-anoressizzante
MCH: ormone concentrante della melanina (MCH), promotore dell’appetito.
CRH:Ormone di liberazione della corticotropina (Corticotropin-releasing hormone e
originariamente conosiuto come CRF ovvero corticotropin-releasing factor) è un
ormone polipeptidico ipotalamico, nonché un neurotrasmettitore, coinvolto nella
risposta agli stress
Cushing’s Syndrome, two loci CNC1 and CNC2, mutations
in PRKAR1A or MEN1 genes
Cortisone Reductase Deficiency, mutations in HSD11B1 and
the H6PD gene
Isolated Growth Hormone Deficiency
X-Linked Syndromic Mental Retardation 16, MECP2 gene
Bardet-Biedl Syndrome, (14q32.1) genes
BBS8, BBS3 and
BBS5
Abright Hereditary Osteodystrophy-Like Syndrome
2008
--The Human Obesity Gene
Map
According to the susceptible-gene
hypothesis,
genes increase the risk of a certain
characteristic, but are
not sufficient in themselves to
explain the development of a
disease. ‘Our genes permit us to
become obese; the environment
determines if we become obese’
Attualmente sono stati
pubblicati 15 studi GWAS
sull’obesit{
Genome-wide association studies (GWAS) have
identified several loci in the human genome
containing genetic variants associated with common
diseases, such as obesity.
More than 97 genetic loci have been robustly
associated with obesity-related traits, but,
in general, a little overlap in the results of these studies
has been observed
Distribuzione obesità in Italia
Distribuzione obesità in Italia
Valutazione della statura e del BMI in
Sardegna. Dati sulla leva del 1980
Piras I.S1., Vona G1., Ghiani M.E1., Inghes S2., Salaris L2., Calò C.M1.
(1) Dipartimento di Biologia Sperimentale
(2) Dipartimento di Ricerche Economiche e Sociali
Università degli Studi di Cagliari
Obesità
5,0%
4,7%
4,0%
3,4%
3,0% 3,1%
3,0%
3,0%
3,0%
2,6% 2,6%
1,5%
2,0%
1,0%
Gallura
SU
Sa
rd
eg
na
CA
D
M
O
G
NU
O
R
SS
G
A
0,0%
Ogliastra
Sardegna 3,0%
Gallura: 4,7%
Ogliastra: 1,5%
Medio
Campidano
Sulcis
ANALISI DEL BMI
sottopeso
Normopeso
Sovrappeso +
Obesi
1951
1980
1951
1980
1951
1980
Sassari
8,84
8,9
86,68
78,4
4,49
12,70
Olbia tempio
6,45
9,3
86,61
76,7
6,94
14,00
Nuoro
4,32
7,5
90,24
78,0
5,44
14,50
Ogliastra
5,66
9,8
91,04
80,1
3,30
10,10
Oristano
5,73
6,6
88,90
81,7
5,37
11,70
M.Campidano
8,22
10,2
86,67
76,6
5,11
13,20
CarboniaIglesias
10,16
10,1
85,49
77,2
4,34
12,70
Cagliari
8,93
10,1
86,39
77,2
4,68
12,70
Sardegna
7,91
9,0
87,21
78,2
4,88
12,80
ANALISI DEL BMI
sottopeso
Normopeso
Sovrappeso +
Obesi
1969
1998
1969
1998
1969
1998
Montagna
3,90
9,49
91,02
78,83
5,08
11,68
Collina interna
5,65
10,12
89,66
77,95
4,69
11,93
Collina
litoranea
7,65
9,39
87,22
76,47
5,13
14,15
Pianura
9,95
10,97
85,22
76,12
4,82
12,91
Provincia di
Carbonia
Iglesias
Incidenza dell’Obesit{ in et{ evolutiva
nella Provincia di Carbonia Iglesias
Realizzato in collaborazione con
UNIVERSITA’ DEGLI STUDI DI CAGLIARI
Dipartimento di Biologia Sperimentale e
Corso di Laurea in Scienze Motorie
Obesità e Sovrappeso
nei singoli comuni
Sardegna- Ogliastra
Obesità e sovrappeso nei maschi:
confronto con dati precedenti