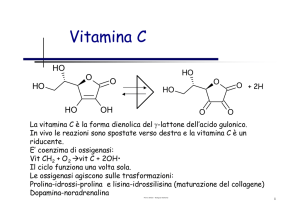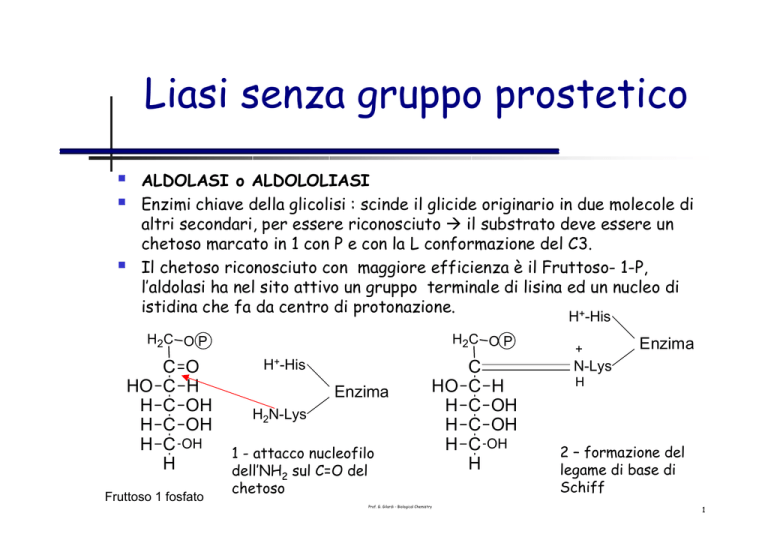
Liasi senza gruppo prostetico
ALDOLASI o ALDOLOLIASI
Enzimi chiave della glicolisi : scinde il glicide originario in due molecole di
altri secondari, per essere riconosciuto Æ il substrato deve essere un
chetoso marcato in 1 con P e con la L conformazione del C3.
Il chetoso riconosciuto con maggiore efficienza è il Fruttoso- 1-P,
l’aldolasi ha nel sito attivo un gruppo terminale di lisina ed un nucleo di
istidina che fa da centro di protonazione.
+
H -His
H2C O P
HO
H
H
H
C
C
C
C
C
H
O
H
OH
OH
OH
Fruttoso 1 fosfato
H2C O P
H+-His
Enzima
H2N-Lys
1 - attacco nucleofilo
dell’NH2 sul C=O del
chetoso
Prof. G. Gilardi - Biological Chemistry
HO
H
H
H
C
C
C
C
C
H
O
H
OH
OH
OH
+
Enzima
H2N-Lys
H
2 – formazione del
legame di base di
Schiff
1
Meccanismo
3 – protonazione dell’ N con spostamento del doppio legame tra la parte 2-3 a spese del
legame C3-C4, il C4 resta in forma cationica e con OH- del mezzo è neutralizzata e
diventa gliceraldeide in forma idrata (P) se fossimo partiti da F-1,6-dP o solo
gliceraldeide da F-1-P
H+-His
H2C O P
Enzima
C
HO
NH-Lys
C H
OHH C
+
OH
H C OH
H C OH
H
Prof. G. Gilardi - Biological Chemistry
2
Meccanismo
4 – l’uscita del primo prodotto di reazione
modifica il sito attivo Æ ripristino del legame
di base di Schiff nella forma originaria e
semplice protonazione del carbanione
H+-His
H2C O P
HO
H
H+ H
H
C
C
C
C
C
H
O
H
OH
OH
OH
+
H2N-Lys
H
H2C O P
C
HOH2C
O
H+-His
Enzima
H2C O P
OH-
Enzima
H2N-Lys
C O
HO C H
H OH
H C
5 – deprotonazione
H C OH dell’azoto e idrolisi
del legame
di OH
base di Sciff Æ si forma
H C
l’altro prodotto
H di reazione.
DIOSSIACETONFOSFATO : scissione
di un monosaccaride in 2 altre unità
monocarboniose
Prof. G. Gilardi - Biological Chemistry
3
Aldolasi Mn dei funghi
Stesso discorso vale per le aldolasi nei funghi in cui la destabilizzazione si realizza
con legame dativo MnÆO e poi il legame diviene covalente ; spostamento
dell’insaturazione tra C2 e C3 a spese del legame C3 – C4, anche in questo caso si ha
GAP idrata per neutralizzazione degli OH- del mezzo.
H+-His
H2C O P
H+-His
H2C O P
HO
H
H
H
C
C
C
C
C
H
O
H
OH
OH
OH
Enzima
C
Enzima
HO
Mn
C H
Mn
OHH C
+
OH
H C OH
H C OH
H
Prof. G. Gilardi - Biological Chemistry
H C
O
H C OH
H C OH
H
gliceraldeide
4
Aldolasi Mn dei funghi
Il ripristino del legame dativo porta al carbanione sul C3 Æ neutralizzazione per
protonazione e liberazione di DIOSSIACETONEFOSFATO
H+-His
H2C O P
C O
HO C H
Enzima
Mn
H2C O P
-
C
O
HOH2C
H+
Prof. G. Gilardi - Biological Chemistry
5
ISOMERASI: cl. 5
5 CLASSE: ISOMERASI
AÆB
danno la intertrasformazione di 2 isomeri
Sottoclasse: tipo di reazione isomerasica
catalizzata
Sottosottoclasse:tipi di substrato
Prof. G. Gilardi - Biological Chemistry
6
5. ISOMERASI: coenzimi
Alcune isomerasi sono proteine coniugate con coenzimi di
derivazione vitaminica, dei quali sfruttano le proprietà catalitiche
che spesso sono ascrivibili ad una differente classe enzimatica (es.
effetto ossidoreduttasico o liasico) Altri enzimi hanno centri
catalitici metallici oppure R amino acidi nel sito attivo.
Nel dettaglio vedremo le caratteristiche di reazione di isomerasi
che contengono come coenzima:
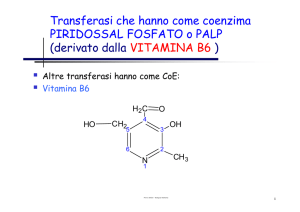
PALP (derivato dalla VITAMINA B6 ): isomerasi specifiche che
agiscono sugli aminoacidi
DESOSSIADENOSINA COBALAMIDE COENZIMA (derivato
dalla VITAMINA B12): isomerasi delle vie di salvezza
metabolica
NAD+ o NADP + (derivati dalla VITAMINA PP): isomerasi di
monosaccaridi veicolati da nucleotidi difosfati (es. UDFG:
uridindifosfoglucoso)
Prof. G. Gilardi - Biological Chemistry
7
Isomerasi PALP specifiche che
agiscono sugli aminoacidi
Coenzima piridossalfosfato
Collegano l’aminoacido (attacco NH2 su CHO) Æ legame di base di Schiff Æ
formazione del doppio legame Æ transizione verso la struttura chinoide del coenzima
con trasporto dei doppi legami Æ il metallo si coordina solo con l’N dell’amino acido.
HOOC
H2C
OH
O P
OH
O
CH2
O
Base di Schiff
CH
H2N
O Me
R
O P
N
HC
OH
O
CH2
HOOC
O Me
CH
R
OH
N
CH2-enzima
N
CH2-enzima
HOOC
HC
OH
O P
O
OH
N
CH2
O Me
N
H
C
H+
R
CH2-enzima
Prof. G. Gilardi - Biological Chemistry
8
Isomerasi PALP specifiche che
agiscono sugli aminoacidi
L’altro legame del metallo è Æ R del sito attivo. Il ritorno delle coordinazioni iniziali
ha come effetto Æ ribaltamento della stereoisomeria del C alfa. In questo modo
l’amino acido subisce isomerizzazione dalla forma L Æ D reversibilmente.
In vivo questa isomerizzazione si ha aa L Å aa D. Questi enzimi sono situati dulle
cosidette vie di salvezza metabolica che servono ad eliminare componenti che
potrebbero risultare dannosi per gli intermedi o per i prodotti che formano. La
reazione si completa con l’idrolisi del legame con liberazione dell’aa trasformato.
OHN
HC
OH
O P
R
O
CH2
CH
COOH
O Me
OH
N
CH2-enzima
aa L
Prof. G. Gilardi - Biological Chemistry
aa D
9
DESOSSIADENOSINA COBALAMIDE
COENZIMA (derivato dalla VITAMINA B12):
isomerasi delle vie di salvezza metabolica
NH2
N
N
N
N
CH 2
O
OH OH
N
N
Co
+
N
N
CH4
N
H2C
CH3
CH2
O
CH2OH
O
NH
N
CH3
H2C
O
H3C
P
HO
O
OH
O
Prof. G. Gilardi - Biological Chemistry
10
DESOSSIADENOSINA COBALAMIDE
COENZIMA (derivato dalla VITAMINA B12):
isomerasi delle vie di salvezza metabolica
.
.
CH2
N
N
H-
CH3
N
Co
N
Co
N
N
.
H-
N
N
.
Prof. G. Gilardi - Biological Chemistry
11
Isomerasi B12 che agiscono sulla
isomerizzazione dei glicoli
H
H
C
H
C
OH
H
- H-
C
OH
+
+
OH
HO
H
C
OH
H
C
X
X
H-
H
C
HO
H
C
OH
H
C
H
OH
+
X
X
Prof. G. Gilardi - Biological Chemistry
12
Isomerasi B12 che agiscono sulla
isomerizzazione dei glicoli
Avvenuta la trasposizione : la posizione destabilizzata riceve nuovamente l’H e
l’elettrone.
Si è ottenuta la forma idrata di un’aldeide.
Il meccanismo: è cambiato il n di ossidazione dei gruppi interessati (C)
il gruppo alcolico 2°ha il C con n di ossidazione = 0.il gruppo alcolico 1°ha n ossid. = a
+1. Al termine della reazione l’atomo di C del gruppo alcolico 2° ÆmetilenicoÆ0Æ-2.
quello che era gruppo OH 1° Æaldeide.
Il meccanismo oltre che oxred è anche liasico (aldeide in forma idrata :è come se
fosse stata sottratta una molecola d’H2Oche rappresenta solo la struttura che
idrata).
Questo E è presente in cellule procariote che riescono a utilizzare i glicoli come
fonte di carbonio.
Di attualità x la depurazione attraverso ceppi batterici selezionati.
I ceppi batterici che esprimono queste isomerasi sono in grado di trasformare glicoli
Æaldeidi poi ossidate a acidi,legati al CoA e poi metabolizzati regolarmente secondo i
cicli metabolici classici.
Prof. G. Gilardi - Biological Chemistry
13
Isomerasi B12: metil-malonil CoA
Queste isomerasi sono poi presenti in tutte le cellule quando sono riferite a un
substrato particolareÆil METIL-MALONIL-CoA. Questo substrato si ottiene in una
delle vie di salvezza metabolica.
Si esprime nelle vie di salvezza
Nelle cellule eucarioteÆ vie di salvezza metabolica intramitocondriale :impedire la
formazione di ac. Malonico.
I CoE B12 isomerasici, quando il substrato è stato riconosciuto dalla apoproteina
intervengono togliendo H + 1 e- sempre dalla posizione adiacente alla 1
Si forma il carbocatione in α. Il meccanismo del trasferimento riguarda il Cα
destabilizzato e non il C1* ma l’atomo di C più prossimo in grado di cedere H cioè il
CH3 in sostituzione.
Il C idrogenato cede l’H alla struttura carbocationica recupera un sostituente che in
questo caso è il C1 bloccato sul CoAÆnuovo Cα :ex-CH3 in ramificazione dove è stato
trasferito il C1.
La catena viene linearizzata:trasposizione di legami.
La reazione si completa con la cessione di H- al carbocatione sulla catena ormai
linearizzata.
Dal metilmalonil CoA si Æsuccinil CoA che è un intermedio del ciclo di krebs.
Prof. G. Gilardi - Biological Chemistry
14
Isomerasi B12: metil-malonil CoA
O
C
H3C
O
O
S CoA
CH
COOH
- HH3C
S CoA
C
C
+
C
H2C
COOH
O
S CoA
CH
+
COOH
+ H-
C
S CoA
H2C
CH2
COOH
Metil malonil CoA
Succinil CoA
Prof. G. Gilardi - Biological Chemistry
15
NAD+ o NADP + (derivati dalla VITAMINA PP):
isomerasi di monosaccaridi veicolati da
nucleotidi difosfati (es. uridindifosfoglucoso)
Ci sono altre isomerasi che usano NAD o NADP con effetto chiaramente
ossidoreduttasico. Queste sono implicate nella trasformazione di molti saccaridi. I
monosaccaridi con queste trasformazioni non esistono in forma libera ma veicolati su
nucleotidi difosfato. (es. UDFG: uridindifosfoglucoso)
1)ossidazione dell’unità monocarboniosa sulla posizione 4 del glucoso che si trasforma
in gruppo chetonico.
A questo punto:
alcune isomerasi possono associare il CoE come facevano le ossidoreduttasi classiche
e unirsi poi a un’altra molecola di CoE.
Altre danno solo un cambiamento di conformazione e la reazione si ripete in senso
simmetrico ma viene a formarsi un isomero (L conf del C4).
Altre isomerasi funzionano per trasferimento interno:
hanno nel sito attivo il R che puo essere trasferito e poi un Me di transizione con
funzione destabilizzante.
Prof. G. Gilardi - Biological Chemistry
16
NAD+ o NADP + (derivati dalla VITAMINA PP):
isomerasi di monosaccaridi veicolati da
nucleotidi difosfati
L’enzima che opera per trasf interno con il suo metallo riconosce l’O del legame fosfomonoestere
presente nel sito attivoÆprima legame dativoÆpoi covalenteÆsi forma il catione fosforico.
Il substrato è orientato nel sito attivo dell’enzima in modo da avere il gruppo 6 prossimo al sito di
fosforilazione,per cui il catione da facilmente attacca elettrofilo nel gruppo alcolicoprimario e si
ottiene il glucosio 1,6dP che è intermedio metabolico e può essere liberato.
Il gr6 è prossimo al sito di fosforilazioneÆattacco elettrofilo del P+ sull’OH del C6.
Cambiamento di conformazione che porta a un rovesciamento della parte del substrato nel sito
attivoÆadesso è il terminale 1 a essere orientatoÆMe il Mn riconosce l’atomo di O del legame
fosfoglucosidico e destabilizza col passaggiop del legame dativo a covalente il legame fosfatoossigeno con la formazione del catione fosforico. Il catione fosforico a questo puntodata la
prossimità può dare attacco elettrofilo nel gruppo alcolico primario della serina (nel sito attivo).
Quindi la serin ritorna nella forma fosforilata.
Abbiamo avuto la defosforilazione dell’altra posizione del substrato. Il ritorno a legame dativo
consente la protonaz del gruppo gluc e scissione da Me.
A questo punto il substrato può uscire dal sito attivo dell’enzime.
Quello che era entyrato come Glu 1 P esce come G6P (o viceversa) a seconda delle necessità
metaboliche. Sono dette anche MUTASI Æ rappesentano punti di discriminazione metabolica
abbasr’tanza importanti. Sono importanti perchè G1P e G6P hanno funzioni diverse.
Prof. G. Gilardi - Biological Chemistry
17
Isomerasi senza Coenzima
Ci sono ancora le isomerasi che funzionano senza Me o CoE ma solo
sfruttando gli effetti di protonazione e deprotonazione. Questi
effetti permettono di realizzare l’equilibrio fra ALDOSI e
CHETOSI importante per mediare gli effetti metabolici.
Protonazione del’O carbonilico promuovendo : la stabilizzazione di
doppio legame tra C1 e C2 con il C2 che dissocia un H+ Æpoi si ha
riassestamento a una forma a pot <.
Prof. G. Gilardi - Biological Chemistry
18
LIGASI: cl. 6
Ultima classe di enzimi : catalizzano solo reazioni di formazione
di legame, sono irreversibili, questi legami possono essere come
per le liasi:
-C-C-,
-C-O- C-N-C-S-P-O-,
nella reazione stechiometrica complessiva partecipa X =
composto ad alta energia (ATP o altri).
Il legame tra le 2 componenti molecolari si forma sempre a
spese di ATP, normalmente abbiamo una mole di ATP per mole
di legame, tutte le ligasi visto che usano composti ad alta
energia hanno sempre un metallo di transizione nel sito attivo
(essenziale).
Prof. G. Gilardi - Biological Chemistry
19
6. LIGASI: coenzimi
Tutte le ligasi sono proteine coniugate in
quanto contengono un metallo di transizione
nel sito attivo (quasi sempre Mn), necessario
per destabilizzare il composto ad alta energia
Esistono anche –C-C- ligasi che contengono il
metallo e un coenzima di derivazione
vitaminica:
LIGASI A BIOTINA (VITAMINA H)
Prof. G. Gilardi - Biological Chemistry
20
Schema di reazione
Reazioni in due tappe, la prima reazione è reversibile : riguarda la
formazione di un intermedio ad alta energia che è un’anidride.
1 – da acido libero Æ anidride mista
2 – l’acile è trasferito in una struttra anidridica su ADP liberando P
3 – AMP che trasporta l’acile
la prima metà della reazione è sempre in equilibrio, per realizzarla il
metallo riconosce un O dei legami anidride dell’ATP Æ promuove la
formazione del catione fosforico che darà attacco elettrofilo
sull’OH del gruppo acido.
Seconda metà della reazione : irreversibile, il metallo destabilizza il
nuovo legame di anidride formatosi e allora trasforma la struttura
carbossilica in struttra cationica in grado di dare attacco
elettrofilo sull’accettore.
Prof. G. Gilardi - Biological Chemistry
21
C-S ligasi
C-S ligasi : la ligasi accetta il CoA che non
trasporta acili, il metallo destabilizza i
legami di anidride Æ carbossile catione
che danno attacco elettrofilo sull’S del
CoA.
Prof. G. Gilardi - Biological Chemistry
22
C-N ligasi
Altro esempio di ligasi : saccaridi Æ amino monosaccaridi.
Lo stesso metallo dopo questa trasf. Nei rapporti substrato enzima
riconosce l’O in 2 che fa parte del substrato e lega il P Æ nuova
destabilizzazione e allontanamento Æ formazione del catione in 2.
Cosubstrato di questa ligasi è la glutammina, ha sul terminale COOH,
legato al C gamma il gruppo semiamidico : può cedere questo R
amminico sulla posizione 2 Æ aminazione.
Il gruppo NH2 dà attacco nucleofilo sul catione che si è originato
dalla rottura dell’O del P
Galattoso Æ galattosamina a questo punto su questo substrato
possono intervenire transferasi.
Prof. G. Gilardi - Biological Chemistry
23
-C-O- ligasi
Esempio di C-O ligasi: importante per la sintesi proteica : ligasi che fissano
ciascuno amino acido sul proprio RNA di trasferimento
1° reazione : destabilizzazione del primo legame dianidride Æ formazione di
Ppi
formazione catione fosforico sul P del AMP che dà attacco elettrofilo sull’O
del carbossile Æ aminoacil adenilato, questi si formano facilmente perchè il
sito attivo dell’aenzia può discriminare tra aa Æ la prima metà della
reazione su aa molto simili può portare a sovrapposizione fino al 30%.
La correzione avviene con la seconda reazione, questa ha come cosubstrato
quell’t-RNA che sul 3’ terminale ha la sequenza CCA, si ha riconoscimento
specifico, l’errore è di 1\3000 o 1\8000 per trasferimento di aa simili. Il
metallo destabilizza l’O del legame anidridico Æ formazione del catione sul
carbossile dell’aa Æ questo darà attacco sul’OH 2’ o sul 3’ Æ irreversibili.
Si elimina AMP.
Prof. G. Gilardi - Biological Chemistry
24
POLINUCLEOTIDE LIGASI
Polinucleotidi a vario grado di polimerizzazione.
Realizzano la saldatura 3’ , 5’ per esempio trasformando la molecola da lineare a
circolare o unire 2 segmenti per dare un segmento di ampiezza >. Sono usate nei
laboratori dove si utilizzano tecniche di biologia molecolare per saldare frammenti.
In vivo il ruolo di completare le catene più lunghe e intervengono nella riparazione del
DNA. Ci può essere la riorganizzazione di alcuni tratti, per es. con si ritagliano
frammenti non correttiÆligasi legano il frammento corretto.
Le ligasi sono dei Me-Enzimi.
Operano sui frammnti con 3’ libero e 5’ fosforilatoÆbisogna che agiscano prima E di
classe 2 (CINASI), che sono specifiche per riconoscere i 5’ e fosforilarli.
Le ligasi riconoscono e ospitano il terminale fosfomonestereo in 5’.
Solo adesso parte la reazione ligasica vera e propria.
Cosubstrato è rappresentato sempre da ATP. Il Mn riconosce l’O del primo legame lo
destabilizzaÆformazione del fosfato cationico liberando pirofosfato. In mancanza di
ATP può fornire AMP+ ad esempio il NAD.
Prof. G. Gilardi - Biological Chemistry
25
POLINUCLEOTIDE LIGASI
Il fosfato da attacco elettrofilo sul fosfato in 5’ si ha cosi la prima parte della
reazione quella reversibile che marca il terminale 5’con una struttura pirofosforica
In conseguenza di questi cambiamenti muta la conformazione del sito attivo che solo
a questo punto può accogliere il terminale 3’ libero.
Il Mn in conseguenza di cambiamenti della conformazione del sito si trova ad essere
molto vicino al legamedianidride. Formaz leg dativo e poi covalente che interrompe il
legame P-O e da catione P+. Questo da attacco elettrofilo sull’OH del terminale 3’
libero promuovendo l’unione dei 2 terminali.
Quando cambiano i rapporti con il Mn viene rilasciato AMP.
Reazione in 2 tempi:
1°- passaggio fosfomonoestere terminale a struttura di anidride pirofosforica
(reversibile).
2°-irreversibile destabilizza della struttura, formazione del catione fosforico e
attacco nella struttura 3’.
Prof. G. Gilardi - Biological Chemistry
26
LIGASI A BIOTINA
(VITAMINA H)
La biotina contiene una struttura eterocliclica fatta da 2 nuclei condensati. La
posizione 2 sulla parte tiazolidinica lega una catena N-valerianica; questa serve per
unire l’Enz.
Unione: leg carbonilico con un residuo di Lys e il complesso Lys-Biotina viene indicato
come BIOCITINA. Nel sito attivo dell’enzima la struttura eterociclica della biotina è
prossima a un residuo imidazolico di istidina. I 2 eterocicli sono vicini, ci sono Me
cofattori interpostiÆ l’interazione fa si che l’N1 sia in forma di AZOTURO nel sito
attivo dell’Enz.
O
Mn
O
NH
HN
O
NH
S
NH
-N
O
Lys-E
NH
CH3
S
Prof. G. Gilardi - Biological Chemistry
Lys-E
CH3
27
LIGASI A BIOTINA
La parte reversibile della reazione ligasica è preceduta da una reazione con
un enzima ausiliario. Carbonicoanidrasi ha come Me lo Zn e determina
l’addizione di H2O sulla CO2Æacido carbonico in quantità >> a quelle che si
avrebbe per l’eq spontaneo tra i due reagenti.
-substrato per la reazione è l’ac carbonico che ha accesso al sito attivo
dell’Enz.
Grazie all’Mn il fosforile+ da attacco elettrofilo sull’O dell’acido
carbonicoÆcarbossilfosfato. Questo carbossilfosfato ha:
il C porta una δ+ nel sito ativo dell’Enz.:s truttura che può subire attacco
dello ione azoturoÆforma leg covalente a spese degli e-di legame C-O del
legame anidridico.
Liberazione di ac.ortofosforico.
Il carbossile si trasf.sull’N1.
Prof. G. Gilardi - Biological Chemistry
28
LIGASI A BIOTINA
CA
CO2 + H2O
C
HO
O-
HCO3- + H+
+ ATP
ADP +
O
HO
C
O
P
OO
O-
O
O
Carbossil fosfato
NH
N
O
NH
Lys-E
CH3
S
OHO
C
-O
P
O
O-
O
Prof. G. Gilardi - Biological Chemistry
29
LIGASI A BIOTINA
Questa è la parte reversibile della reazione (si può ottenere la retrocessione degli
equilibri).
Questi cambiamenti a livello del sito attivo fanno abbassare la Kd delle ligasi per il
CoA : queste ligasi possono interagire col CoA che accettano non nella forma libera
ma in quello con l’acile.
Questo è un 1° gruppo di C-C ligasi biotina-dipendenti e dipendenti dal CoA.
Il CoA si lega vicino al sito catalitico (in un sito specifico) e il SH che porta l’acile è
abbastanza prossima come orientamento Mn che alla struttura carbossibiotina.
Negli Acil CoA la struttura è di impedimento alla libera risonanza: il C=O non può
risuonare sulla posizione C-S ma solo sull’altra posizione.sul Cα viene a concentrarsi
una C negativa. Questa struttura carbanionica viene a trovarsi allineata su 1 legame
orientato del Mn e prossimo al legame che il Mn da col carbonile legato col = legame.
Il Mn destab.il legame C-N carbossile in forma cationica che da attività nucleofila sul
Cα. Abbiamo la carbossilazione del substrato.
Prof. G. Gilardi - Biological Chemistry
30
1° gruppo di C-C ligasi biotina-dipendenti
O
HO
C
O
NH
N
HO
O
O
O
NH
-N
O
Lys-E
CH3
X-CH-C-S-CoA
+
O
NH
S
C
NH
Mn
S
Lys-E
CH3
COOH
X-CH-C-S-CoA
O
Prof. G. Gilardi - Biological Chemistry
31
Sintesi del Metil-malonil CoA
O
O
HO
C
NH
N
HO
O
O
Lys-E
CH3
CH3-CH-C-S-CoA
O
NH
-N
O
NH
S
C
+
O
NH
Mn
Lys-E
CH3
S
COOH
CH3-CH-C-S-CoA
O
Propionil CoA
Metil malonil CoA
Prof. G. Gilardi - Biological Chemistry
32
Meccanismo biotina
Æl’E ritorna nella sua struttura inziale pronto
per un nuovo ciclo di reazioni.
Per le cellule procariote non ci sono problemi.
Per le cellule eucariote c’è il problema della
compartimentazione : il Malonil-CoA è tossico
nel compartimento intramitocondriale. Questa
ligasi è però nel comp extram.
E’ la molecola che permette la sintesi di acili a
lunga catena e cioè di materiale lipidico.
Prof. G. Gilardi - Biological Chemistry
33
C-C- ligasi
Esiste un gruppo di C-C ligasi che usano
come Cosubstrato per la seconda reazione
acil CoA e’ distribuita
intramitocondrialmente Æ rappresenta
una via di salvezza metabolica. Le ligasi a
biotina e l’isomerasi B12 dip operano
insieme perÆsuccinil CoA.
Prof. G. Gilardi - Biological Chemistry
34
2° gruppo di C-C ligasi biotina-dipendenti
Oltre a questa prima categoria C-C ligasica è acilCoA
dipendenti. Esiste un secondo gruppo che non ha sito interagente
con CoA ma accetta nel sito attivo degli α-chetoacidi.
O
HO
C
NH
N
O
O
NH
S
CH3
COOH
C O
CH3
Lys-E
COOH
COOH
Mn-E
C O
Mn-E
CH2
Prof. G. Gilardi - Biological Chemistry
C O
Mn-E
CH2 35
Piruvato carbossilasi
il trasf avverrà sulla posiz β. La simmetria dei legami del Mn fa si che da 1
substrato e dall’altra col CoE. L’interazione col substrato riguarda un
legame dativo Me-O.
Cβ può accettare il carbossile. Questo carbanione ha un valore di
elettronegatività << del Cα carbanionico. L’altro legame del Mn non riguarda
solo più 1 legame orientato una coppia di legami dativi orientati ÆO del
carbossile e O sostituente in posiz 2’. Abbiamo prima delle interazioni che
promuovono il trasferimento deel Mn dall’atomo N all’atomo di O di COOH
con un aumento di circa un fattore 2 della δ+ sul C. A questo punto si
realizza la vera e propria destabilizzazione del legame
carbossileÆOÆformaz del carbossilecatione il suo attacco sul carbanione.
Il carbossile è trasferito sull’ac.piruvicoÆsi ha ac.ossalacetico.
Questo è l’E chiave della gluconeogenesi (piruvatocarbossilasi)la strutt C4
dell’ac ossalacetico è importante è l’unità base di entrata delciclo
gluconeogenico. In tutti i casi il n do ox del C cambia in riduz.; il carbossile è
cosi inserito stabilmente nella molecola del substrato per dera i prodotti
finali.
Prof. G. Gilardi - Biological Chemistry
36
2° gruppo di C-C ligasi biotina-dipendenti:
schema del meccanismo
-O
δ+
C O
COOH
C O
O
CH2 NH
N
O
NH
S
CH3
COOH
C O
CH3
Lys-E
Acido piruvico
Prof. G. Gilardi - Biological Chemistry
COOH
C O
CH2
COOH
Acido ossalacetico
37
Lesione biochimica da
carenza di VIT H
Æalterazioni del metabolismo dei lipidi e
dei glicidi. La reazione piruvato
carbossilasicaÆparziale blocco di2 vie
metaboliche. Questo a livello macroscopico
da particolare danno ai tessuti
nervosi,muscolari ed epiteliali.
Prof. G. Gilardi - Biological Chemistry
38
Vitamina F
Gli acidi LINOLEICO, LINOLENICO e ARACHIDONICO,
con l’acido CLUPANDONICO (sei doppi legami) sono definiti
acidi poliinsaturi.
Fanno parte del cosidetto COMPLESSO VITAMINICO F
che serve a proteggere le membrane biologiche dall’effettto
ossidativo dell’ossigeno
Infatti sono ANTOSSIDANTI VITAMINICI: la loro
porzione poliinsatura si ossida più facilmente dei lipidi di
membrana e perciò fungono da “cattura radicali”
Prof. G. Gilardi - Biological Chemistry
39
Vitamina F
ACIDO LINOLEICO ∆9,12
ACIDO LINOLENICO ∆9,12, 15
Prof. G. Gilardi - Biological Chemistry
•L’acido linoleico è un acido grasso
insaturo che è essenziale nei
mammiferi, che non sono in grado
di sintetizzare doppi legami oltre
la posizione ∆ 9.
•Pertanto l’acido linoleico e l’acido
linolenico sono essenziali nella
dieta dei mammiferi poichè hanno
doppi legami in posizione 9, 12 e 9,
12 e 15 rispettivamente.
•L’acido linoleico è un importante
precursore dell’acido
arachidonico, che a sua volta è un
precursore degli eicosanoidi, una
classe che comprende le
prostaglandine e i leucotrieni
40
Vitamina F
ACIDO ARACHIDONICO
(ACIDO cis-5,8,11,14-EICOSATETRAENOICO)
L’ACIDO ARACHIDONICO è un acido grasso poliinsaturo che è un importante
precursore degli EICOSANOIDI, che comprendono le PROSTAGLANDINE, I
LEUCOTRIENI e i TROMBOSSANI.
Prof. G. Gilardi - Biological Chemistry
41
Vitamina D
1,25 Dihydroxycholecalciferol - 1,25(OH)D3
The most abundant form of vitamin D is D3, called cholcalciferol. Vitamin D
is not technically a vitamin, because it is not required in the diet. It arises
from uv-photolysis of 7-dehydrocholesterol, an intermediate in cholesterol
biosynthesis (see here).
Vitamin D regulates calcium and phosphorus metabolism, particularly the
synthesis of the inorganic matrix of bone, which consists largely of calcium
phosphate.
D3 undergoes two successive hydroxylations catalyzed by mixed-function
oxidases. The first occurs at carbon 25 in liver. When calcium levels are
low, hydroxylation occurs at carbon 1, yielding the active form,
1,25(OH)D3, which stimulates osteoblasts to take up calcium. In the
intestine, 1,25(OH)D3 stimulates transcription of a protein that
stimulates calcium absorption into the bloodstream. When calcium levels
are adequate, hydroxylation occurs instead at carbon 24, yielding the
inactive 24,25(OH)D3 form.
Prof. G. Gilardi - Biological Chemistry
42
Vitamina D
H3C
CH3 H
CH3
CH3
CH3
H3C
CH3
H3C
CH3
H
H
H
CH2
HO
CH2
HO
Vitamina D2
Vitamina D3
Prof. G. Gilardi - Biological Chemistry
43