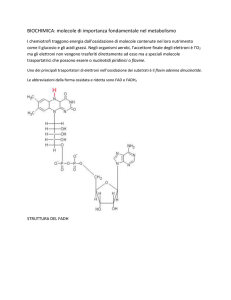
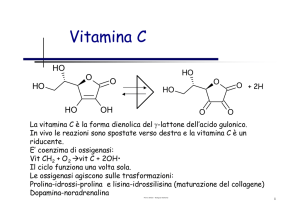
Enzimi: concetti di base e
meccanismi di catalisi enzimatica
a.
Classificazione, meccanismo d’azione
b.
Esempi di reazioni catalizzate
c.
Descrizione di alcune tipiche proteine enzimatiche.
Cofattori e vitamine
a.
b.
c.
caratteri generali, funzioni, effetti biologici
regolazioni metaboliche delle vitamine A, D, E, F, K,
B1, B2, B3, B6, B8, B12, C, H, PP;
trasformazione di vitamine in coenzimi.
1
Gli enzimi
Gli enzimi promuovono effetti catalitici.
Possono essere proteine semplici ma spesso possiedono un
gruppo prostetico che è fondamentale per la regolazione
degli effetti catalitici.
Quando siamo in presenza di un enzima che sia una proteina
coniugata si indica:
Oloenzima= apoenzima+coenzima
Apoenzima: parte proteica semplice, alcuni enzimi sono solo
apoenzimi
Coenzima: gruppo prostetico, parte non proteica (derivato da
una vitamina o metallo) che determina gli effetti catalitici
Prof. G. Gilardi - Biological Chemistry
2
Classificazione degli enzimi
Sono stati individuati 6 tipi fondamentali di reazioni enzimatiche:
1.OSSIDOREDUTTASICHE (trasporto di elettroni)
2.TRANSFERASICHE (trasferimento di gruppi)
3.IDROLASICHE (scissione o resintesi con partecipazione di H2O)
4. LIASICHE (formazione o scissione reversibile di legami)
5. ISOMERASICHE (isomerizzazione del substrato)
6. LIGASICHE (sintesi irreversibile di legami con consumo di
composti ad alta energia)
Sono di conseguenza state individuate 6 classi di enzimi, una per
ciascuna delle reazioni suindicate.
Prof. G. Gilardi - Biological Chemistry
3
Classificazione degli enzimi
Ogni enzima è classificato con un codice a
4 cifre: a. b. c. d
a: si riferisce alla classe (reazione
catalizzata, es. 4. liasi)
b-c: si riferiscono alla modalità della
catalisi e individuano la sottoclasse e la
sotto-sottoclasse
d: numero di serie dell’enzima all’interno
della sotto-sottoclasse.
Consideriamo ora una classificazione ordinata
Prof. G. Gilardi - Biological Chemistry
4
1. OSSIDOREDUTTASI
Trasportano unità riducenti, (H+)+(e-)
La sottoclasse indica il donatore dell’H (alcool,
aldeide ecc.) o altre unità riducenti (es.
alcooldeidrogenasi). I vari numeri indicano i vari tipi
di substrato che possono donare unità riducenti.
Il 3° numero indica l’accettore delle unità riducenti
(NAD+, FAD, Citocromo ecc) (es. alcooldeidrogenasi:
accettori sono enzimi del metabolismo lipidico
oppure citocromi, il numero progressivo individua la
reazione).
Il 4° numero indica il numero di serie nella sottosottoclasse.
Prof. G. Gilardi - Biological Chemistry
5
1. OSSIDOREDUTTASI: coenzimi
Le ossidoreduttasi sono proteine coniugate (apoenzima +
coenzima).
Il coenzima deriva dalla trasformazione da una vitamina oppure
è una struttura che la cellula è in grado di prodursi: per esempio
le strutture tetrapirroliche del protoemo nei citocromi.
Nel dettaglio vedremo le caratteristiche di reazione di
ossidoriduttasi di tipo:
PIRIDINICO (coenzima derivato dalla VITAMINA PP)
FLAVINICO (coenzima derivato dalla VITAMINA B2 )
CHINONICO (coenzima Q oppure derivato dalle VITAMINE
E, K )
PTERINICO (coenzima derivato dalla VITAMINA B8 )
VITAMINA C DIPENDENTI
Prof. G. Gilardi - Biological Chemistry
6
OSSIDOREDUTTASI con coenzima
PIRIDINICO (NAD+ e NADP +)
I coenzimi piridinici utilizzati da
questa classe di ossidoreduttasi
derivano dalla vitamina PP
O
5
6
4
N
3
NH2
2
1
Prof. G. Gilardi - Biological Chemistry
7
O
C
NH2
VITAMINA PP
N
Ne sono dipendenti molti animali e molti
eucarioti. E’ l’eterociclo della piridina che in
posizione 3 ha un gruppo amidico
Si tratta dell’amide dell’acido nicotinico [1]:
dopo l’assunzione abbiamo l’idrolisi del
legame amidico e quindi liberazione
dell’acido nicotinico [2] che servirà per la
sintesi del coenzima.
In caso di deficienza soltanto le cellule
animali hanno selezionato un sistema di
supporto che utilizza gli intermedi del
metabolismo del triptofano per
sintetizzare un acido dicarbossilico ciclico:
l’acido chinolinico [3].
-OH
O
[1]
C
NH2
NH3
N
[2]
O
C
OH
N
[3]
O
C
OH
OH
N
C
O
Prof. G. Gilardi - Biological Chemistry
8
COSTRUZIONE DEL
COENZIMA PIRIDINICO [1]
Per la costruzione del coenzima sono necessari l’eterociclo della
piridina, mono o disostituito con il carbossile (ACIDO NICOTINICO O
CHINOLINICO). Inoltre è necessario, un saccaride, il RIBOSO. Si
ottiene nella forma fosforilata sulla posizione 5 e con difosforilazione
con l’anidride esterna dell’acido fosforico sulla posizione 1.
O
O
C
OH
OH
OH
N
HO
P
O
ACIDO NICOTINICO
O
P
O
1
O
H
O
OH
HO
P
5
O
H 2C
H
H
OH
OH
RIBOSO-5-FOSFATO-1-PIROFOSFATO
Prof. G. Gilardi - Biological Chemistry
9
COSTRUZIONE DEL
COENZIMA PIRIDINICO [2]
In questi enzimi avremo quei metalli di transizione (Me) che sono in grado di
dare legami dativi con l’atomo di ossigeno che in seguito diventano legami
covalenti: questo effetto si compie sull’O legato al C1 del riboso: viene
sottratta la struttura pirofosforica sulla posizione 1 su cui compare una
carica +: il C1 diventa C+, in contemporanea si ha una inversione di
configurazione del C1 da α a β.
Il C1+ può quindi ricevere attacco nucleofilo dal N1 del substrato (acido
nicotinico o acido chinolinico). Si forma il prodotto di addizione e viene
eliminato del pirofosfato (PPi).
O
HO
C
OH
N
O
O
O
+
OH
HO
P
O
H
OH
O
P
O
O
OH
H 2C
H
H
OH
P
O
C
OH
OH
HO
O
N
+
HC H
O
OH
Me
Prof. G. Gilardi - Biological Chemistry
H 2C
H
H
OH
P
OH
O
+ PPi
10
COSTRUZIONE DEL
COENZIMA PIRIDINICO [3]
La struttura che si forma è costituita da un pentoso legato all’acido
fosforico (in posizione 5 del riboso) e ad un’eterociclo azotato (o base
azotata) tramite legame del C1 del riboso con l’N1 dell’eterociclo.
Possiamo definire questa struttura un nucleotide: il nicotinato
mononucleotide (NMN) oppure il chinolinato mononucleotide (CMN).
COOH
COOH
+
+
CH2O P
O
H
NMN
COOH
N
N
CH2O P
O
H
H
H
H
OH
H
OH
OH
Prof. G. Gilardi - Biological Chemistry
OH
CMN
11
COSTRUZIONE DEL
COENZIMA PIRIDINICO [4]
Il chinolinato mononucleotide viene ulteriormente modificato da un
metalloenzima Mn dipendente che riconosce il COOH in posizione 2
dell’eterociclo e lo sottrae sotto forma di CO2, generando quindi il
nicotinato mononucleotide che serve per la formazione del coenzima
funzionale.
COOH
COOH
Mn
+
COOH
N
H
H
CH 2 O P
+ CO2
H
H
H
OH
+
O
CH2O P
O
H
N
OH
OH
Prof. G. Gilardi - Biological Chemistry
OH
12
COSTRUZIONE DEL
COENZIMA PIRIDINICO [5]
La sintesi del coenzima prevede una ulteriore reazione del
nicotinato mononucleotide con ATP:
Mn
O
O
OH
OH
N
O
HO P O P O P O
OH
COOH
NH2
N
N
O
+
N
N
P
O
O
N
OH
O
N
+
P O
O
OH
OH
N
N
O
OH
OH OH
NH2
OH
OH OH
un Mn enzima riconosce l’ossigeno del legame di anidride che collega il Pα con
il Pβ e destabilizza il legame tramite la transizione dativo-covalente
dell’interazione Mn-O. Il Pα diventa sede di una carica + su cui da attacco
nucleofilo uno degli atomi di ossigeno del fosforile del nicotinato. Quando il
legame Mn-O ritorna dativo si libera pirofosfato e il prodotto di
condensazione: il nicotinato adenin dinucleotide, ossia la forma desaminata
del NAD+ (desamido-NAD+).
Prof. G. Gilardi - Biological Chemistry
13
COSTRUZIONE DEL
COENZIMA PIRIDINICO [6]
Per ottenere la forma attiva del coenzima (NAD+) si ha la seguente reazione:
desamidoNAD+ + ATP + Q → ADP + Pi +E + NAD+
La reazione si basa sulla destabilizzazione del legame amidico della glutammina
(Q) che viene scomposta a acido glutammico e un gruppo amminico che si
trasferisce sul carbossile dell’acido nicotinico che torna quindi a formare una
nicotinamide.
Si ottiene il primo coenzima piridinico attivo, il NICOTINAMIDE ADENIN
DINUCLEOTIDE (NAD+).
NH2
O
OH
N
OH
O
+
N
P
O
O
O
O P O
OH
N
NH2
O
N
OH
N
O
+
N
O
OH
P
O
O P O
O
O
OH
N
N
N
O
OH OH
OH OH
OH
N
NH2
desamidoNAD+
OH
Prof. G. Gilardi - Biological Chemistry
OH
NAD+
14
COSTRUZIONE DEL
COENZIMA PIRIDINICO [7]
L’altro coenzima piridinico attivo si ottiene dal NAD+ tramite fosforilazione
della posizione 2 del riboso legato all’anello purinico dell’adenina.
NH2
O
N
NH2
OH
NAD+
+ ATP → ADP +
NADP+
O
+
N
P
O
O
O
N
N
O P O
N
O
OH
OH O
O
OH
OH
P
OH
OH
I due coenzimi hanno identico meccanimo di azione ma sono caratterizzati da
un differente pH isoionico ed isoelettrico, poiché uno (il NADP+ ) contiene un
gruppo fosforico e ha quindi una carica netta negativa maggiore. Questi
coenzimi interagiranno quindi con proteine che hanno simmetricamente un
diverso pH isoelettrico ed eventualmente cariche positive complementari a
quelle del coenzima. Alcune apoproteine si legheranno in modo specifico al
NAD+ e altre al NADP+ a formare differenti oloenzimi ossidoreduttasici
piridinici.
Prof. G. Gilardi - Biological Chemistry
15
Struttura trimensionale
del coenzima
O
*NH2
N
OH
O
+
N
*
P
O
O
O
O P O
OH
N
* NH2
N*
N
O
OH OH
OH
OH
Tra i due piani si collocano i metalli cofattori, ioni
metallici bivalenti (Ca2+ Mg2+ Mn2+ ), effettori della
catalisi, che danno 4 interazioni con gli atomi
indicati dagli asterischi *
Prof. G. Gilardi - Biological Chemistry
La molecola da un
punto di vista
spaziale risulta
ripiegata intorno
ad un asse in
corrispondenza
dell’O che connette
i due gruppi
fosforici. I due
eterocicli si
trovano su piani
affacciati e
paralleli.
16
Effetto catalitico
I metalli cofattori catalizzano la ridistribuzione del sistema di
insaturazioni: la adenina transisce dalla forma lattimica alla
forma semilattamica, e questo effetto, amplificato dai metalli
cofattori si trasmette alla piridina, che verrà a trovarsi in 2
possibili forme di risonanza: la aromatoide e la chinoide.
O
NH2
+ H + elettrone
H
O
NH2
N
+N
Aromatoide
H
CH3
Chinoide (NAD(P)H + H+)
(NAD(P)+)
Prof. G. Gilardi - Biological Chemistry
17
Effetto catalitico
La transizione scatenata dall’equilibrio tra le due forme di risonanza
fa sì che sulla posizione 4 si concentri la carica positiva portata in
precedente dall’N e che possa essere fissato in 4 un atomo di
idrogeno in più mentre un elettrone viene accettato dal sistema
delocalizzato degli anelli. Si forma pertanto una struttura neutra.
Le ossidoreduttasi che contengono questi coenzimi operano
reversibilmente, catalizzando la riduzione o l’ossidazione dei
substrati.
ossidazione
NAD+
NADH + H+
+ XH2
X+
NADP+
NADPH + H+
riduzione
La catalisi è stereospecifica: il substrato interagisce con il coenzima
solo solo se si trova in una conformazione sterica appropriata.
Prof. G. Gilardi - Biological Chemistry
18
Interazione coenzima-apoproteina
L’interazione con la proteina è esclusivamente salina, il coenzima si
lega all’apoproteina tramite interazioni dei fosforili del pirofosfato.
Nei coenzimi NADP viene coinvolto anche il gruppo fosforico presente
in 2’. Gli enzimi che interagiscono con NAD o NADP hanno pH
isoelettrico differente.
Nelle cellule eucariotiche:
I coenzimi NAD sono presenti in enzimi intra-mitocondriali.
I coenzimi NADP in enzimi extra-mitocondriali
Eccezione: le ossidoreduttasi della glicolisi utilizzano NAD anche se la
glicolisi è extra-mitocondriale.
Prof. G. Gilardi - Biological Chemistry
19
Interazione coenzima-apoproteina
•Durante il trasferimento delle unità riducenti si
realizzano nel sito attivo dell’enzima dei cambiamenti
conformazionali che fanno variare la costante di
dissociazione (Kd) tra coenzima e apoproteina, fino a farla
aumentare di un fattore 103-104
•Il coenzima trasformato dissocia (infatti all’aumentare
della Kd diminuisce l’affinità del coenzima per la
apoproteina) e lo stesso enzima trasformato può essere
accettato da un’altra apoproteina che lo utilizzerà per una
reazione spostata in verso opposto rispetto alla
precedente
Prof. G. Gilardi - Biological Chemistry
20
Substrati delle ossidoreduttasi con
coenzimi piridinici. Tipo 1
Coinvolgono unità MONOCARBONIOSE (gruppi con un solo atomo
di carbonio).
alcool 2ario + NAD+Æ C=O (chetone) + NADH + H+
alcool 1ario + NAD+Æ CHO (aldeide) + NADH + H+
aldeide + NAD+Æ COOH (carbossile) + NADH + H+
carbossile:
può essere ossidato a CO2
o ridotto a -CHO
il gruppo aminico può andare incontro a desaminazione ossidativa
CH-OH
CH2-OH
CHO
COOH
H2N-C-H + NAD+Æ C=NH (immino gruppo) + NADH + H+
Prof. G. Gilardi - Biological Chemistry
21
Esempio: passagio aldeide-acido
OH
E0 + NAD+ Æ E1- NAD+ + R-C-OH Æ E2- NAD+
H
S
SH
R-C-OH
H
Æ E3- NADH ÆE4-Zn + NADH + H3PO4Æ E5-Zn
S
S
R-C=O
R-C=O
Prof. G. Gilardi - Biological Chemistry
S
+ R-C-OP
O
22
Substrati delle ossidoreduttasi con
coenzimi piridinici. Tipo 2
Alcune ossidoreduttasi NAD dipendenti hanno potenziale standard
che consente l’interazione diretta con altre ossidoreduttasi.
In particolare si ha l’interazione con enzimi redox che hanno coenzimi
flavinici.
FADH2
FMNH2
+ NAD(P)+
FAD
FMN
+ NAD(P)H + H+
E’ IMPORTANTE PER LE CATENE REDOX, es. catena respiratoria
Prof. G. Gilardi - Biological Chemistry
23
Substrati delle ossidoreduttasi con
coenzimi piridinici. Tipo 3
Possono interagire con l’ossigeno molecolare
NAD(P)H + H+ + O2Æ NAD(P)+ + OH- + OH•
Si tratta di MONO-OSSIGENASI
Si forma un radicale OH• e a questo punto l’enzima può
ospitare nel sito attivo il substrato su cui avviene una
sostituzione radicalica ad opera del radicale OH•
(ossigenazione). Es. un gruppo metilenico diventa un alcol.
Alcuni batteri che operano per il disinquinamento
trasformano gli idrocarburi in alcoli che sono poi in grado
di metabolizzare.
Prof. G. Gilardi - Biological Chemistry
24