www.associazionemediciendocrinologi.it
Breaking news
nr. 2 - gennaio 2014
ROMOSOZUMAB NELLE DONNE IN MENOPAUSA CON
BASSA DENSITÀ MINERALE OSSEA
Responsabile Editoriale
Vincenzo Toscano
La terapia dell’osteoporosi si basa storicamente sull’uso di farmaci anti-riassorbitivi (bisfosfonati e
denosumab) e sull’uso di teriparatide, che ha un’azione osteo-anabolizzante, che produce effetti più
evidenti sulla densità minerale, sulla resistenza e sull’architettura ossea.
La sclerostina, codificata dal gene SOST, è una glicoproteina secreta dagli osteociti che gioca un ruolo
fondamentale negativo nei processi di osteo-formazione, attraverso l’inibizione della proliferazione e
dell’attività osteoblastica. Il gene SOST è espresso solamente nel tessuto osseo e ciò rende ragione del
fatto che la sclerostina è stata considerata un bersaglio preferenziale nella terapie anti-osteoporotiche,
per la ridotta probabilità di effetti collaterali extra-scheletrici (1).
Sulla scorta di queste osservazioni è stato prodotto romosozumab, un anticorpo monoclonale
umanizzato diretto contro sclerostina che, negli studi di fase 1, si è dimostrato in grado di aumentare la
BMD, ridurre il riassorbimento osseo e stimolare l’osteo-formazione (2).
Recentemente sono stati pubblicati i risultati dello studio di fase 2 condotto con romosozumab su un
gruppo di donne in menopausa con bassa massa ossea (3). Si tratta di uno studio multicentrico,
randomizzato, controllato contro placebo, che ha arruolato 419 donne (range 55-85 anni) con T-score
compreso fra -2 e -3.5 in almeno uno dei seguenti tre siti ossei: rachide, femore in toto, collo del
femore. I criteri di esclusione comprendevano le pregresse fratture, vertebrali e non-vertebrali, tutte le
patologie e i farmaci osteopenizzanti, valori di 25(OH)-vitamina D plasmatica < 20 ng/mL e il pregresso
uso di bisfosfonati.
Le pazienti sono state suddivise in 8 gruppi e randomizzate, in cieco, a ricevere romosozumab sottocute
a 5 diverse posologie (mensili di 70, 140 e 210 mg o trimestrali di 140 e 210 mg), ovvero placebo
(mensile o trimestrale, sottocute); la randomizzazione dei due gruppi trattati con alendronato (70
mg/settimana) o teriparatide (20 µg/die) era, ovviamente, in aperto.
L’end-point primario dello studio era l’incremento percentuale della BMD lombare a distanza di 12
mesi dalla randomizzazione. Gli end-point secondari comprendevano le variazioni della BMD a livello
vertebrale e degli altri siti ossei (femore e radio), nonché le modificazioni dei marcatori di turn-over
osseo.
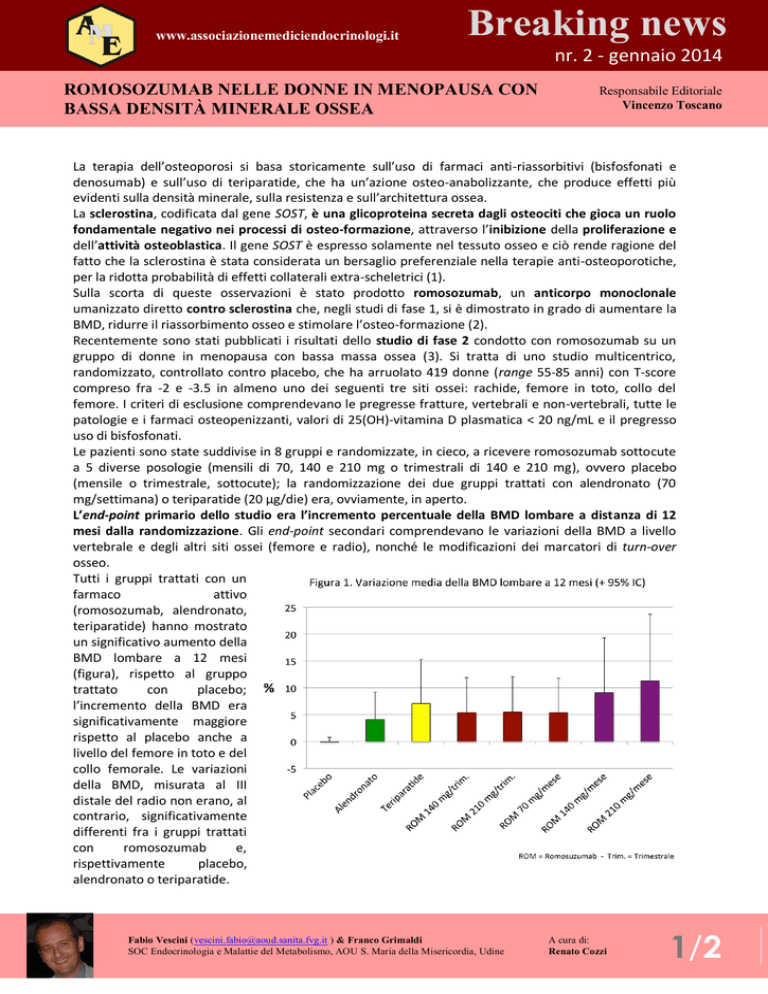
Tutti i gruppi trattati con un
farmaco
attivo
(romosozumab, alendronato,
teriparatide) hanno mostrato
un significativo aumento della
BMD lombare a 12 mesi
(figura), rispetto al gruppo
trattato
con
placebo;
l’incremento della BMD era
significativamente maggiore
rispetto al placebo anche a
livello del femore in toto e del
collo femorale. Le variazioni
della BMD, misurata al III
distale del radio non erano, al
contrario, significativamente
differenti fra i gruppi trattati
con
romosozumab
e,
rispettivamente
placebo,
alendronato o teriparatide.
Fabio Vescini ([email protected] ) & Franco Grimaldi
SOC Endocrinologia e Malattie del Metabolismo, AOU S. Maria della Misericordia, Udine
A cura di:
Renato Cozzi
1/2
www.associazionemediciendocrinologi.it
Breaking news
gennaio 2014
Il maggiore guadagno, in termini di BMD, è stato osservato nel gruppo trattato con 210 mg/mese di
romosozumab, con incrementi medi a 12 mesi, rispetto al basale, pari all’11.3% sulla colonna lombare,
al 4.1% sul femore e al 3.7% sul collo femorale. Questi valori erano significativamente maggiori di quelli
osservati nei gruppi trattati con alendronato o teriparatide.
In tutti i gruppi trattati con romosozumab si è osservato un incremento dei marcatori di osteoformazione che iniziava già dopo 7 giorni dalla somministrazione del farmaco e raggiungeva lo zenit a
distanza di 1 mese. I valori tornavano nella norma fra i 2 e i 9 mesi dall’inizio dello studio. Il marcatore
di riassorbimento osseo (ß-CTX) diminuiva, rispetto al basale, in tutti i gruppi trattati con romosozumab,
a distanza di una settimana dall’iniezione del farmaco. Nei 3 gruppi che avevano ricevuto il farmaco una
volta al mese il ß-CTX rimaneva al di sotto del valore basale anche a 12 mesi dall’inizio dello studio.
Le variazioni dei marcatori di turn-over osseo indotte da romosozumab differiscono sia da quelle dei
farmaci anti-riassorbitivi (diminuzione del marcatore di formazione e di quello di riassorbimento), sia da
quelle di teriparatide (incremento del marcatore di formazione e di quello di riassorbimento).
Le conseguenze dell’andamento divergente dei marcatori di rimodellamento osseo con romosozumab
(aumento della formazione e diminuzione del riassorbimento) confermano quanto osservato nello
studio di fase 1 (2) e, secondo gli autori, possono fornire la spiegazione dell’ampio incremento della
BMD osservato in questo studio.
La transitorietà dell’effetto osteo-formativo non è stata correlata alla comparsa di auto-anticorpi
neutralizzanti e, insieme al sostenuto effetto anti-riassorbitivo, rimane ancora non spiegata.
A parte una reazione cutanea, di grado moderato, nel sito di iniezione, non sono state rilevate differenze
nell’incidenza di eventi avversi fra i gruppi trattati con romosozumab e, rispettivamente, placebo,
alendronato e teriparatide.
In conclusione, pur in assenza di dati relativi all’incidenza di fratture, romosozumab, in
somministrazione sottocutanea mensile o trimestrale, si è mostrato in grado di indurre un rapido e
transitorio incremento dei marcatori di neoformazione ossea, insieme ad una moderata e prolungata
diminuzione di quelli di riassorbimento e, soprattutto, un marcato aumento della BMD sia rispetto al
placebo, sia in confronto con i “comparatori” attivi alendronato e teriparatide.
I risultati di questo studio sono molto promettenti e, pur in attesa di conferme in termini di efficacia
anti-fratturativa, evidenziano la necessità di nuovi studi per valutare romosozumab nel trattamento dei
pazienti con osteoporosi.
Bibliografia
1. Baron R, Rawadi G. Targeting the Wnt/beta-catenin pathway to regulate bone formation in the adult
skeleton. Endocrinology 2007, 148: 2635-43.
2. Padhi D, Jang G, Stouch B, et al. Single-dose, placebo-controlled, randomized study of AMG 785, a
sclerostin monoclonal antibody. J Bone Miner Res 2011, 26: 19-26.
3. McClung MR, Grauer A, Boonen S, et al. Romosozumab in postmenopausal women with low bone mineral
density. N Engl J Med 2014, DOI: 10.1056/NEJMoa1305224.
2/2