MARCELLIN BERTHELOT (1827-1907)
« La chimie crée son objet »
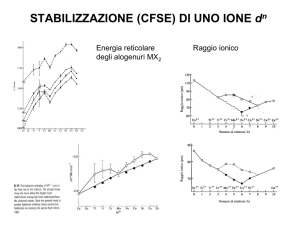
STABILIZZAZIONE (CFSE) DI UNO IONE dn
Energia reticolare
degli alogenuri MX2
Raggio ionico
SPETTROSCOPIA ELETTRONICA
Regole di selezione per una transizione elettronica :
•Spin: non può cambiare la molteciplità di spin DS = 0
•Laporte: deve cambiare la parità g/u
Le transizioni “proibite” sono, in realtà, poco probabili
Banda
emax
Spin-proibita
<1
Laporte proibita
10
Laporte permessa
100
A trasferimento di carica
103-104
[Cr(ox)3]3- e [CrF6]3n1 corrisponde a Do
MnF2
D DIPENDE DA:
Dq = 1/6{ze2<r4>/a5} a = dist.internucleare, <r> = dist media di e dal nucleo
• La carica sul metallo:
[Ru(H2O)6]2+
19800 cm-1
[Ru(H2O)6]3+
28600 cm-1
•La geometria del complesso:
Do2 Dt
[VCl4]
7900 cm-1
[VCl6]2-
15400 cm-1
•La natura del metallo:
Mn2+ < Ni2+ < Co2+ < Fe2+ <Fe3+ < Cr3+ <Co 3+
< Mo3+ < Rh3+ < Ru3+ < Pd4+ < Ir3+ < Pt4+
[MnF6]2[TcF6]2[ReF6]2-
21800 cm-1
28400 cm-1
32800 cm-1
•Il legante (serie spettrochimica)
[CoF6]313100 cm-1
[Co(H2O)6]3+
20800 cm-1
[Co(NH3)6]3+
22900 cm-1
LA SERIE SPETTROCHIMICA
Leganti diversi spostano il massimo di
assorbimento nello spettro elettronico.
C > N > O > F > Cl > Br > I
Leganti “misti” hanno effetto “medio”
GLI ORBITALI d NEI COMPLESSI
QUADRATO-PLANARI
IL CAMPO DEI LEGANTI (LIGAND FIELD):
IL CASO OTTAEDRICO
Le possibili combinazioni tra gli
orbitali del metallo e quelli dei
leganti:
Gli orbitali di frontiera (HOMO e
LUMO sono centrati sul metallo):
L’EFFETTO p
La sovrapposizione p tra un
orbitale d e un orbitale p:
Orbitali p pieni (leganti
elettronegativi, bassa energia):
Orbitali p vuoti (alta energia):
GLI ELETTRONI DI UN COMPLESSO
GLI ELETTRONI DI UN COMPLESSO
MAGNETISMO
Diamagnetismo: il moto degli elettroni appaiati viene perturbato da un
campo magnetico.
Si genera una magnetizzazione (I) che si oppone al campo esterno
B = H + 4pI
(I è una grandezza negativa)
Effetto comune a tutte le sostanze.
Paramagnetismo: anche il moto degli elettroni spaiati viene perturbato
da un campo magnetico.
Si genera una magnetizzazione (I) che si oppone al campo esterno
I = kH
(I è positivo, e molto maggiore che nel caso precedente)
Effetto proprio dei composti con elettroni spaiati.
IL MOMENTO MAGNETICO
La suscettività magnetica k è la risposta di un
mezzo al campo magnetico esterno:
k= I/H
Bilancia di Gouy: la differenza di peso tra il
campione ed uno standard dà la suscettività
magnetica per unità di volume, k
La forza (differenza di peso) che agisce sul
volume V è: F = ½kH2V = cost k
La susc. paramagnetica molare è cM = (k/d)MMcdia
MAGNETISMO
Bilancia di Gouy: la differenza di peso tra il campione
ed uno standard dà la suscettività magnetica per
unità di volume, k
La suscettività molare è data da cM = k P.M./d
Per molti composti cM è funzione della temperatura
secondo la legge di Curie: cM = C/T
Il momento magnetico è indipendente dalla
temperatura meff = cost (cMT)½ = √[n(n+2)]
LEGGE DI CURIE
Il contributo diam. cdia è dato dal contributo di ogni atomo
(costanti di Pascal)
La susc. Param. è funz della temperatura e del momento
magnetico, perché T tende a disorientare i dipoli
magnetici:
cM = cost(m2/T)
m = 2.828 cMT) = n(n+2)
n è il numero di elettroni spaiati per ogni molecola
AURANOFIN: UN COMPLESSO LINEARE CON PROPRIETÀ
FARMACEUTICHE
ISOMERIA NEI COMPLESSI
Tipo di isomeria
Descrizione
Esempio
Configurazionale
Diversi poliedri di
coordinazione
Tetraedro/quadrato
TBP/SP
Di spin
Alto/basso spin
Fe(II)
Di legame
Diversi atomi donatori
sul legante
O-NO/NO2
Geometrico
Diversa distribuzione
dei leganti
Cis/trans
fac/mer
Ottico
Enantiomeria
D/L
5T
1A
ISOMERIA IN NiCl2(PPh3)2
Verde scuro, paramagnetico
Rosso scuro
ISOMERIA NEI COMPLESSI
Isomeria geometrica: cis/trans, fac/mer
Isomeria ottica: D/L
ISOMERIA DI IONIZZAZIONE
PENTACOORDINAZIONE
Il campo cristallino favorisce
sempre la piramide a base
quadrata (SP)
Leganti con effetto p possono interagire
efficacemente in diverse orientazioni
ISOMERIA IN [Cr(en)3][Ni(CN)5] · 1.5 H2O
Temp. e press.
Ambiente
7 kbar
Dopo esser tornati a
press. ambiente
Composto disidratato
(SP)
OCTACOORDINAZIONE
IDRURI
Donatori di un elettrone
Pochi complessi puramente idrurici: [ReH9]2- , [FeH6]4-
Molti con altri leganti: H2Fe(N2)(PR3)3, H3Co(PPh3)3, H5Ir(PR3)2, H2PtCl2(PR3)2
Occupano un sito di coordinazione, ma consentono ad altri leganti di espandersi
Idruri “non classici”: il legame di
una molecola H2 funziona da donatore
[BH4]- come legante chelante: Cu(PPh3)2BH4
RAGGI X E NEUTRONI
Il complesso di Kubas: dove sono i legami
tra W e H?
H-H : 0.75(16) Å (raggi X)
0.74 in H2 libero
0.84 Å (neutroni)
J(H-D) = 33.5 Hz (43.2 Hz in HD molecolare,
2-3 Hz is cis diidruri)
n(HD) = 2360 cm-1
Kubas, Acc. Chem. Res., 1988, 21, 120:
“in an inversion of the normal order,
spectroscopic rather than crystallographic,
data provided the convincing evidence”
H COME LEGANTE
Paramagnetic shielding (correnti elettroniche)
Dihydrogen bond H----H+
IL TEMPO DI RILASSAMENTO T1
L’impulso a 180° inverte la popolazione dei
due livelli di spin. Si diagramma in funzione
del ritardo di acquisizione (delay)
Il tempo di rilassamento dipende anche dalla
distanza di altri nuclei con spin
1H
E 31P NMR
trans-PtHCl(PPh3)2 1J(1H-195Pt) = 1196 Hz; 2J(1H- 31P) = 13 Hz
LEGANTI ALL’AZOTO
•
Ammoniaca e ammine: nessun effetto p,leganti tipici per cationi +2 e +3
•
Deprotonazione di ammoniaca: ammidi (NH2-), nitreni (NH2-) e nitruri (N3-): pdonatori
•
Ammine aromatiche: piridina, imidazolo, pirazolo e pirazolato. Forti p-donatori,
stabilizzano alti stati di ossidazione: [Ag(Py)2]2+
•
Diazoto: N2 es: [Fe(EDTA)N2]-, [Ru(NH3)5N2]2+
•
Basi di Schiff, porfirine, ftalocianine: macrocicli tetra- (o penta-)dentati, con
almeno 2 N
•
Pseudoalogenuri: N3-, NCS-, CN-, NO2- (isomeria di legame)
•
Nitrili R-CN (isonitrili R-NC)
•
Nitrosile NO (lineare, piegato, a ponte)
IL LEGANTE N2
I diversi modi di coordinazione possibili.
Tra le fonti di N2 si usa N2O; N2H4, N3-, N2
CO, N2 e HCCH sono (elettronicamente)
simili
n14/n15 = 15/14
n15 = 1936 0.966 = 1870 cm-1
PORFIRINE
«out of plane»
metalloporphirine
BASI DI SCHIFF
Sono formate per condensazione di un’aldeide con un’ammina. I prodotti imminici
legano al metallo tramite i doppietti residui sull’azoto. Spesso vengono ottenute per
sintesi templata (usando il metallo come stampo)
LEGANTI AL FOSFORO
•
Fosfine alifatiche: PR3: s-donatori, poveri p-accettori
•
Fosfine aromatiche: PPh3 moderato s-donatore, moderato p-accettore, stabile
all’ossidazione, solida, non volatile, diminuisce la solubilità del composto, ne facilita la
cristallizzazione
•
Fosfine chelanti dppe, dppm: PPh2-(CH2)n-PPh2
•
Fosfine chirali
•
Fosfiti: P(OR)3 scarso s-donatore, forte p-accettore
•
PF3: simile al CO per effetto elettronico e per ingombro sterico
•
Angolo di Tollman:
PMe3 a ponte:
I LEGANTI AL FOSFORO
Il potere p-accettore delle fosfine
Effetti sterici ed elettronici
delle fosfine
INGOMBRO STERICO E INSATURAZIONE
Pt[PPh(t-Bu)2]2
Pt(PPh3)3
Pt(dppp)2
dppp =
Ph2P(CH2)3PPh2
P5 ANALOGO DEL CICLOPENTADIENE
LEGANTI ALL’OSSIGENO
• Acqua, idrosso
• Alcoli, alcolati, eteri, thf, eteri corona
• Legante oxo (O2-) p-donatore; tre formule di risonanza M-O-, M=O, MO+
gruppi M=O sono stabilizzati da stati di ossidazione > +4 e dn < 4
• Diossigeno, superosso O2-, perossido O22• Chetoni, urea, SO2
• Dichetonati [R-C(O)-CH-C(O)-R]-, chelanti, una volta coordinati a M formali
anelli con sistema p delocalizzato
• Ossoanioni (NO3-, SO42-, PO43-,CO32-, carbossilati RCOO- (mono e bidentati)
• Ossidi delle fosfine (O=PR3)
• Dimetilsolfossido (Me2S=O)
LEGANTI ALL’OSSIGENO: ALCUNI ESEMPI (1)
VO(acac)2
[Cr(O2)4]3-
CuSO45H2O
LEGANTI ALL’OSSIGENO: ALTRI ESEMPI (2)
{Cu(OOCCH3)2 H2O}2
O-Ir-O : 37°
IL DIOSSIGENO COME LEGANTE
O2, O2-, O22-
Lo stato di ossidazione del legante e del metallo si deduce
da dati strutturali (distanza O-O) e spettroscopici(n(O-O))
LEGANTI ALLO ZOLFO
• Solfuri, polisolfuri, tiolati, tioeteri (metalloenzimi)
• Ditioleni S-CR=CR-S. Impossibilità di determinare gli stati di ossidazione
• SO2 (isomeria di legame)
• Tiocianato (SCN piegato)
• Ditiocarbammato [R2N-CS2]monodentato, a ponte]
[chelante (anello a quattro termini),
SOLFURI, TIOLATI, POLISOLFURI
[Pt(S5)3]2-, un composto
chirale senza carbonio
[Au25(SR)18]+, un colloide
d’oro stabilizzato da tiolati
[Fe4S4(SR)4]2+, un
analogo sintetico delle
ferredossine. Esistono
anche gli stati ossidati
(+3) e ridotti (+1)
[Ni2(dmit)3]2-: un complesso
con un ditiolene
LEGANTI NON INNOCENTI: [ReL3]z
5 stati di ossidazione; z da +1 a -3
Spettro ESR: in ReL32-, l’elettrone spaiato è
centrato sul metallo; 185Re I = 5/2
3 stati di spin
Prisma trigonale
DMSO COME LEGANTE
SO2 COME LEGANTE
ALOGENURI
•
Fluoro: piccolo ingombro, nessun potere riducente, nessun effetto p: alti numeri di
coordinazione ([ZrF8]4-), bassa posizione nella serie spettrochimica
•
Altri alogeni: stabilizzano complessi tetraedrici, possono fungere da ponti (donatori
di tre e cinque elettroni)
Cu4I4py4
REAZIONI DI COMPOSTI ORGANICI ED
INORGANICI (1)
REAZIONI DI COMPOSTI ORGANICI ED
INORGANICI (2)
VELOCITÀ DI SCAMBIO: COMPLESSI LABILI ED
INERTI
MECCANISMI DI SOSTITUZIONE
E
U
E
U
E
U
E
U
Associativo
Interscambio
a carattere
associativo
Interscambio
a carattere
dissociativo
Dissociativo
A
Ia
Id
D
ENTALPIA ED ENTROPIA DI ATTIVAZIONE: DH‡ E
DS‡
Equazione di Arrhenius: k = A exp(-Ea/RT)
Equazione di Eyring: k =(kBT/h)exp(-DG‡/RT) =
(kBT/h)exp(-DH‡/RT + DS‡/R )
ln k/T = - DH‡/RT + ln (kB/h) + DS‡/R
Plot di Arrhenius (●) e di Eyring (■)
per la reazione di scambio di una
molecola di solvente in
[Ga(dmso)6]3+
VOLUME DI ATTIVAZIONE: DV‡
d lnk/d P = -DV‡/RT
DV‡ è positivo per reazioni dissociative, è negativo per reazioni associative
EQUAZIONI CINETICHE
MECCANISMO ASSOCIATIVO:
U-M + E U-M-E
v = -d[M-U]/dt = k[U-M][E] (dipende da E)
MECCANISMO DISSOCIATIVO:
U-M M + U k1, k-1
M+E M-E
k2
v = -d[M-U]/dt = k1 k2[M-U][E]/(k-1[U]+ k2[E])
Se k2[E] >> k-1[U] v = k1[M-U] primo ordine, non dipende da E
Se k-1[U] >> k2[E] v = k1 k2[M-U][E]/k-1[U] si ha effetto inibitore di U
Se k-1[U] k2[E] si deve usare l’espressione completa
MECCANISMO DI INTERSCAMBIO:
U-M + E
U-M--E K0
U-M--E U--M-E k3
U--M-E M-E + U k2, veloce
v = -d[M-U]/dt = K0k3[M-U][E]/(1+ K0[E])
Se K0[E] >> 1 v = k1[M-U] primo ordine, non dipende da E
Se K0[E] << 1 v = K0k3[M-U][E] secondo ordine, dipende da E
Se k-1[U] k2[E] si ha dipendenza complessa
REAZIONI DI SOSTITUZIONE:
I COMPLESSI QUADRATO - PLANARI
Pt(py)2Cl2 + L Pt(py)2(Cl)L Due meccanismi paralleli: kobs = k1 + k2[L]
EFFETTO E INFLUENZA TRANS
EFFETTO E INFLUENZA TRANS
L’influenza trans (donazione s) è un
fenomeno termodinamico (destabilizza il
reagente). T e X competono per uno
stesso orbitale
L’effetto trans (retrodonazione p)è un
fenomeno cinetico (stabilizza lo stato di
transizione). Un accettore rimuove
l’eccesso di elettroni
L’EFFETTO TRANS: IMPLICAZIONI SINTETICHE
CN-, C2H4, CO, NO >PR3H- > tu > CH3- >Ph > SCN- > NO2- > I- >Br- > Cl- > NH3 >
OH- > H2O
Sintesi di cis-Pt(NH3)2Cl2
[PtCl4]2- + NH3 [Pt(NH3)Cl3]- cis-Pt(NH3)2Cl2
Sintesi di trans-Pt(NH3)2Cl2
[Pt(NH3)4]2+ +Cl- [Pt(NH3)3Cl]- trans-Pt(NH3)2Cl2
LA SCALA DI NUCLEOFILICITÀ
log (kL/k0) = shPt
hPt, fattore di nucleofilicità, è determinato per reazioni di sostituzione su
[Pt(py)2Cl2], ma vale per molti complessi di platino:
s è il fattore di discriminazione
CRISTAL FIELD ACTIVATION ENERGY
Velocità (sperimentale)
Velocità (calcolata con MO, AO)
Velocità (calcolata con CF)
CRISTAL FIELD ACTIVATION ENERGY
Si calcola la stabilizzazion del campo cristallino nel reagente e nello stato di
transizione (in unità Dq): CFAE = (CFSE)‡ - CFSE
Le velocità di scambio di solvente negli acquocomplessi:
Ione
Config.
CFAE (Dq)
k (s-1)
DV‡(cm3/mol)
DH‡(KJ/mol)
V2+
t2g3
1.80 (OC)
87
-4.1
62
Cr2+
t2g3 eg1
-3.14 (SP)
> 108
Mn2+
t2g3 eg2
0
2 107
-5.4
33
Fe2+
t2g4 eg2
-2.08(OC)
4.4 106
+3.8
41
Co2+
t2g5 eg2
-2.56(PP)
3.2 106
+6.1
47
Ni2+
t2g6 eg2
1.80(OC)
3.2 104
+7.2
57
Cu2+
t2g6 eg3
-3.14(SP)
>107
Zn2+
d10
0
>107
Si riesce a prevedere quali ioni sono labili e quali inerti. Meno efficace per
determinare l’ordine di reattività
CORRELAZIONE LINEARE
DI ENERGIA LIBERA (L.F.E.R.)
Keq = kd / ki
DG° = DG‡i - DG‡d
Se DG‡i = cost
log Keq + C = log ki
[Co(NH3)5 X]2+ + H2O
[Co(NH3)5 H2O]3+ + X-
SOSTITUZIONE IN COMPLESSI [CrL6]3+
Il complesso [Cr(H2O)6]3+ da’ sostituzioni associative, il complesso
[Cr(NH3)5(H2O)]3+ dissociative; DS‡ sono però confrontabili
MECCANISMO DI INTERSCAMBIO
Raramente si riesce a osservare una variazione
dell’ordine in funzione della concentrazione di
legante entrante
Esempio: [Cr(NH3)5(H2O)]3+ + SCN-
[Cr(NH3)5SCN]2+ + H2O
Per le reazioni di sostituzione [Ni(H2O)6]2+ + L, k3 = kf/K0
SOSTITUZIONI CATALIZZATE
1.
DA BASI
[Co(NH3)5X]2+ + OH- [Co(NH3)4(NH2)X] + + H2O
[Co(NH3)4(NH2)X] + [Co(NH3)4(NH2)] 2+ + X[Co(NH3)4(NH2)] 2+ + H2O [Co(NH3)5OH] 2+
2.
DA RIDUCENTI
[Cr(II)(H2O)6]2+ + X- [Cr(II)(H2O)5X]+
[Cr(II)(H2O)5X]+ + [Cr(III)(H2O)6]3+ [Cr(III)(H2O)5X]2+ + [Cr(II)(H2O)6]2+
Complessi di Co(III) sostituiscono più rapidamente in presenza di riducenti (carbone)
1983, for his work on the mechanisms of electron transfer reactions,
especially in metal complexes
1992, for his contributions to the theory of electron transfer reactions in
chemical systems
REAZIONI REDOX: MECCANISMO A SFERA
ESTERNA
PRINCIPIO DI FRANCK-CONDON: il movimento dei nuclei è molto più lento
del movimento degli elettroni
DG‡ è funzione di DG°
Il DG‡ di attivazione minore si ha
dove le due curve si intersecano;
È funzione della ripidità della
parabola e della ampiezza della
deformazione
Anche transizioni elettroniche possono contribuire in modo significativo alle barriere di
attivazione; la velocità di autoscambio di Co(NH3)62/3+ è molto bassa
Co(II) passa ad uno stato
eccitato “a basso spin”
Il trasferimento elettronico tra
Co(II) in basso spin e Co(III)
è spin-permesso
There is a disagreement between our, 6 10-3 (M s)-1, and the experimental rate, 5 10-5 (M s)-1. Either something is
not correct with the theoretical estimate or the experimental rate constant is too small. In the more likely case that the
theory misses some details……
REAZIONI DI AUTOSCAMBIO (DG° = 0)
Si può calcolare l’energia di attivazione DG‡ di una reazione redox
valutando:
1. Il lavoro necessario per avvicinare i reagenti
2. L’energia per ricostruire la sfera di idratazione
3. L’energia per deformare i parametri strutturali dei reagenti
L’accordo è discreto (entro un fattore 100) considerando il gran
numero di parametri da calcolare
REAZIONI REDOX DI AUTOSCAMBIO
Le reazioni che implicano maggiori differenze
di distanze di legame (Dd, elettroni eg) sono le più lente:
DG‡ (LA VELOCITÀ) DIPENDE DA:
•
La forma della curva (=le costanti
di forza dei legami, l’ordine di legame M-L)
•
La distanza tra i minimi
(= l’entità della deformazione)
•
La differenza tra i minimi
(= il DG° di reazione)
REAZIONI REDOX ASIMMETRICHE (DG0)
le deformazioni subite dai due reagenti sono simili a quelle nell’autoscambio:
DG(AB‡) = ½[DG(AA‡) + DG(BB‡)]
REAZIONI REDOX ASIMMETRICHE (EQ. DI MARCUS
SEMPLIFICATA)
k12 = (k11k22K12f)1/2
DG12‡ = ½ (DG11‡ + DG22‡ + DG12°)
REAZIONI REDOX: MECCANISMO A SFERA
INTERNA
I complessi condividono un legante. L’esperimento di Taube:
[Co(NH3)5Cl]2+ + [Cr(H2O)6]2+ [Cr(H2O)5Cl]2+ + [Co(H2O)6]2+ + 5 NH3
La reazione redox è molto più veloce della sostituzione del Cr(III)
Si forma un “complesso precursore”:
Se, nell’ambiente di reazione, sono presenti ioni Cl- isotopicamente marcati,
questi non vengono incorporati nel complesso di Cr(III)
COMPLESSO PRECURSORE E SUCCESSORE
MO-L + M’R MO-L-M’R complesso precursore
MO-L-M’R MR-L-M’O complesso successore. Raramente è il passaggio
lento. Può esser generato in situ da MO-L-M’O
MR-L-M’O MR + L-M’O si formano i prodotti finali
ATTACCO VICINO E ATTACCO LONTANO
Leganti multiatomici possono aver più siti di attacco. Possono presentarsi
diverse possibilità per il complesso pontato.
[(NH3)5CoNCS]2+ + Cr2+ Co2+ + Cr-SCN
Solo S ha un doppietto disponibile, si forma un unico isomero
[(NH3)5CoSCN]2+ + Cr2+ Cr-SCN (meno stabile, 30 %) + Cr-NCS
Si formano entrambi gli isomeri
O
Co
N
+
NH2
Cr2+
Co2+ +
O
N
Qual è il meccanismo di trasferimento dell’elettrone?
NH2
Cr
MECCANISMO CHIMICO O DI RISONANZA?
MO-L-M’R MO-L--M’O MR-L-M’O
Meccanismo chimico (a stadi). Si
forma il legante ridotto
MO-L-M’R MR-L-M’O Trasferimento
per risonanza.
•La velocità dipende dalla distanza e dalla coniugazione nel legante
•Se l’elettrone rimane intrappolato dal legante, si vede via ESR
CARATTERIZZAZIONE (SPETTROSCOPICA) DEGLI
INTERMEDI
Sfera esterna e sfera interna
possono essere concorrenti
Forma e giacitura del segnale ESR sono
compatibili con un radicale organico
SFERA ESTERNA O SFERA INTERNA?
1. Identificare i prodotti di sostituzione o gli intermedi
2. Confronto tra velocità di sostituzione e velocità della reazione
redox
3. Assenza di leganti con coppie di non legame (ammoniaca,
fenantrolina)
4. Dipendenza della velocità dal pH (differente capacità pontante
di H2O/OH)
5. Scala di reattività con leganti diversi (F/Cl/Br, SCN/N3)
6. Corrispondenza tra k (e DG‡) sperimentali e calcolati
COMPOSTI DI INTERVALENZA
Il complesso di Creutz:
FILI METALLICI
Il sale di Krogmann:
K2[Pt(CN)4]X0.3·(H2O)n
(X = Cl, Br)
REAZIONI DI ISOMERIZZAZIONE: ISOMERIA DI
LEGAME
[Co(NH3)5-17O-N-O]2+ [Co(NH3)5-O-N-17O]2+ [Co(NH3)5-NO17O]2+
Lo scambio O-17O ha velocità confrontabile con lo scambio O-N.
Meccanismo intermolecolare con intermedio p
Isomeria di legame in
[Os(NH3)5NR2Ph]2/3+.
L’isomerizzazione è attivata da
redox elettrochimiche.
Il complesso di Os(II) presenta
entrambi gli isomeri, quello di
Os(III) solo quello legato a N
PROCESSI DINAMICI (FLUSSIONALITÀ)
(a) Stato limite a bassa T (w0)
(b) Regime di scambio lento k = p(wE-w0)
(d) Coalescenza k = (Dn0)p/2
(e) Regime di scambio veloce k = p(Dn0)2/2(wE-w0)
(f) Stato limite ad alta T (w0)
DISSOCIAZIONE DI UN CHELANTE
a) inversione e isomerizzazione
avvengono con la stessa velocità
b) In [Rh(ox)3]3- racemizzazione e
scambio di 18O interno col solvente
avvengono con la stessa velocità
REAZIONI DI ISOMERIZZAZIONE: I COMPLESSI
OTTAEDRICI
Rotazione di Bailar: devono
deformarsi gli angoli interni di tutti
gli anelli
Rotazione di Ray-Dutt: non
richiede deformazione degli anelli
ISOMERIZZAZIONE DI fac- e mer-RuQ3
Q = di-tbut-chinone
+25°C
-85°C
Ray-Dutt twist:
ISOMERIZZAZIONE IN COMPLESSI QUADRATOPLANARI
1.
Doppia sostituzione (catalizzata da L)
2.
3.
Pseudorotazione diretta (A → B)
Dissociazione
ISOMERIA IN BIPIRAMIDI TRIGONALI
Alta T: una sola J
media
Bassa T: una J
grande e una
piccola
HRhL4 L=P(OEt)3
1H NMR
J(1H-31P) e J(1H-103Rh)
Co(CF3)(PF3)(CO)3, due isomeri con
CF3 assiale, PF3 ass. ed eq.
NMR di CF3: J(19F-19F) e J(19F-31P)
REAZIONI DI ISOMERIZZAZIONE: I COMPLESSI
TETRAEDRICI
Complessi del tipo Ni(PR3)2X2
isomerizzano da tetraedrico a
quadrato planare.
Ni(dpp)2Cl2 esiste, a temperatura
ambiente in MeCN, nei due isomeri:
Planare
tetraedrico
k1, k-1, K1
La composizione della miscela di
equilibrio può essere alterata per
irraggiamento.
K1 = 0.75 k1 = 4.5 105 s-1
k-1 = 6 105 s-1
Lo spettro NMR di Ni(PMePh2)2Br2 a Temp. variabile