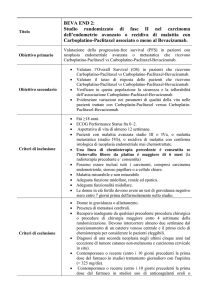
BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti
con carcinoma mammario metastatico in combinazione con paclitaxel.
(09-09-2008)
Specialità: Avastin(Roche spa)
Forma farmaceutica:
• 1 flaconcino , soluzione per infusione 400mg in 16ml - Prezzo: euro 2.021
• 1 flaconcino , soluzione per infusione 100mg in 4ml - Prezzo: euro 504
ATC: L01XC07
Categoria terapeutica: Citostatici: anticorpi monoclonali
Fascia di rimborsabilità: H OSP-1
Indicazioni ministeriali:
Avastin (bevacizumab) in combinazione con chemioterapia a base di fluoropirimidine è indicato per il
trattamento di pazienti con carcinoma metastatico del colon e del retto.
Avastin in combinazione con paclitaxel è indicato per il trattamento in prima linea di pazienti
con carcinoma mammario metastatico.
Avastin, in aggiunta a chemioterapia a base di platino, è indicato per il trattamento in prima linea di
pazienti con carcinoma polmonare non a piccole cellule, non resecabile, avanzato, metastatico o in
ricaduta, con istologia a predominanza non squamocellulare.
Avastin in combinazione con interferone alfa-2a è indicato per il trattamento in prima linea di pazienti con
carcinoma renale avanzato e/o metastatico.
Decisioni PTORV
Data riunione: 09-09-2008
Decisione: Allargamento indicazioni
Commenti:
La Commissione sulla base dei risultati di efficacia, che hanno mostrato quasi un raddoppiamento della
PFS e della stretta correlazione che esiste tra PFS e OS in questa tipologia di tumore, approva
l’allargamento di indicazione di bevacizumab in combinazione con paclitaxel per il trattamento in prima
linea di pazienti con carcinoma mammario metastatico.
Inquadramento della patologia
Il tumore della mammella è la neoplasia di gran lunga più frequente nel sesso femminile; rappresentando
nel periodo 1998-2002 il 24,9% del totale delle diagnosi tumorali [2]. Anche in termini di mortalità è
risultata la prima fra le cause tumorali con il 17,1% del totale dei decessi neoplastici. Il trattamento del
carcinoma mammario è comunemente basato su fattori prognostici e predittivi, quali la stadiazione, lo
stato recettoriale e l’espressione del recettore HER-2. Circa il 20-25% dei carcinomi mammari presenta,
infatti, una sovraespressione dell’HER2, una proteina dei recettori transmembrana tipicamente associata
ad una patologia più aggressiva e ad una sopravvivenza più breve. Il 15% circa dei carcinomi mammari
presenta, inoltre, una sovraespressione di un altro recettore, il recettore EGFR-1 o ErB-1 (recettore per il
fattore di crescita epidermico di tipo 1).
Caratteristiche del prodotto
Bevacizumab è un anticorpo monoclonale ricombinante umanizzato, registrato con procedura
centralizzata a livello europeo. E' inibitore dell’angioneogenesi e agisce legando il fattore di crescita
vascolare endoteliale (VEGF), impedendo così l’interazione di questo ai recettori VEGF- 1 e VEGF-2
presenti sulle cellule endoteliali. L’espressione del recettore VERG è molto bassa nei tessuti normali,
mentre risulta importante in molti tumori inclusi quelli del colon-retto, mammella, polmone, rene.
L’azione di bevacizumab di neutralizzazione del VEGF si traduce in una relativamente specifica inibizione
dell’angiogenesi a livello tumorale e quindi della crescita e sviluppo tumorali[1].
Il farmaco ha ricevuto l'allargamento di indicazione nel trattamento di prima linea del carcinoma alla
mammella metastatico, associato a Paclitaxel. Il Paclitaxel è registrato ed ampiamente utilizzato nel
trattamento dei pazienti con cancro alla mammella in entrambi i setting metastatico e adiuvante , per la
sua buona efficacia e per un profilo di sicurezza accettabile. E' stato, anche, associato con successo alla
terapia con anticorpo monoclonale trastuzumab nei pazienti con espressione del recettore HER-2 e
pertanto è stato scelto come farmaco da associare a bevacizumab per verificarne l'efficacia vs la
monoterapia con paclitaxel [1]. Le dosi raccomandate del bevacizumab per l'indicazione oggetto di
valutazione sono 10 mg/kg una somministrazione ogni 2 settimane oppure 15 mg/kg una
somministrazione ogni 3 settimane in infusione ev.
Linee guida di trattamento esistenti
Le linee Guida NCCN 2008 riportano, nel caso di pazienti con malattia ricorrente o di stadio IV, che
presentino recettori ormonali ER e PR negativi oppure ER e/o PR positivi ma refrattarietà alla terapia
endocrina, e recettore HER2 negativo, diverse terapie di preferenza sia come agenti singoli (doxorubicina,
epirubicina, doxorubicina pegilata, paclitaxel, docetaxel, capecitabina, vinorelbina gemcitabina, paclitaxel
legato ad albumina) sia in associazione. Il farmaco da preferirsi in associazione a bevacizumab è
considerato il paclitaxel, in quanto in un singolo RCT di fase III è stato documentato un aumentato tempo
alla progressione dell'associazione rispetto al trattamento singolo. Numerosi sono anche i regimi di
associazione
consigliati:
CAF/FAC
(ciclofosfamide/doxorubicina/fluorouracile),
FEC
(fluorouracile/epirubicina/ciclofosfamide); AT (doxorubicina/docetaxel; doxorubicina/paclitaxel); CMF
(ciclofosfamide/methotrexate/fluorouracile); docetaxel/capecitabina; GT (gemcitabina/paclitaxel) [3].
Dati di efficacia
La Scientific Discussion dell'EMEA riporta a supporto della nuova indicazione, uno studio Pivotal
randomizzato controllato in aperto che ha valutato l'efficacia dell'aggiunta di bevacizumab alla
monoterapia con paclitaxel vs la sola monoterapia in 722 pazienti con carcinoma della mammella
metastatico non precedentemente trattate con terapia citotossica per malattia metastatica. Erano
invece permesse precedenti terapie ormonali o chemioterapie citotossiche in fase adiuvante. Le pazienti
che avevano ricevuto terapia adiuvante a base di taxani, dovevano essere libere da malattia da almeno
12 mesi, dopo la conclusione della terapia a base di taxani. Le pazienti con HER-2 positivo erano elegibili
soltanto se avevano già ricevuto terapia con trastuzumab. I dettagli dello studio sono mostrati in tabella.
Il bevacizumab associato a paclitaxel ha mostrato di aumentare significativamente la sopravvivenza
libera da progressione (p<0.001) e la percentuale di risposte obiettive (p<0.001), ma non la
sopravvivenza complessiva. Bisogna sottolineare, peraltro, che il dosaggio e lo schema terapeutico di
paclitaxel utilizzato nello studio (sia nel regime di associazione che di monoterapia) non corrisponde a
quello registrato in scheda tecnica per la monoterapia (175 mg/m2/in infusione di 3 ore al giorno 1 da
ripetersi ogni 3 settimane) anche se, complessivamente il dosaggio settimanale per ciclo di terapia dei
due schemi posologici risulta quasi sovrapponibile (di poco superiore nello studio clinico) [1, 4].
Due studi di supporto vengono, inoltre, descritti nella Scientific discussion: uno studio non controllato
sull'efficacia e farmacocinetica del bevacizumab a tre differenti dosaggi in monoterapia e uno studio di
fase III randomizzato e controllato che ha valutato l'associazione bevacizumab+capecitabina vs la sola
capecitabina. Sebbene l'aggiunta di bevacizumab a capecitabina abbia prodotto un aumento significativo
nelle percentuali di risposta, non si sono osservate differenze significative né sulla sopravvivenza libera
da malattia né sulla sopravvivenza globale [1,5]. I dettagli degli studi sono mostrati in tabella.
Referenza
Pazienti e trattamento
K. Miller
New England
Journal of
Medicine
2007 [4]
722 pazienti con cancro alla
mammella ricorrente e
metastatico.
Trattamento: Paclitaxel
90mg/m2 giorni 1,8,15 ogni 4
settimane [354]; Paclitaxel
(stesso schema)+ Bevacizumab
10mg/kg giorni 1, 15 [N=368].
K.D. Miller
Journal of
Clinical
Oncology
2005 [5]
462 pazienti con carcinoma
metastatico alla mammella già
precedentemente trattato.
Trattamento: Capecitabina 2500
mg/m2/gg o (1875 mg/m2/gg se
creatinina tra 30-50 mL/min) dal
giorno 1 fino al 14° ogni 3
settimane [N=230];
Capecitabina + Bevacizumab
15mg/kg ogni 3 settimane
[N=232]
Disegno
Randomizzato,
aperto, gruppi
paralleli.
Multicentrico,
randomizzato,
aperto,
Fase
Jadad
score
*
Misure di esito
Risultati principali
III
End-point primario:
PFS (sopravvivenza
indipendente da
progressione)
End-point secondari:
percentuale di
risposte obiettive,OS
(sopravvivenza
complessiva),
tossicità .
Paclitaxel+Bevacizumab vs paclitaxel:
significativo prolungamento del PFS
mediano (PFS 11,8 mesi vs 5.9 mesi,
p<0.001);
significativo aumento risposta obiettiva
(36.9% vs 21.2% p<0.001);
OS mediana simile: 26.7 mesi vs 25.2
p=0.16)
Effetti avversi di grado 3-4
significativamente più frequenti:
ipertensione (p<0.001),
proteinuria (p<0.001), mal di testa
(p=0.008), ischemia cerebrovascolare
(p=0.02), infezioni (p<0.001),
stanchezza (p=0.04)
2
III
End-point
primario:PFS
End-point
secondario: OS, ORR
(percentuale
risposta obiettiva),
incidenza di eventi
avversi.
l'associazione Capecitabina-Bevacizumab
vs capecitabina:nessuna differenza
significativa nel PFS (4.9 mesi vs 4.2
mesi); nessuna differenza sulla
sopravvivenza complessiva (15.1 vs 14.5
mesi); aumento significativo ORR (19.8%
vs 9.1% p=0.001).
Maggior frequenza dell'ipertensione di
grado 3-4 nel gruppo bevacizumab
(17.9% vs 0.5%)
2
*Jadad Scale: strumento per la verifica della qualità della pubblicazione; tra si basa sulla considerazione che i tre elementi principali che devono essere riportati per avere
maggiori garanzie sulla buona qualità di uno studio clinico siano la randomizzazione, la condizione di doppia cecità, e la gestione dei drop-out. Si considerano buone le
pubblicazioni che ottengono almeno 3 punti, mentre si considerano di scarsa qualità quelle che raggiungono un punteggio uguale o inferiore a due.
Valutazione della qualità degli studi
Entrambi gli studi analizzati presentano un punteggio della Jadad scale uguale a 2 ossia non vengono
considerati di qualità sufficiente, in particolare perché non è prevista la doppia cecità e non vengono
descritti i criteri usati per la randomizzazione.
Dati di sicurezza
La Scientific discussion riporta che il profilo di sicurezza relativo all'associazione bevacizumab+paclitaxel
non aggiunge nuovi effetti tossici inattesi. I più comuni effetti avversi verificatisi nei 3 studi analizzati per
valutare la sicurezza sono stati problemi gastrointestinali (nausea, vomito, astenia). Gli eventi
avversi comunemente correlati alla chemioterapia, si sono verificati con la stessa frequenza in entrambi i
bracci per ciascuno studio [1]. Bisogna segnalare che nello studio pivotal si sono osservati diversi eventi
avversi di grado 3-4 con una frequenza significativamente superiore nel gruppo bevacizumab:
ipertensione (p<0.001), proteinuria (p<0.001), mal di testa (p=0.008), ischemia cerebrovascolare
(p=0.02), infezioni (p<0.001), stanchezza (p=0.04).Anche nello studio vs capecitabina in monoterapia
l'ipertensione è stata più frequente nel gruppo bevacizumab+capecitabina (17.9% vs 0.5%).
Indicazione studi in corso
Gli studi in corso per bevacizumab nel trattamento del cancro alla mammella in fase metastatica e
adiuvante riportati nei registri americano e italiano sono numerosissimi (oltre 100 nel clinicaltrials.gov)
[6, 7]. Vengono di seguito riportati in tabella gli studi di fase III relativi alla fase metastatica e adiuvante
in cui bevacizumab viene confrontato vs trattamenti standard in pazienti precedentemente trattate e
naive.
Studi in corso per bevacizumab nel trattamento del cancro alla mammella
Registro /
Nazione
clinicalTrials.gov
AIFA
clinicalTrials.gov
clinicalTrials.gov
AIFA
clinicalTrials.gov
AIFA
clinicalTrials.gov
Pazienti e trattamento
Pz con cancro alla mammella metastatico già
precedentemente trattato con terapia
chemioterapica [N=650]
Le pz sono state randomizzate a ricevere:
- bevacizumab + chemioterapia
- placebo + chemioterapia
Pz con cancro alla mammella metastatico mai
precedentemente trattato [N=560]
Le pz sono state randomizzate a ricevere:
- Bevacizumab 10mg/kg ogni 2 settimane +
paclitaxel 90mg/m2 1 volta a settimana per 3
settimane in cicli di 4 settimane
- bevacizumab 10mg/kg ogni 2 settimane +
capecitabina 1000mg m2 2 volte al giorno nei
giorni 1 e 14 in cicli di 3 settimane
Pz con cancro alla mammella metastatico mai
precedentemente trattato [N=705]
Le pz sono state randomizzate a ricevere:
- bevacizumab 7,5 mg/kg ogni 3 settimane +
docetaxel 100mg/m2 ogni 3 settimane
- bevacizumab 15mg/kg ogni 3 settimane
+ docetaxel 100mg/m2 ogni 3 settimane
-placebo IV ogni 3 settimane + docetaxel
100mg/m2 ogni 3 settimane
Pz con cancro alla mammella metastatico HER2+
mai precedentemente trattato [N=410]
Le pz sono state randomizzate a ricevere:
- bevacizumab 15mg/kg ogni 3 settimane +
herceptin 8mg/kg come dose iniziale, dosi
successive di 6 mg/kg ogni 3 settimane +
docetaxel 100mg/m2 ogni 3 settimane
- herceptin 8mg/kg come dose iniziale, dosi
successive di 6 mg/kg ogni 3 settimane +
docetaxel 100mg/m2 ogni 3 settimane
Pz con cancro alla mammella metastatico con
sovraespressione di HER2+ mai precedentemente
trattato [N=489]
Le pz sono state randomizzate a ricevere:
- carboplatino + paclitaxel + placebo +
trastuzumab
- carboplatino + paclitaxel + trastuzumab +
Disegno
Fase
Misure di esito
Note
RCT, doppio cieco,
controllato con
placebo
III
PFS (sopravvivenza libera da
progressione)
In fase di
reclutamento
RCT, aperto, gruppi
paralleli
III
Non inferiorità del braccio B rispetto
al braccio A in termini di OS
(sopravvivenza globale)
Non più in fase di
reclutamento
RCT, doppio cieco,
controllato con
placebo, gruppi
paralleli
III
PFS (sopravvivenza libera da
progressione)
Attivato. Non più
in fase di
reclutamento
RCT, aperto, gruppi
paralleli, con
controllo attivo
III
PFS (sopravvivenza libera da
progressione)
In fase di
reclutamento
PFS (sopravvivenza libera da
progressione)
In fase di
reclutamento
RCT, aperto,
controllato con
placebo
III
clinicalTrials.gov
bevacizumab
Pz in postmenopausa con cancro alla mammella
metastatico mai precedentemente trattato
[N=378]
Le pz sono state randomizzate a ricevere:
- Letrozolo 2,5mg/ die os
- Letrozolo 2,5 mg/die os + bevacizumab
15mg/kg ogni 3 settimane
Pz con cancro alla mammella metastatico già
precedentemente trattato con terapia
chemioterapica [N=400]
clinicaltrials.gov
I pz sono stati randomizzati a ricevere:
- capecitabina
- capecitabina + bevacizumab
RCT, aperto, con
controllo attivo
RCT, aperto, con
controllo attivo
III
PFS (sopravvivenza libera da
progressione)
Non più in
reclutamento
III
tempo di progressione della
malattia,tasso di risposta oggettiva,
durata della risposta,% di
sopravvivenza ad 1 anno
Attivato, non più
in reclutamento
Studi in corso per bevacizumab nel trattamento in terapia adiuvante del cancro alla mammella:
Registro /
Nazione
clinicalTrials.gov
clinicalTrials.gov
clinicaltrials.gov
Pazienti e trattamento
Pz con cancro alla mammella operabile [N=2530]
Le pz sono state randomizzate a ricevere:
- bevacizumab 5mg/kg a settimana + terapia
adiuvante convenzionale
- terapia adiuvante convenzionale
Pz con cancro alla mammella HER2 positivo
[N=3500]
Le pz sono state randomizzate a ricevere:
- docetaxel + trastuzumab + carboplatino
- bevacizumab + docetaxel + trastuzumab +
carboplatino
- docetaxel + trastuzumab + 5 fluorouracile +
epirubicina + ciclofosfamide
- docetaxel + trastuzumab + 5 fluorouracile +
epirubicina + ciclofosfamide + bevacizumab
Pz con tumore alla mammella di stadio I, stadio II
o stadio IIIA che può essere rimosso con
operazione chirurgica [N=1200]
Le pz sono state randomizzate a ricevere:
- Bevacizumab + cliclofosfamide + docetaxel +
doxorubicina e sottoposti a chirurgia
convenzionale
- ciclofosfamide + docetaxel + doxorubicina e
sottoposti a chirurgia convenzionale
Disegno
RCT, doppio cieco, con
controllo attivo
RCT, doppio cieco, con
controllo attivo, gruppi
paralleli
RCT
Fase
III
III
III
Misure di esito
Note
IDFS (sopravvivenza libera
da malattia invasiva)
In fase di
reclutamento
IDFS (sopravvivenza libera da
malattia invasiva
In fase di
reclutamento
Risposta completa della
patologia primaria a livello
mammella (pCR)
In fase di
reclutamento
- bevacizumab + capecitabina + ciclofosfamide +
docetaxel + doxorubicina e sottoposti a terapia
convenzionale
- capecitabina + ciclofosfamide + docetaxel +
doxorubicina e sottoposti a terapia convenzionale
Altri report HTA
Il NICE riporta di non aver ancora ricevuto arte della ditta l'analisi economica completa richiesta al
momento della sottomissione del dossier e pertanto non può fornire alcuna raccomandazione di uso del
bevacizumab per il trattamento di I linea del carcinoma mammella associato a paclitaxel [8].
Il report HAS (Haute Autorité de Santé) francese conclude che bevacizumab apporta un miglioramento
alla salute di grado moderato (classificazione HAS III) nel trattamento del carcinoma della mammella
metastatico con HER2 negativo o non elegibili al trattamento con trastuzumab [9].
Analisi economiche
Non sono ad oggi pubblicate analisi farmacoeconomiche relative all'uso di bevacizumab nell'indicazione
oggetto di valutazione.
Analisi dei costi (costi delle alternative, potenziale impatto di budget etc.)
Principio
attivo
Dosaggio
BEVACIZUMAB
15mg/kg ogni 3
settimane (2 fl da 400mg
e 3 fl da 100mg)
BEVACIZUMAB
10mg/kg ogni 2
settimane (1fl da 400mg
e 3 fl da 100mg)
Costo all'ospedale per
ciclo di terapia (senza
risk sharing)
€ 3.366,38 (CICLO DI 3
SETTIMANE)
Spreco di
farmaco per
ciclo di terapia
50mg
€152,88
€ 2.141,83 (CICLO DI 2
SETTIMANE)
Costo all'ospedale
per anno di
terapia
€ 30.297
€ 26.773
Note
il costo all'anno è stato valutato
secondo la seguente modalità di
rimborso fornita dalla ditta:
primi 2 cicli di terapia: risk sharing
al 50%
cicli dal 3° al 10° a carico dell'SSN
i cicli successivi a carico della ditta
produttrice
il costo all'anno è stato valutato
secondo la seguente modalità di
rimborso fornita dalla ditta:
primi 3 cicli di terapia: risk sharing
al 50%
cicli dal 4° al 14° a carico dell'SSN
i cicli successivi a carico della ditta
produttrice
prezzi forniti da ditta produttrice, agosto 2008
costi dell'alternativa utilizzata nello studio clinico:
Principio
attivo
PACLITAXEL
PACLITAXEL
Dosaggio
90mg/m2 (1fl da 150mg
+ 1 fl da 30mg) nei giorni
1, 8 e 14 in cicli di 4
settimane
175mg/m2 ogni 3
settimane (1 fl da 300mg
e 1 fl da 30mg)
DOSAGGIO DA SCHEDA
TECINCA
prezzo fornito da ditta produttrice agosto 2008
Costo all'ospedale per
ciclo di terapia
€1.368,24(CICLO DI 4
SETTIMANE)
€ 836.13(CICLO DI 3
SETTIMANE
Spreco di
farmaco per
ciclo di terapia
18mg
€45,60
15mg
€38,01
Costo all'ospedale
per anno di
terapia
Note
€ 17.787,12
QUESTO DOSAGGIO SI ASSOCIA
AL TRATTAMENTO CON
BEVACIZUMAB 10mg/m2
€ 14.492,92
QUESTO DOSAGGIO SI ASSOCIA
AL TRATTAMENTO CON
BEVACIZUMAB 15mg/m2
e si usa anche in monoterapia
costi di altre possibili alternative
Principio
attivo
DOCETAXEL*
EPIRUBICINA*
+ DOCETAXEL*
EPIRUBICINA*+
PACLITAXEL*
DOCETAXEL* +
CAPECITABINA
*
PACLITAXEL* +
GEMCITABINA#
Dosaggio
100mg/m2 ogni 3
settimane (2 fl da 80mg e
1 fl da 20mg)
Epirubicina: 90 mg/m2
ogni 3 settimane (3 fl da
50mg e 1 fl da 10mg)
Docetaxel: 75mg/m2 (1 fl
da 80mg e 3 fl da 20mg
)ogni 3 settimane
Epirubicina: 90mg/m2 (3
fl da 50mg e 1 fl da
10mg) ogni 3 settimane
Paclitaxel: 175mg/m2(1 fl
da 300mg e 1 fl da
30mg) ogni 3 settimane
Docetaxel 75mg/m2 (1 fl
da 80mg e 3 fl da 20mg
)ogni 3 settimane
Capecitabina 1250mg/m2
(4cpr da 500mg e 2cpr da
150mg) 2 volte al giorno
per 2 settimane seguite
da 1 settimana di
sospensione.
Paclitaxel: 175mg/m2
ogni 3 settimane
Gemcitabina: 1250mg/m2
nei giorni 1 e 8 in cicli di
3 settimane
Costo all'ospedale per
ciclo di terapia
Spreco di
farmaco per
ciclo di terapia
€ 1.139,07
Costo all'ospedale
per anno di
terapia
€ 19.742,67
€ 1.135,28
€ 19.678,19
€1.065,60
€18.470,40
€ 1.270,37
€ 22.019,75
€ 1.398,61
* prezzi ex factory forniti dalla ditta produttrice
#prezzo al 50% iva esclusa da banca dati Farmadati, agosto 2008
Gemcitabina:
300mg
€ 36,24
€ 24.242,57
Note
Bibliografia
1. Scientific Discussion EMEA Avastin: EMEA/H/C/582/II/08
2. http://www.registri-tumori.it/incidenza19982002/rapporto/Schede%20specifiche%20per%20tumore/Tumore%20della%20mammella%20femmin
ile.pdf (accesso 28/08/2008)
3. Linee Guida NCCN http://www.nccn.org (accesso 28/08/2008)
4. Miller K. et al, New Engl J Med 2007; 357: 2666-76
5. Miller K. et al, J Clin Oncol 2005; 23: 792-799
6. http://www.clinicaltrials.gov (accesso 28/08/2008)
7. http://www.agenziafarmaco.it (accesso 28/08/2008)
8. http://www.nice.org/UK (accesso 26/08/2008)
9. http://www.has-sante.fr (accesso il 28/08/2008)
SINTESI
Inquadramento della patologia
Il tumore della mammella è la neoplasia di gran lunga più frequente nel sesso femminile; rappresentando
nel periodo 1998-2002 il 24,9% del totale delle diagnosi tumorali. Anche in termini di mortalità è risultata
la prima fra le cause tumorali con il 17,1% del totale dei decessi neoplastici. Il trattamento del carcinoma
mammario è comunemente basato su fattori prognostici e predittivi, quali la stadiazione, lo stato
recettoriale e l’espressione del recettore HER-2. Circa il 20-25% dei carcinomi mammari presenta, infatti,
una sovraespressione dell’HER2.
Caratteristiche del prodotto
Bevacizumab è un anticorpo monoclonale ricombinante umanizzato, registrato con procedura
centralizzata a livello europeo. E' inibitore dell’angioneogenesi e agisce legando il fattore di crescita
vascolare endoteliale (VEGF), impedendo così l’interazione di questo ai recettori VEGF- 1 e VEGF-2
presenti sulle cellule endoteliali.
Il farmaco ha ricevuto l'allargamento di indicazione nel trattamento di prima linea del carcinoma alla
mammella metastatico, associato a Paclitaxel. Il Paclitaxel è registrato ed ampiamente utilizzato nel
trattamento dei pazienti con cancro alla mammella in entrambi i setting metastatico e adiuvante , per la
sua buona efficacia e per un profilo di sicurezza accettabile. E' stato, anche, associato con successo alla
terapia con anticorpo monoclonale trastuzumab nei pazienti con espressione del recettore HER-2 e
pertanto è stato scelto come farmaco da associare a bevacizumab per verificarne l'efficacia vs la
monoterapia con paclitaxel.
Linee guida di trattamento esistenti
Le linee Guida NCCN 2008 riportano, nel caso di pazienti con malattia ricorrente o di stadio IV, che
presentino recettori ormonali ER e PR negativi oppure ER e/o PR positivi ma refrattarietà alla terapia
endocrina, e recettore HER2 negativo, diverse terapie di preferenza sia come agenti singoli:che in
associazione. Il farmaco da preferirsi in associazione a bevacizumab è considerato il paclitaxel, in quanto
in un singolo RCT di fase III è stato documentato un aumentato tempo alla progressione dell'associazione
rispetto al trattamento singolo.
Dati di efficacia
La Scientific Discussion dell'EMEA riporta a supporto della nuova indicazione uno studio Pivotal
randomizzato controllato in aperto che ha valutato l'efficacia dell'aggiunta di bevacizumab alla
monoterapia con paclitaxel vs la sola monoterapia in 722 pazienti con carcinoma della mammella
metastatico non precedentemente trattate con terapia citotossica per malattia metastatica. Le pazienti
con HER-2 positivo erano elegibili soltanto se avevano già ricevuto terapia con trastuzumab. I dettagli
dello studio sono mostrati in tabella. Il bevacizumab associato a paclitaxel ha mostrato di aumentare
significativamente la sopravvivenza libera da progressione (p<0.001) e la percentuale di risposte
obiettive (p<0.001), ma non la sopravvivenza complessiva.
Dati di sicurezza
La Scientific discussion riporta che il profilo di sicurezza relativo all'associazione bevacizumab+paclitaxel
non aggiunge nuovi effetti tossici inattesi. I più comuni effetti avversi verificatisi nei 3 studi analizzati per
valutare la sicurezza sono stati problemi gastrointestinali (nausea, vomito, astenia). nello studio pivotal si
sono osservati diversi eventi avversi di grado 3-4 con una frequenza significativamente superiore nel
gruppo bevacizumab: ipertensione, proteinuria, mal di testa, ischemia cerebrovascolare, infezioni,
stanchezza.
Indicazione studi in corso
Sono in corso studi di fase III relativi alla fase metastatica e adiuvante in cui bevacizumab viene
confrontato vs trattamenti standard in pazienti precedentemente trattate e naive.
Altri report HTA
Il report HAS (Haute Autorité de Santé) francese conclude che bevacizumab apporta un miglioramento
alla salute di grado moderato (classificazione HAS III) nel trattamento del carcinoma della mammella
metastatico con HER2 negativo o non elegibili al trattamento con trastuzumab.
Analisi dei costi (costi delle alternative, potenziale impatto di budget etc.)
Il costo del trattamento per un anno è di circa 30.000 € cui va sommato il costo del paclitaxel. Per il
farmaco l'AIFA ha contrattato la seguente modalità di rimborso:
cicli di 3 settimane: primi 2 cicli di terapia: risk sharing al 50% (solo per il primo anno), cicli dal 3° al 10°
a carico dell'SSN,i cicli successivi a carico della ditta produttrice fino ad 1 anno di terapia (solo per il
dosaggio più elevato);
cicli di 2 settimane: primi 3 cicli di terapia: risk sharing al 50% (solo per il primo anno), cicli dal 4° al 14°
a carico dell'SSN, i cicli successivi a carico della ditta produttrice fino ad 1 anno di terapia (solo per il
dosaggio più elevato).