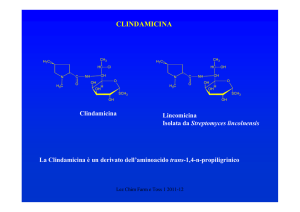
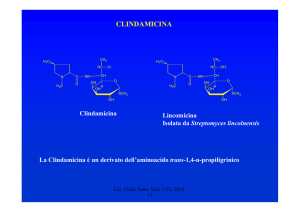
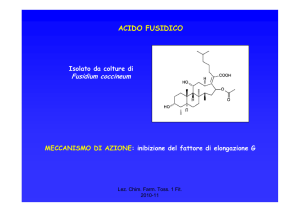
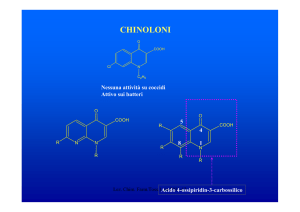
CEFALOSPORINE
•1945 Il Prof. G. Brotzu scoprì l’attività anti Salmonella typhi del
Cephalosporium acremonium
•1955-56 Isolamento della Cefalosporina C
Caratteristiche della Cefalosporina C
Era presente un atomo di S
Resistente alle eso β-lattamasi
Attiva sui Gram – (S. typhi)
H2N
CH CH2
COOH
Lez. Chim. Farm. Toss. 1 2010-11
CH2
CH2
R
STRUTTURA DELLA CEFALOSPORINA C
+H N
3
CH2
CH
CH2 CH2 NH
7 6
COON
O
8
5
S
1 2
43
COOH
Resistente alle eso β-lattamasi
Attiva sui Gram – (S. typhi)
ATTIVITA’ NON MOLTO ALTA
MOLECOLA INSTABILE
Lez. Chim. Farm. Toss. 1 2010-11
CH3
O
O
1962: isolamento del 7-ACA
++
H3
COO - HN
H
N CH
3N
COONH
O
O
S
N
NOCl, HC OOH
HOOC
S
N
O
S
CH2OCOCH3
N
COOHCH OCOCH
2
O
3
N
CH2OCOCH3
COOH
COOH
HOOC
O
S
N
O
H2O
N
CH2OCOCH3
COOH
S
H2N
O
N
CH2OCOCH3
COOH
7-ACA
Lez. Chim. Farm. Toss. 1 2010-11
Sintesi delle cefalosporine
Cl
R
R
N
O
7-ACA
S
NH
O
CH3
O
O
COOH
H2O
Cl
R
R
S
NH
O
7-ACA
N
O
Acetone anidro, NaHCO3
CH3
O
O
COOH
OH
R
R
S
NH
O
7-CA
N
N
C
N
O
CH3
O
O
COOH
O
R
O
R1
R
S
NH
7-ACA
N
N
C
N
O
O
O
COOH1 2010-11
Lez. Chim. Farm. Toss.
CH3
Sintesi delle cefalosporine
S
H2N
Cefadroxil, Cefalexin, Cefadrine
N
O
CH3
COOH
Acido 7-ammino-3-desacetossi-cefalosporanico (7-ADCA)
SINTESI TOTALE:
es: CEFALOTINA
Lez. Chim. Farm. Toss. 1 2010-11
CORRELAZIONI STRUTTURA ATTIVITA’ DELLE CEFALOSPORINE
R
S
NH
N
O
CH3
O
COOH
O
•Gli angoli di legame dell’N sono di circa 104 °
•La riduzione del doppio legame in 3-4 determina la perdita di attività
•La catena laterale in 7 deve essere sopra il piano
•Ampie modificazioni della catena laterale in 3 (variazioni farmacocinetiche e di MIC)
•Ampie modificazioni della catena laterale in 7 (variazioni dello spettro di azione)
•Le Cefalosporine sono più idrosolubili delle penicilline
•Le Cefalosporine hanno uno spettro più ampio rispetto alle penicilline
Lez. Chim.
•Le Cefalosporine sono inattivate
dalleFarm.
basi Toss. 1 2010-11
INATTIVAZIONE BASICA DELLE CEFALOSPORINE
O
O
S
NH
R
R
OH
-
S
NH
O
N
O
-N
-O
COCH3
COCH3
OH
COOH
COOH
O
S
NH
R
N
- CH3COOH
O
O
CH2
OH
COOH
Lez. Chim. Farm. Toss. 1 2010-11
O
R
C
O
HN
O
R
S
N
..
40a
2a
S
_
N
R1
R1
+
O
39b
1b
COOH
O
O
C
HN
COOH
39a
1a
R
C
R
HN
O
C
HN
S
S
_
..N
R1
COOH
N
O
R1
+
2b
40b
Lez. Chim. Farm. Toss. 1 2010-11
COOH
CLASSIFICAZIONE DELLE CEFALOSPORINE (O’CALLAGHAN C., 1979)
Uso
parenterale
Beta-lattamasi sensibili
Beta-lattamasi
resistenti
Metabolicamente
instabili
Metabolicamente
stabili
Cefalotina
Cefazolina
Acetil.
Cefapirina
Cefacetrile
Ceftriaxone
Cefamandolo
Cefotetan
Cefotiam
Cefodizime
Cefanone
Cefazaflur
R
Cefuroxime
S
NH 7
Cefamandolo
Cefsulodin
3
N
O
CH3
O
COOH
Ceftazidime
Ceftizoxime
O
Short-acting
Cefmenoxime
Cefoperazone
Cefoxitin
Lez. Chim. Farm. Toss. 1 2010-11
Cefotaxime
Long-acting
CLASSIFICAZIONE DELLE CEFALOSPORINE (O’CALLAGHAN C., 1979)
USO ORALE
β-Lattamasi sensibili
β-Lattamasi resistenti
Cefalexina
Cefaclor (parzialmente)
Cefatrixina
Cefroxadina
Cefaloglicina
Ceftibuten
Cefprozil
Lez. Chim. Farm. Toss. 1 2010-11
CLASSIFICAZIONE DELLE CEFALOSPORINE (WILLIAMS J. D., 1985)
I. Composti con elevata attività sui
Gram + ma inattivati da enzimi da
Gram-
a
Cefaloridina
Cefazolina
II. Composti con elevata attività sugli
enterobatteri ma con poca o nessuna
attività su Pseudomonas e specie
correlate. Stabili all’idrolisi da parte di
alcune
o
tutte
le
β-lattamasi
trasferibili dei batteri Gram -.
Idrolizzati
dalle
β-lattamasi
cromosomiche
Cefamandolo
Cefuroxim
Ceftizoxime
Cefmenoxime
III. Composti con elevata attività su
Pseudomonas o specie correlate,
possono o non possono essere
idrolizzati
dalle
β-lattamasi
cromosomiche
Ceftazidime
Cefoperazone
Cefsulodin
IV. Composti non idrolizzati dalle βlattamasi cromosomiche e
plasmidiche. Notevole l’attività su B.
fragilis
b
Cefoxitin
Moxalactam
Cefmetazolo
c
Cefalotina
Cefacetrile
Cefalexina
Cefradina
Ceftriaxone
Cefotaxime
Cefotetan
a) Derivati con le comuni caratteristiche farmacocinetiche delle cefalosporine (emivita di 1-2 h, escrezione per via renale).
b) Derivati assorbiti per via orale o con lunga emivita.
c) derivati con le comuni caratteristiche farmacocinetiche,
con unToss.
acetilestere
in posizione 3, per cui vanno incontro a
Lez. Chim.maFarm.
1 2010-11
metabolizzazione nell’uomo.
CLASSIFICAZIONE
“GENERAZIONE”
1a generaziome
Cefalotina
Cefapirina
Cefazolina
Cefacetrile
Ceftezolo
DELLE
CEFALOSPORINE
2a generaziome
Cefamandolo
Cefotetan
Cefoxitin
Cefuroxim
Cefmetazolo
Cefotiam
E
COMPOSTI
3a generaziome
4a generazione
Cefotaxime
Ceftizoxime
Ceftazidime
Ceftriaxone
Cefsulodin
Cefodizime
Cefmenoxime
Cefoperazone
Cefepime
Cefpirone
Attive per via orale
Cefalexina
Cefradina
Cefatrizina
Cefroxadina
Cefadroxil
Acetilcefuroxima
Cefprozil
Cefaclor
Cefibuten
Lez. Chim. Farm. Toss. 1 2010-11
ASSIMILATI
PER
5a genarazione
Ceftobiprole
POSSIBILI MODIFICAZIONI DEL SISTEMA CEFALOSPORANICO
R1
NH
R3
S
N
O
R2
COOH
Modifiche su R1 determinano variazioni DELLO SPETTRO D’AZIONE
Modifiche su R2 determinano variazioni della FARMACOCINETICA
Modifiche su R3 determinano variazioni della RESISTENZA ALLE β-LATTAMASI
Lez. Chim. Farm. Toss. 1 2010-11
I SOSTITUENTI AL C-3
Le energie associate allo stato di transizione delle cefalosporine con diversi R2 in
C-3, cresce al crescere della natura elettron-attrattrice di R2 (maggiore
delocalizzazione della carica negativa)
Quanto più è favorevole (maggiore) l’energia, tanto più diminuiscono le MIC verso i
Gram –
R1
MIC
NH
R3
S
Sostituente
N
CH3
O
R2
CH2OH
COOH
CH2OCH3
CH2SCH3
CH2CN
CH2OCONH2
CH3
CH2OH
CH2SCH3
CH2OCONH2
CH2OCOCH3
OSO2CH3
CH2OCOCH3
130 132 134 136 138
140
Lez. Chim. Farm. Toss. 1 2010-11
E (Kcal/mol)
129.6
131.0
132.2
132.7
133.1
136.1
METABOLISMO DEL SOSTITUENTE IN C3
Le cefalosporine subiscono metabolizzazione della catena in posizione 3.
Dopo anni di ricerche si scoprì che il 3-acetossimetil Cefem veniva
deacetilato formando un 3-metanolo-Cefem derivato che sebbene ancora
attivo lo era molto meno del suo precursore
R1COHN
R3
S
N
R2
O
COOH
Cefotaxime
R2
R1
nome
T1/2
S
H2N
NOCH3
N
CH2OCOCH3
C
h
% metabolismo
1.5
>20
8.0
<2
O
N
Ceftriaxone
id.
CH2S
OH
N
N
CH3
N
Cefadizime
id.
CH3
3.0
CH2S
<2
Lez. Chim. Farm. Toss. 1 2010-11
S
CH2COOH
Se in C-3 si
introducono R
molto ingombranti
o pesanti, non
verranno
metabolizzati,
oppure generano
farmaci con t 1/2
molto elevati
I Sostituenti al C-7 nel 7-ACA
N
S
CH2COHN
S
N
O
CH2OAc
COOH
42
Il sostituente 2- metiltioazolil aumenta l’attività sugli stafilococchi penicillinoresistenti
Sono stati impiegati innumerevoli sostituenti al nucleo tiazolico,
aumentando di volta in volta l’attività sui Gram - , oppure aumentando
la resistenza alle β- LTM
Lez. Chim. Farm. Toss. 1 2010-11
I gruppi più impiegati sono gli amminotiazoli e gli N-acil- fenilglicinici
C
NOR'
X
N
CH
NH
H2N
S
43
44
CO
R''
•
Se nell’amminotiazolo R’ = CH3, si ottengono molecole dotate di
elevata resistenza alle β– LTM e buona attività sui Gram -, solo
quando l’ossima è SYN (stabilizzazione del lattame)
•
La posizione 5’ nell’amminotiazolo può essere occupata da alogeni,
ma senza grandi miglioramenti dell’attività
•
Nei derivati N-acil- fenilglicinici lo spettro d’azione risulta assai
allargato, si possono colpire Gram – anche difficili, ma diminuisce la
resistenza alle endo β – LTM.
Lez. Chim. Farm. Toss. 1 2010-11
Sostituzione dell’H-α
α sul carbonio 7 nelle Cefalosporine
CEFAMICINE (7-α- metossicefalosporine), isolate per la prima volta da colture
di un ceppo di Streptomyces lipmanii
H2N
CH
( CH2 )
3
HN
OCH3
S
COOH
N
45
CH2OAc
O
COOH
CEFAMICINA C
•Elevata resistenza alle β-lattamasi
•Spettro orientato sui Gram –
•Ridotta applicabilità terapeutica (bassa attività)
•Cefamicine in uso terapeutico Cefoxitina, Cefotetan
Lez. Chim. Farm. Toss. 1 2010-11
CEFALOSPORINE ORALI
•Le cefalosporine orali sono corredabili all’Ampicillina (simili caratteristiche
farmacocinetiche e spettro d’azione (I e II generazione)
•Maggiore resistenza rispetto all’ampicillina nei confronti delle β-lattamasi
•Vengono associate alle isossazolpenicilline
R1COHN
S
N
R2
O
COOH
Farmaco
h
t 1/2
R2
R1
resist. β LTM
Spettro
azione
Genaraz.
NH2
Cefalexina
Cefaclor
Cefaloglicina
CH
CH3
0.9
No
Idem
Cl
1.0
Si
Idem
0.8
CH3OCOCH3
Cefroxadina
1.1
CH
G(-)
II
I
No
G(+)
No
Classico
NH2
CH3
Classico
I
I
NH2
Cefprozil
HO
HC
Lez.
Chim.
Farm. Toss. 1 2010-11
CH
CH3
1.3
SI
II
CEFTIBUTEN (III generazione)
COOH
O
S
NH
N
O
N
COOH
S
NH2
Appartiene al gruppo delle cefalosporine
Carbossietilideniche
Resistente a cefalosporinasi mediate da plasmidi e β-lattamasi a largo spettro
INDICAZIONI TERAPEUTICHE: infezioni urinarie, delle basse vie respiratorie, sinusiti
batteriche
SPETTRO D’AZIONE: Gram + (Streptococcus pyogens, S. pneumoniae) e Gram – H.
influenzae (inclusi ceppi resistenti all’ampicillina), Moraxella catarralis, E. coli, K.
pneumoniae
t1/2 = 2.4 h
METABOLISMO: escrezione per via renale praticamente immutato (10% cefibuten trans)
Lez. Chim. Farm. Toss. 1 2010-11
INDICAZIONI TERAPEUTICHE DELLE CEFALOSPORINE ORALI
Infezioni delle vie aeree superiori (faringiti, tonsilliti, sinusiti, otiti)
Infezioni alle vie aeree inferiori (bronchiti acute, polmoniti)
Infezioni non complicate delle basse vie urinarie
Infezioni cutanee e dei tessuti molli
Lez. Chim. Farm. Toss. 1 2010-11
SPETTRO ANTIBATTERICO DELLE CEFALOSPORINE ORALI
Generazione Gram +
Gram -
I
Streptococcus (pyrogens,
pneumoniae)
E. coli, Klebsiella sp.,
Moraxella catarrhalis,
Proteus
II
Streptococcus (pyrogens,
pneumoniae)
E. coli,
Klebsiellasp.,Moraxella
catarrhalis, Proteus, H.
influenzae, Neisseria sp.
III
Streptococcus (pyrogens,
pneumoniae)
E. coli,
Klebsiellasp.,Moraxella
catarrhalis, Proteus, H.
influenzae, Neisseria sp.,
Aeromonas sp.
Lez. Chim. Farm. Toss. 1 2010-11
CLASSIFICAZIONE DELLE CEFALOSPORINE PARENTERALI (O’CALLAGHAN C., 1979)
Beta-lattamasi sensibili
Beta-lattamasi
resistenti
Metabolicamente
instabili
Metabolicamente
stabili
Cefalotina
Cefazolina
Cefapirina
Cefacetrile
Acetilate
Ceftriaxone
Cefamandolo
Cefotetan
Cefotiam
Cefodizime
Cefanone
Cefazaflur
Cefamandolo
Cefuroxime
Cefsulodin
Ceftazidime
Ceftizoxime
Short-acting
Cefmenoxime
Cefoperazone
Cefoxitin
Lez. Chim. Farm. Toss. 1 2010-11
Cefotaxime
Long-acting
Cefalosporine Sensibili alle β-lattamasi Metabolicamente Instabili
S
CH2
H
CO HN
O
S
N
CH2OAc
COOH
CEFALOTINA (Keflin®)
SPETTRO D’AZIONE: Gram +(anche eso-β
β-lattamsi produttori) e Gram – non
difficili
t1/2: breve (0.8 h)
METABOLISMO: subisce deacetilazione
TOSSICITA’: necrosante per i tessuti per somministrazione i.m.
EFFETTI COLLATERALI: Può dare SHOCK ANAFILATTICO
Lez. acidi
Chim. ma
Farm.
Toss.assorbito
1 2010-11 per via enterica
SOMMINISTRAZIONE: stabile agli
poco
R
S
NH
N
O
R= N
R=
N
CH3
O
C
COOH
O
CH2
CEFACETRILE
S
CH2
CEFAPIRINA
SPETTRO D’AZIONE: come Cefalotina. Cefacetrile
Cefapirina è la più resistente verso le β-lattamsi
t1/2: brevi
METABOLISMO: subiscono deacetilazione
Possono dare SHOCK ANAFILATTICO
Lez. Chim. Farm. Toss. 1 2010-11
anche
su
Proteus.
Cefalosporine Sensibili alle β-lattamasi Metabolicamente stabili
R1COHN
R1
H
S
N
R2
O
CH2
COOH
N
N
CH
CEFAMANDOLO
N
S
OH
N
H
N
N
CEFAZOLINA
N
CH2 N
CH3
S
S
N
N
CH2
NH2
CEFOTIAM
N
N
N
S
N
S
( CH2 ) 2 N ( CH3 ) 2
CH2
CEFALORIDINA
S
H2 C
N
+
Caratteristiche generali simili alla cefalotina ma stabili metabolicamente
Il Cefamandolo è tra le tre la più resistente alle endo beta-lattamasi
La Cefazolina è sensibile alle eso beta-lattamasi prodotte da Stafilococchi
La Cefaloridina è più attiva sui G Lez. Chim. Farm. Toss. 1 2010-11
R2
CEFALOSPORINE β-LATTAMASI RESISTENTI SHORT ACTING (t1/2< 3h)
CEFALOSPORINE SHORT ACTING A SPETTRO CLASSICO
R1
C
R3
NH
S
O
N
O
R2
COOH
R1
NOCH3
CEFUROXIME
C
R3
CH2OCONH2
H
t½
1.2 h
O
H2N
NOCH3
S
S
N
C
N
CEFMENOXIME
R2
N
N
N
CH2
CH3
H
Lez. Chim. Farm. Toss. 1 2010-11
1.2 h
Le METOSSIMINE hanno uno spettro rivolto soprattutto ai Gram –
Resistenza alle endo β- LTM
C
N
O
CEFUROXIME
R
C
C
N
O
S
NH
O
OCH3
N
O
CH2OCONH2
COOH
SPETTRO D’AZIONE: Gram + e Gram – (gonococchi penicillino
resistenti, Proteus, Klebsiella, Haemophylus)
t1/2: 1h
METABOLISMO: nessuno
SOMMINISTRAZIONE: solo parenterale instabile agli acidi
Lez. Chim. Farm. Toss. 1 2010-11
N
H2N
S
C
C
N
O
OCH3
S
NH
N
N
N
N
CH2S
O
COOH
N
H3C
CEFMENOXIME
SPETTRO D’AZIONE: resistente alle eso ed endo β- LTM. (dovuta alla funzione
2-amino metossi–imino tiazolica). Attivo su Gram + (S. aureus, S.
epidermidis).
Gram – (Proteus, Serratia, Haemophylus). Enterobacteriaceae
t1/2: 1h
METABOLISMO: assente
Lez. Chim. Farm. Toss. 1 2010-11
CEFALOSPORINE SHORT ACTING A SPETTRO MIRATO
R1
C
NH
R3
S
O
N
O
R2
COOH
R1
R2
CH2
CEFOXITINA
R3
CH2OCONH2
t½
OCH3
0.8
H
1.5
S
CEFSULODIN
CH
SO3H
CH2
+
N
CONH2
Lez. Chim. Farm. Toss. 1 2010-11
O
NH OCH3 S
S
NH2
N
O
O
COOH
O
CEFOXITINA
SPETTRO D’AZIONE: Simile al cefuroxime ma ridotta attività sui Gram +. Azione
particolare su anaerobi e N. gonorreae
t1/2: 0.8
METABOLISMO: perdita del CONH2 (ridotta percentuale)
SOMMINISTRAZIONE: solo parenterale instabile agli acidi
Non attraversa la barriera ematoencefalica
Lez. Chim. Farm. Toss. 1 2010-11
O
S
NH
NH2
HO3S
+
N
N
O
O
COOH
CEFSULODIN
SPETTRO D’AZIONE: ridotta attività sui Gram +. Azione specifica su N. gonorreae e
β-lattamasi
soprattutto Pseudomonas. Particolarmente resistente alle endo-β
Forma attiva: R
t1/2: 1.5
METABOLISMO: nessuno
Lez. Chim. Farm. Toss. 1 2010-11
CEFALOSPORINE SHORT ACTING A SPETTRO ALLARGATO
R1
C
NH
R3
S
O
N
O
R1
CEFTIZOXIME
N
N
CEFTAZIDIME
NOCH3
CH2OCOCH3
NOCH3
H
0.6-0.7 h
H
C
CH3
NOC COOH
CH3
CH2
+N
CH
NHCO
HO
H
1.5
C
S
N
CEFOPERAZONE
t½
C
S
H2N
H2N
R3
S
H2N
CEFOTAXIME
R2
H
N
N
O
N
O
N
N
CH2
S
1.7
N
CH3
C2H5 Chim. Farm. Toss. 1 2010-11
Lez.
H
0.6-0.7 h
R2
COOH
R1
C
R3
NH
S
O
N
O
R2
COOH
R1
H2N
CEFOTAXIME
R2
R3
t½
S
N
NOCH3
CH2OCOCH3
H
0.6-0.7 h
C
SPETTRO D’AZIONE: Molto ampio. Attività sui Gram + simile alla cefalotina. Spettro
ampio su Gram – (E. coli, Serratia, Proteus, Klebsiella, Pseudomonas) (attivi su
anaerobi)
METABOLISMO: deacetilazione (ancora attivo sui G -)
t1/2 = 0.6-0.7 h
SOMMINISTRAZIONE: solo parenterale
Attraversa la barriera ematoencefalica
Lez. Chim. Farm. Toss. 1 2010-11
R1
C
NH
R3
S
O
N
O
R2
COOH
R1
CEFTIZOXIME
N
CEFTAZIDIME
R3
t½
H
H
1.5
S
H2N
H2N
R2
NOCH3
C
S
N
C
CH3
NOC COOH
CH3
CH2
+N
H
1.7
CEFTIZOXIME : stesse caratterisctiche del cefotaxime ma con maggiore attività su
Bacteroides
CEFTAZIDIME: la maggiore polarità della molecola incrementa
Pseudomonas e riduce l’attività su Gram +. Inattivi su Bacteroides
Lez. Chim. Farm. Toss. 1 2010-11
l’azione
su
R1
C
R3
NH
S
O
N
O
R2
COOH
R1
R2
CH
NHCO
CEFOPERAZONE
HO
R3
N
N
O
N
O
N
N
CH2
S
t½
N
H
1.6- 2.6 h
CH3
C2H5
SPETTRO D’AZIONE: molto ampio come gli altri della serie. Spiccata
azione su Pseudomonas. Molto attivo anche su Gram +
t1/2 = 1.6- 2.6 h
METABOLISMO: nessuno
ELIMINAZIONE: principalmente biliare
Rende i pazienti intolleranti
all’alcool
Lez. Chim.
Farm. Toss. 1 2010-11
CEFALOSPORINE β-LATTAMASI RESISTENTI LONG ACTING (t1/2 > 3h)
R1
C
R3
NH
S
O
N
O
R2
COOH
R1
R2
R3
t½
S
H2N
Cefodizime
S
N
C
N
NOCH3
N
H2N
N
OH
N
H
8.0
OCH3
12
O
N
N
COOH
C
S
N
S
C
S
HC
3.0
CH3
NOCH3
Cefotetan
H
CH3
S
Ceftriaxone
CH2COOH
S
C
CONH2
N
S
N
CH3
Lez. Chim. Farm. Toss. 1 2010-11
R1
R2
R3
t½
S
H2N
Cefodizime
S
N
S
C
N
NOCH3
3.0
H
8.0
CH3
N
H2N
N
H
CH3
S
Ceftriaxone
CH2COOH
C
NOCH3
N
S
OH
N
O
CEFODIZIME: Spettro d’azione orientato sui Gram + e Enterobatteri. Elevata
resistenza verso le β-lattamasi
METABOLISMO: nessuno
CEFTRIAXONE: rispetto al cefodizime spettro più ampio nei confronti dei Gram –.
Non attivo su Pseudomonas
t1/2 alto
METABOLISMO: nessuno
Lez. Chim. Farm. Toss. 1 2010-11
O
S
NH OCH3 S
N
CH
HOOC
C
S
N
N
N
O
S
COOH
H2NOC
N
H3C
CEFOTETAN (APATEF ®)
SPETTRO D’AZIONE: sovrapponibile a quello della cefoxitina (ridotta attività sui Gram +)
con però una maggiore attività su alcuni Gram – come Proteus e Serratia. Poco attivo su
Pseudomonas
Elevata resistenza verso le β-lattamasi
METABOLISMO: nessuno
t1/2: 12 h (2 somministrazioni giornaliere)
Lez. Chim. Farm. Toss. 1 2010-11
CEFALOSPORINE PARENTERALI DI IV GENERAZIONE
OCH3
N
N
H2N
HN
S
S
O
N
+
O
COO-
OCH3
N
N
H2N
HN
S
S
O
S
+
O
N
OCH3
COO-
N
N
H2N
S
HN
S
O
N
O
+
COO-
Lez. Chim. Farm. Toss. 1 2010-11
CEFEPIME (MAXIPIME®, 2000)
OCH3
N
N
H2N
S
HN
S
H3C
O
+
N
O
COO-
Lez. Chim. Farm. Toss. 1 2010-11
CEFEPIME (MAXIPIME®)
SPETTRO D’AZIONE: estremamente ampio.
Gram-negativi: Pseudomonas spp., E. coli, Klebsiella spp. Proteus
spp. Serratia spp. Providencia spp., Morganella morganii, H.
influenzae
(incluso
ceppi
ampicillino-resistenti),
H.
parainfluenzae, Hafnia alvei, Kluvyera spp., Salmonella spp.,
Shigella
spp.,
Aeromonas
hydrophila,
Y.
enterocolitica,
Campylobacter jejuni, Vibrio spp., Acinetobacter calcoaceticus,
M. catarrhalis, N. gonorrhoeae, N. meningitidis, Gardnerella
vaginalis.
SPETTRO D’AZIONE: Gram-positivi: S. aureus (inclusi ceppi che producono
penicillinasi), S. epidermidis (inclusi ceppi che producono penicillinasi),
Streptococcus
pyogenes,
Streptococcus
agalactiae,
Streptococcus
pneumoniae.
INATTIVO SU Bacteroides fragilis, Clostridium difficile, Pseudomonas
pickettii, Enterococcus faecalis, MRSA
Lez. Chim. Farm. Toss. 1 2010-11
INDICAZIONI TERAPEUTICHE: infezioni dell'apparato respiratorio e le infezioni
(complicate e non complicate) del tratto urinario inferiore e superiore, le
infezioni della cute e dei tessuti molli, le infezioni intra-addominali, comprese le
peritoniti e le infezioni biliari, le setticemie compresi gli episodi febbrili in
pazienti immunocompromessi.
Nei bambini: meningite cerebrospinale sostenuta da germi sensibili.
Maxipime è indicato nella profilassi chirurgica nei pazienti sottoposti a
chirurgia intraddominale
Può essere usato da solo come farmaco di prima scelta o in associazione con
antibiotici aminoglicosidici o con altri antibiotici.
SOMMINISTRAZIONE: i.m., endovena
t1/2: 2 h
METABOLISMO: POCO METABOLIZZATO. Il metabolita principale nelle urine è
l'N-metilpirrolidina, che è rapidamente convertita in N-ossido (6.8 %)
Lez. Chim. Farm. Toss. 1 2010-11
OCH3
N
CEFPIROME
N
H2N
HN
S
S
+
O
N
O
Stesse caratteristiche
del cefepime
COO-
HOOC
CH3
H3C
O
O
N
S
NH
+
N
N
O
COO-
N
S
NH2
CEFTAZIDIME
III GENERAZIONE
Minore resistenza alle β-lattamasi prodotte dalle Enterobacteriaceae
Lez. Chim. Farm. Toss. 1 2010-11
Minore attività verso Staphylococchi
CEFOZOPRAN (FIRSTCIN®)
UTILIZZO TERAPEUTICO: infezione
Enterococcus faecalis e P. aeruginosa
MRSA
delle
vie
urinarie
Lez. Chim. Farm. Toss. 1 2010-11
contemporanee
da
CEFALOSPORINE PARENTERALI DI V GENERAZIONE
OH
CEFTOBIPROLE (2008, USA)
N
N
H2N
S
HN
N
S
O
C
N
O
COO-
O
NH
ELEVATA AFFINITÀ VERSO LE PBP2a dello S. aureus
Ridotta capacità di selezionare ceppi batterici resistenti
SPETTRO D’AZIONE: Ampio simile al CEFEPIME + MRSA
USO TERAPEUTICO
Infezioni complicate della cute e dei tessuti molli sostenute da MRSA (anche
vancomicina resistenti)
SOMMINISTRAZIONE : parenterale
Lez. Chim. Farm. Toss. 1 2010-11
HO
O
N
+
S
NH
N
CH2CONH2
N
TOC 39
N
(TAIHO)
S
O
COOH
S
NH2
CEFALOSPORINA ad ampio spettro
ELEVATA AFFINITÀ VERSO LE PBP2a
SPETTRO D’AZIONE: potenza comparabile con quella della Vancomicina sui Gram +
incluso MRSA, Enterococcus faecalis, Streptococcus pyrogens.
Gram -: S. pneumoniae, H. influenzae, Moraxella catarralis, E. coli, K. Pneumoniae,
Proteus mirabilis
Inattiva su Pseudomonas
Lez. Chim. Farm. Toss. 1 2010-11
Attività antibatterica in vitro del TOC 39
MIC 90 (µ
µg/ml)
Batteri
TOC 39
Vancomicina
Ceftazidime
MRSA (117)
3.13
1.56
> 100
MRSA (57)
3.13
1.56
> 100
MSSA
0.39
-
25
E. faecalis
0.78
-
> 100
S. pneumoniae
0.2
-
12.5
Lez. Chim. Farm. Toss. 1 2010-11
+
NH2
MC-02,306
O
S
H2N
S
NH
NH
+
N
NH2
S
O
COOH
S
NH2
SPETTRO D’AZIONE: MRSA, Streptococcus pneumoniae pen. res., E. faecalis
ELEVATA AFFINITÀ VERSO LE PBP2a
Lez. Chim. Farm. Toss. 1 2010-11
Attività antibatterica in vitro del MC-02,306
MIC 90 (µ
µg/ml)
Batteri
MC02,306
Vancomicina
MRSA (60)
8
1
MSSA
0.5
1
E. faecium
1
4
E. faecalis
2
4
S. Pneumoniae pen res
0.125
-
PBP2a MIC 50 (µ
µg/ml)
1.84
Lez. Chim. Farm. Toss. 1 2010-11
CEFALOSPORINE CHE MIMANO I SIDEROFORI
O
OH
O
O
N
S
NH
HO
HO
GR-69153
N
O
N
COO-
S
NH2
SPETTRO D’AZIONE: Ampio su Gram – (enterobacteriaceae, P. aeruginosa, H.
influenzae, N. gonorrhoeae, M. catharralis
Gram +: staphylococchi, streptococchi
Non attivo su MRSA e enterococchi
t1/2: 3.5 h (una somministrazione giornaliera)
Lez. Chim. Farm. Toss. 1 2010-11
OXACEFALOSPORINE
O
NH R3
O
R1
N
O
R2
COOH
La sostituzione dello S con l’O aumenta la tensione d’anello
Maggiore capacità acilante rispetto alle cefalosporine
Maggiore idrofilicità
Necessitano di un gruppo metossi in 7
Lez. Chim. Farm. Toss. 1 2010-11
HO
O
NH OCH3O
S
N
COOH O
N
LATAMOXEF(Moxalactam) (R,S)
COOH
N
N
N
CH3
Flomoxef
F
O
S
NH OCH3O
S
N
F
O
N
COOH
N
N
N
CH2CH2OH
IL LATAMOXEF è POCO ATTIVO SUI Gram +. Seleziona ceppi resistenti. Buona
l’attività su Bacteroides. Poco attivo su Pseudomonas.
Viene usato per la cura delle meningiti (passa la barriera) e infezioni urinarie
Elevati costi di produzione
Lez. Chim. Farm. Toss. 1 2010-11
CARBACEFALOSPORINE
O
NH R3
R1
N
O
R2
COOH
Minore capacità acilante rispetto alle cefalo ma maggiore resistenza verso le βlattamasi
Nessun derivato terapeutico
Lez. Chim. Farm. Toss. 1 2010-11