FARMACI ATTIVI SULLA SINTESI DEGLI ACIDI
NUCLECI BATTERICI
Il DNA è un substrato naturale comune a tutte le cellule animali, vegetali e batteriche
La sintesi del DNA può essere interrotto da diverse molecole in tre distinte fasi:
Blocco della sintesi delle basi puriniche o pirimidiniche costituenti il DNA
Interferenza nel processo di sintesi del DNA
Interferenza con gli enzimi che sovraintendono alla sintesi del DNA e RNA
Lez. Chim. Farm.Toss.1 aa 2010-11
Inibitori della sintesi delle basi puriniche:
H2
N
N
N
O
H
H
O2
H
C
O
N
N
2
H
C
O
H
H
O
H O
O C
N
-
N
=
+
N
=
H
2C
H H C O
O N O
O
C
Hadacina
Psicofuranina
Nessuna applicazione terapeutica
Lez. Chim. Farm.Toss.1 aa 2010-11
H
O
H
O
Azaserina
INTERFERENZA NEL PROCESSO DI SINTESI DEL DNA
O
OH
COCH2R
OH
OCH3 O
OH
H
O
R= H Daunorubucina
R= OH Doxorubicina
O
CH3
OH
NH2
FARMACI ANTITUMORALI
Lez. Chim. Farm.Toss.1 aa 2010-11
BLOCCO DEGLI ENZIMI CHE SOVRAINTENDONO ALLA SINTESI
DEL DNA O RNA:
Inibitori della RNA polimerasi batterica (RIFAMICINE)
Inibitori della DNA girasi e della Topoisomerasi IV (CHINOLONI)
Lez. Chim. Farm.Toss.1 aa 2010-11
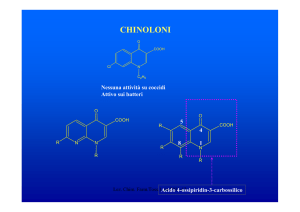
CHINOLONI
O
COOH
Cl
N
C2H5
Nessuna attività su coccidi
Attivo sui batteri
O
O
COOH
R
5
COOH
4
R
N
N
R
R
8
R
1
N
R
Lez. Chim. Farm.Toss.1Acido
aa 2010-11
4-ossipiridin-3-carbossilico
CHINOLONI DI PRIMA GENERAZIONE
O
O
COOH
COOH
N
H3C
N
N
N
C2H5
N
N
C2H5
Acido Nalidissico (1962)
Acido Piromidico
O
O
O
COOH
N
C2H5
Acido Ossolinico
Lez. Chim. Farm.Toss.1 aa 2010-11
CARATTERISTICHE DEI CHINOLONI DI PRIMA GENERAZIONE
SPETTRO D’AZIONE: azione quasi esclusiva su G(-) aerobi (soprattutto
enterobatteri, escluso Pseudomonas)
SOMMINISTRAZIONE: Orale
FARMACOCINETICA: Scarsa diffusione tissutale e rapida eliminazione
renale (A. Nalidissico t1/2 = 1.5 h)
METABOLISMO: prevalentemente epatico (composti idrossilati ancora attivi)
USO TERAPEUTICO : Esclusivamente infezioni urinarie
Sono caratterizzati da una elevata stabilità chimica
La loro attività non dipende dal pH (nell’intervallo pH 4-9)
Lez. Chim. Farm.Toss.1 aa 2010-11
Si differenzia dall’acido Nalidissico per
maggiore attività (da 2 a 4 volte)
O
O
COOH
t1/2 = 3h
O
N
C2H5
Mostra incremento di concentrazione nei giorni
successivi alla somministrazione
Acido 0SSOLINICO
O
COOH
Lo spettro d’azione comprende oltre ai G(-) alcuni G(+)
come gli Stafilococchi
N
N
Presenta ridotto legame farmaco-proteico
N
N
C2H5
Presenta un t1/2 di circa 2 h
Metabolizzazione a livello epatico con formazione di β
idrossi derivati sull’anello pirrolidinico
I metaboliti sono più attivi del
farmaco da cui derivano
Lez. Chim. Farm.Toss.1 aa 2010-11
Acido PIROMIDICO
Chinoloni di seconda generazione
Rispetto a quelli di prima generazione sono dotati di uno spettro d’azione
più ampio sia sui G (-) (incluso Pseudomonas) che nei G (+)
Migliore farmacocinetica
Minore metabolizzazione
Maggiore limitazione: bassa biodisponibilità sistemica
Acido PIPEMIDICO
O
Viene scarsamente metabolizzato
H
O
O
C
N
Raggiunge buone concentrazioni plasmatiche
4
2
1
5
H
2
N C
N
N
Presenta bassi legami farmaco-proteici
t1/2 = 3h
N
H
migliore diffusione tissutale
Lez. Chim. Farm.Toss.1 aa 2010-11
O
H
O
O
C
F
Flumechina
N
3
H
C H
H
Struttura benzochinozolinica che la differenzia da altri chinoloni
Attivo sui G(-) e su alcuni G(+) quali Stafilococchi
MIC migliore rispetto all’Ac. Nalidissico
Ha un elevato legame farmaco-proteico
Il suo t1/2 è di circa 7 h
Lez. Chim. Farm.Toss.1 aa 2010-11
Chinoloni di terza generazione (Fluorochinoloni)
presenza di un atomo di F in 6
Aumento dell’attività antibatterica
Spettro d’azione estremamente ampio, che spazia dai G(-) ai G(+), comprese le
specie più difficili. Attivi anche su Chlamydia, Micoplasmi
Elevata biodisponibilità orale
Elevata capacità di diffusione tissutale nella prostata, nelle vie urinarie, nel tessuto
osseo, nei polmoni, nella bile e nei tessuti molli
Elevata penetrazione endocellulare
Possibilità di impiegare diverse forme farmaceutiche
Trovano applicazione in numerose infezioni quali:
delle vie urinarie, nelle enterocoliti batteriche, nelle infezioni delle vie respiratorie,
nelle osteomieliti, nelle infezioni post-operatorie, infezioni sessualmente trasmesse,
setticemie
Lez. Chim. Farm.Toss.1 aa 2010-11
O
O
F
N
HN
F
COOH
N
COOH
N
N
N
O
N
C2H 5
H3C
NORFLOXACINA (NOROXIN®)
CH3
OFLOXACINA (EXOCIN®)
O
F
N
COOH
N
CIPROFLOXACINA (CIPROXIN®)
HN
Ofloxacina: attiva anche su Gram + responsabili di infezioni oculari (Exocin). Usata
anche nelle infezioni urinarie e respiratorie (Flobacin®, Oflocin®). Usato anche come
antimicobatterico
Ciprofloxacin : Spettro molto ampio. Usato anche come antimicobatterico
Elevatissima attività
t1/2 breve (3-4 h)
Lez. Chim. Farm.Toss.1 aa 2010-11
O
O
F
N
N
N
F
COOH
O
H3C
OFLOXACINA
COOH
N
N
CH3
N
H3C
O
CH3
LEVOFLOXACINA (LEVOFLOXACIN®)
La LEVOFLOXACINA è l’isomero R della Ofloxacina. Maggiore attività
soprattutto su Gram + (S. pneumoniae, viridans)
USO TERAPEUTICO: polmoniti, bronchiti
Lez. Chim. Farm.Toss.1 aa 2010-11
FLUOROCHINOLONI LONG-ACTING
O
O
F
N
N
COOH
N
N
F
H3C
COOH
N
N
C2H5
F
HN
H3C
PEFLOXACINA (PEFLACIN®)
Tra tutti è quello con attività più
bassa
Viene metabolizzato anche come
Norfloxacina
t1/2 = 8-11 h
C2H5
LOMEFLOXACINA (UNIQUIN®)
Viene usata nelle infezioni urinarie e
respiratorie
t1/2 = 8 h
Lez. Chim. Farm.Toss.1 aa 2010-11
Chinoloni di quarta generazione
Spettro allargato verso alcuni aerobi Gram + (pneumococchi
betalattamino-resistenti, batteri a localizzazione endocellulare o privi di
parete)
Elevata biodisponibilità
Elevati tempi di emivita
L’impiego terapeutico: infezioni respiratorie anche ad insorgenza
comunitaria
Lez. Chim. Farm.Toss.1 aa 2010-11
H3C
TEMAFLOXACINA:
Ritirata dal commercio dopo sei mesi
(1992) a causa della cosiddetta “sindrome
da temafloxacina”
O
F
H3C
COOH
N
N
F
HN
F
Temafloxacina
O
GEMIFLOXACINA (2003):
Attiva su S. pneumoniae, compresi ceppi
resistenti a macrolidi, penicilline e al
Ciprofloxacin.
Il più potente fluorochinolone nei confronti
di Pneumococchi responsabili di infezioni
comunitarie
F
H3C
O
COOH
N
N
N
N
H2N
Lez. Chim. Farm.Toss.1 aa 2010-11
Gemifloxacina (Factive®)
O
MOXIFLOXACINA (1999) :
Bronchiti
croniche
(S.
F
pneumoniae,
Stafilococchi, H. influezae), polmoniti
acquisite in comunità (S. pneumoniae, H.
influezae,
Moraxella
catarrhalis,
Mycoplasma
pneumoniae,
Legionella
pneumofila), sinusiti acute batteriche (S.
pneumoniae, H. influezae)
COOH
H
N
N
N
H3C
O
Moxifloxacina (Avalox®)
O
GATIFLOXACINA (1999) :
F
COOH
Stesse applicazioni della Moxifloxacina
N
N
H3C
HN
O
H3C
Lez. Chim. Farm.Toss.1 aa 2010-11
Gatifloxacina (Tequin®)
MECCANISMO DI AZIONE DEI FLUOROCHINOLONI
•Inibizione della DNA girasi
•Inibizione della Topoisomerasi IV
Effetto battericida
Azione selettiva
A dosi elevate inibizione della sintesi dell’RNA batterico
Le resistenze sono esclusivamente di tipo cromosomico
Lez. Chim. Farm.Toss.1 aa 2010-11
DNA GIRASI E TOPOISOMERASI IV
Sono coinvolti nella replicazione del DNA, in particolare:
La DNA girasi facilita i cambiamenti conformazionali del DNA durante
la replicazione
La Topoisomerasi IV interviene nella decatenazone delle molecole figlie
dopo la replicazione del DNA
La DNA girasi sembra che sia il primo bersaglio dei fluorochinoloni nei
G-, mentre nei Gram + sembra che la Topoisomerasi IV
Nei Fluorochinoloni di IV generazione sembra che vengano inibiti
entrambi
Lez. Chim. Farm.Toss.1 aa 2010-11
LA DNA GIRASI
E’ una Topoisomerasi II
Tetramero costituito da due subunità A e due B
GIRASI A:
•La porzione N-terminale contiene il sito attivo con il residuo tirosinico
responsabile del legame con il DNA e alcuni residui come SER83, ASP87,
che interagiscono con i chinoloni
GIRASI B:
• Piega di Rossman (contiene residui essenziali per l’interazione con i
chinoloni e con il DNA )
Lez. Chim. Farm.Toss.1 aa 2010-11
Struttura della Girasi A
La resistenza ai chinoloni è dovuta a mutazioni nella regione compresa tra le
posizioni 67 e 106 (QRDR)
Lez. Chim. Farm.Toss.1 aa 2010-11
MECCANISMO DI AZIONE DELLA DNA GIRASI
Lez. Chim. Farm.Toss.1 aa 2010-11
MECCANISMO DI INTERAZIONE DNA-CHINOLONI
A
B
Il chinolone si intercala tra le basi
del DNA su entrambi i lati della
doppia elica
Il chinolone si inserisce al
posto della citosina formando
legami di idrogeno con la
guanina sul filamento opposto
Lez. Chim. Farm.Toss.1 aa 2010-11
MECCANISMO DI INTERAZIONE GIRASI-CHINOLONI
O
6
COOH
N
N
Lis 447
N
O
83
Ser
H3C
CH3
7
42
F
8
Asp
As
p
Girasi A
Girasi B
Lez. Chim. Farm.Toss.1 aa 2010-11
MECCANISMO DI INTERAZIONE TOPOISOMERASI IV-CHINOLONI-DNA
La Topoisomerasi IV è un tetramero coinvolto nella separazione dei
filamenti replicati del DNA
Contiene due subunità: ParC (responsabile della rottura del DNA) e
ParE (catalizza l’idrolisi dell’ATP)
I chinoloni formano un complesso ternario con la Topoisomerasi IV e
il DNA portando alla rottura del DNA
La resistenza ai chinoloni da parte della Topoisomerasi IV è dovuta
a mutazioni a livello della subunità ParC
Lez. Chim. Farm.Toss.1 aa 2010-11
CORRELAZIONE STRUTTURA-ATTIVITA’ DEI CHINOLONI
Sito di legame al DNA
R5
O
R6
O
C
OH
Sito di legame all’enzima
Sito di legame all’enzima
R7
X
N
R8
R1
Dominio di autoassemblaggio
POSIZIONE 1: i sostituenti influenzano la capacità di legame del farmaco
con l’enzima
I migliori sono il ciclopropile e il 2,4-difluorofenile
Elevata anche l’attività dei chinoloni con un ciclo tra le posizioni 1 e 8
Lez. Chim. Farm.Toss.1 aa 2010-11
Sito di legame al DNA
R5
O
R6
C
5
Sito di legame all’enzima
R7
O
8
4 3
2
1
X
N
R8
R1
OH
Sito di legame all’enzima
Dominio di autoassemblaggio
Posizione 2: è molto vicina al sito di legame per l’enzima. Gruppi
ingombranti impediscono l’accesso
Posizioni 3 e 4: i gruppi carbonilico in 3 e carbossilico in 4 sono essenziali
per il sito di legame con l’enzima. Nessuna possibile modifica
Posizione 5: i sostituenti alterano la configurazione sterica planare del
chinolone. Gruppi metilici (temafloxacina), ossidrilici o amminici possono
incrementare l’attività
Posizione 6: un atomo di F incrementa notevolmente l’attività. Il contributo
di un gruppo amminico dipende
daiFarm.Toss.1
sostituenti
in 7 e 8
Lez. Chim.
aa 2010-11
Sito di legame al DNA
R5
O
O
R6
C
OH
4 3
Sito di legame all’enzima
78
R7
2
X
N
R8
R1
Sito di legame all’enzima
Dominio di autoassemblaggio
Posizione 7: è quella che agisce direttamente con l’enzima. R7 deve essere
preferibilmente un anello eterociclico azotato a 5 o 6 membri.
I gruppi ammonopirrolidinici incrementano l’attività sui Gram + (Gemifloxacina), quelli
piperazinici sui Gram -.
Anelli molto ingombranti aumentano l’attività nei confronti degli anaerobi e riducono
l’efflusso da parte di ceppi resistenti (Moxifloxacina)
Posizione 8: R8 influenza la configurazione sterica della molecola modificando l’accesso
ai siti attivi dell’enzima e del DNA.
Un protone in 8 o un ciclo tra 1 e 8 (Ofloxacina) aumenta l’affinità verso la
Topoisomerasi IV.
Un atomo di F o Cl in 8 migliora l’attività sugli anaerobi e sposta l’affinità verso la
DNA girasi mentre un metossile incrementa sia la potenza antibatterica che l’affinità
Lez. Chim. Farm.Toss.1 aa 2010-11
su entrambi gli enzimi
TOSSICITA’
Sono farmaci poco tossici e ben tollerati
Effetti Collaterali: intolleranza gastrointestinale
Possibile interazioni con metalli quali: Ca, Mg, Fe, Al
Reazioni di fotosensibilità (atomi di F, Cl in posizione 8 incrementa la
fototossicità).
Sono controindicati in età pediatrica (si concentrano nelle cartilagini e
nelle ossa) con possibili artropatie
Possibile interferenza con altri farmaci
RESISTENZA
Esclusivamente di tipo cromosomico:
Alterazione del bersaglio (regione QRDR)
Aumentato Efflusso
Riduzione della permeabilità dello strato lipopolisaccaridico
Lez. Chim. Farm.Toss.1 aa 2010-11





![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)