A 4 pag47-50
Dalle leggi della chimica alla teoria atomica
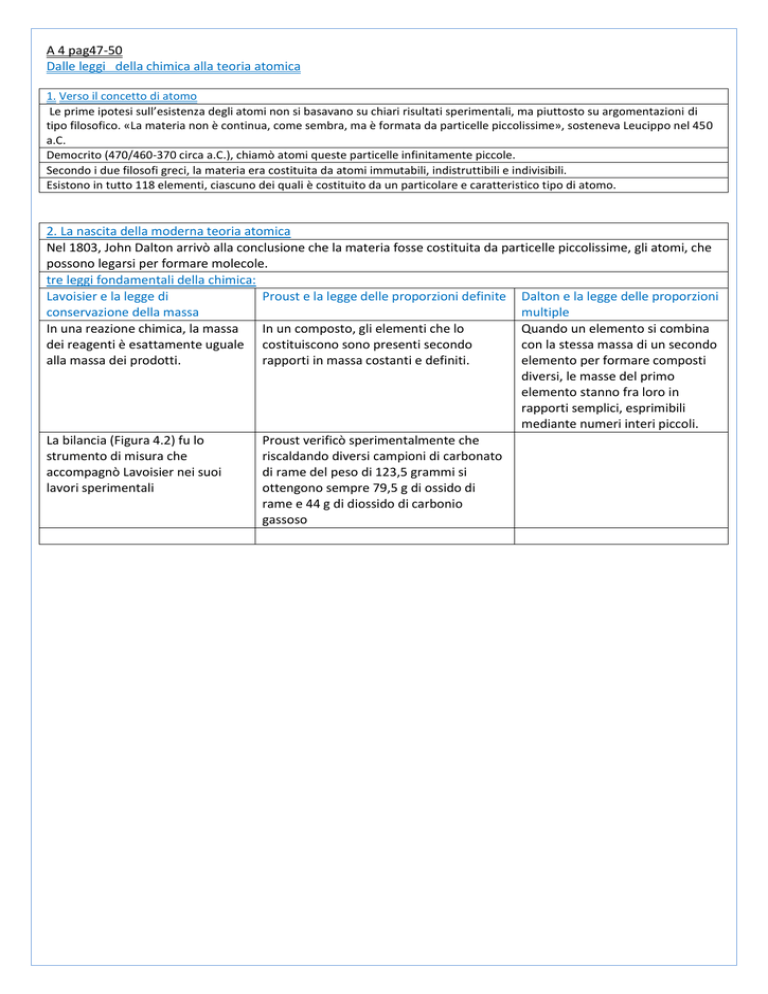
1. Verso il concetto di atomo
Le prime ipotesi sull’esistenza degli atomi non si basavano su chiari risultati sperimentali, ma piuttosto su argomentazioni di
tipo filosofico. «La materia non è continua, come sembra, ma è formata da particelle piccolissime», sosteneva Leucippo nel 450
a.C.
Democrito (470/460-370 circa a.C.), chiamò atomi queste particelle infinitamente piccole.
Secondo i due filosofi greci, la materia era costituita da atomi immutabili, indistruttibili e indivisibili.
Esistono in tutto 118 elementi, ciascuno dei quali è costituito da un particolare e caratteristico tipo di atomo.
2. La nascita della moderna teoria atomica
Nel 1803, John Dalton arrivò alla conclusione che la materia fosse costituita da particelle piccolissime, gli atomi, che
possono legarsi per formare molecole.
tre leggi fondamentali della chimica:
Lavoisier e la legge di
Proust e la legge delle proporzioni definite Dalton e la legge delle proporzioni
conservazione della massa
multiple
In una reazione chimica, la massa
In un composto, gli elementi che lo
Quando un elemento si combina
dei reagenti è esattamente uguale costituiscono sono presenti secondo
con la stessa massa di un secondo
alla massa dei prodotti.
rapporti in massa costanti e definiti.
elemento per formare composti
diversi, le masse del primo
elemento stanno fra loro in
rapporti semplici, esprimibili
mediante numeri interi piccoli.
La bilancia (Figura 4.2) fu lo
Proust verificò sperimentalmente che
strumento di misura che
riscaldando diversi campioni di carbonato
accompagnò Lavoisier nei suoi
di rame del peso di 123,5 grammi si
lavori sperimentali
ottengono sempre 79,5 g di ossido di
rame e 44 g di diossido di carbonio
gassoso












