CORSO DI CHIMICA GENERALE
Con applicazioni cliniche
Annarita
Santoro
Martina
Tarantini
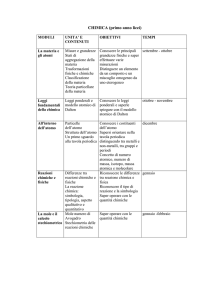
LA MATERIA
●
●
"Materia"
è tutto quello che si manifesta ai
nostri sensi, e pur assumendo forme diverse,
occupa uno spazio, cioè POSSIEDE UN
VOLUME, UN' ENERGIA nonchè una MASSA.
Il concetto di materia e dei suoi costituenti
venne proposto nel lontano 1803 da John
Dalton, che elaborò uno dei pilastri della
chimica....:
LA TEORIA ATOMICA
(John Dalton-1803)
●
●
●
La materia è composta da particelle dette
ATOMI;
Tutti gli atomi di un dato elemento hanno le
stesse proprietà (forma, dimensioni, massa)
che differiscono dalle proprietà degli atomi
costituenti tutti gli altri elementi;
Una reazione chimica consiste semplicemente
in un "riarrangiamento" degli atomi da un certo
tipo di combinazione ad un altro;
(INFATTI IL NUMERO DEGLI ATOMI DI UN DATO
ELEMENTO RIMANE COSTANTE!!!)
La MATERIA si presenta sotto 3
diversi STATI FISICI.
Da alcune immagini schematiche
possiamo dedurre la differente
organizzazione particellare nel contesto
di ciascuno stato fisico:
C
Una delle caratteristiche che contraddistingue i
tre stati è l’interazione fra le molecole che
costituiscono una sostanza.
Se essa è forte la sostanza sarà solida, se
debole un liquido. Se le molecole sono
abbastanza lontane le une dalle altre, la
materia sarà aeriforme.
La materia si definisce SOLIDAquando ha:
• Forma propria
• Volume proprio
• Comprimibilità quasi nulla
La materia si definisce LIQUIDA quando ha:
• Volume proprio
• Forma del recipiente in cui è contenuta
• Comprimibilità piccolissima
Lo STATO LIQUIDO che stiamo sognando!
La materia si definisce GASSOSA quando
ha:
• Volume non proprio
• Forma non propria
• Comprimibilità elevata
Proprietà della materia nei tre stati fisici (schema)
I PASSAGGI DI STATO
●
●
La materia possiede un'altra importante
proprietà che è quella di poter trasformare il suo
stato fisico se sottoposta a variazioni di
temperatura e/o pressione.
Le trasformazioni da uno stato fisico all'altro
vengono normalmente chiamate PASSAGGI DI
STATO.
I PASSAGGI DI STATO
La MATERIA possiede proprietà:
FISICHE
OGGETTIVE;
CHIMICHE
OGGETTIVE;
●
●
INVARIABILI
PER
QUEL
CAMPIONE;
●
●
MISURABILI
CON
GRANDEZZE
INTENSIVE.
●
ORGANOLETTICHE
RIGUARDANO IL
COMPORTAMENTO
DELLA MATERIA IN
PRESENZA
DI
ALTRI CAMPIONI DI
MATERIA DIVERSA.
COLPISCONO
I
NOSTRI
SENSI;
●
SONO
SOGGETTIVE.
●
ESEMPI DI PROPRIETA'
ORGANOLETTICHE
COLORE, percepito con la vista
●
FORMA,percepita principlamente con la vista
●
CONDIZIONE, percepita principlamente con la
vista
●
SAPORE, percepito con il gusto e l'olfatto
●
ODORE, percepito con l'olfatto
●
ESEMPI DI PROPRIETA' FISICHE:
TEMPERATURA DI FUSIONE/ SOLIDIFICAZIONE
●
TEMPERATURA DI EBOLLIZIONE/ CONDENSAZIONE
●
ATTRAZIONE CALAMITA
●
PESO SPECIFICO
●
DENSITA'
●
CALORE SPECIFICO
●
CALORE LATENTE
●
ESEMPI DI PROPRIETA'
CHIMICHE
●
IDROFILIA
●
IDROFOBIA
●
PH
Trasformazioni della materia
In base alla definizione di proprietà fisiche e
chimiche, le trasformazioni che la materia può
subire possono essere di due tipi:
●
TRASFORMAZIONI FISICHE
Sono trasformazioni che avvengono senza
variazione della composizione della materia.
Es. Cambiamenti di stato
●
TRASFORMAZIONI CHIMICHE
Avvengono con variazione della composizione
della materia, e sono anche dette REAZIONI
CHIMICHE.
Es: -Formazione di gas;
-Emissione di luce;
-Sviluppo di calore.
Trasformazioni chimiche
Verso la fine del XVIII secolo e l'inizio del XIX
secolo, si studiarono con particolare importanza
gli aspetti quantitativi delle trasformazioni
chimiche,
arrivando
a
descrivere
il
comportamento delle sostanze attraverso leggi
che ancora oggi sono chiamate leggi
fondamentali della chimica o leggi ponderali .
●
Legge di Lavioisier
●
Legge di Proust o delle proporzioni definite
●
Legge di Dalton o delle proporzioni multiple
Legge di Lavoisier
Nella sua attività laboratoriale Lavoisier
condusse una serie di esperimenti sulle
reazioni chimiche ponendo l'attenzione sugli
aspetti quantitativi.
Servendosi di una bilancia, eseguì accurate
misure di massa dei reagenti e dei prodotti delle
reazioni, riuscendo a dimostrare, nel 1789, che
la massa totale delle sostanze ottenute dalla
reazione chimica era esattamente uguale alla
massa totale delle sostanza messe a reagire.
Venne così formulata la legge di Lavoisier, nota
anche come legge di conservazione della
massa, che afferma che nel corso di una
reazione chimica la somma delle masse dei
reagenti è uguale alla somma delle masse dei
prodotti.
In altre parole, nel corso di una reazione
chimica la materia non si crea e non si
distrugge.
Legge di Proust o delle proporzioni
definite
Nel 1799 il chimico francese J.L. Proust,
rifugiatosi in Spagna durante la Rivoluzione
Francese, notò che la composizione della pirite,
un minerale molto abbondante in quel Paese,
era sempre la stessa indipendentemente dal
luogo di provenienza. In particolare, trovò che
la pirite conteneva ferro e zolfo e che questi
due elementi erano presenti secondo un
rapporto fisso e costante: per ogni grammo di
ferro erano sempre presenti 0,57 grammi di
zolfo.
Tali considerazioni lo portarono a formulare la
legge delle proporzioni definite (nota anche
come legge di Proust) che afferma:
"In un composto chimico gli elementi che lo
costituiscono sono sempre presenti in
rapporti in massa costanti e definiti"
Legge di Dalton o delle proporzioni
multiple
Dalton, anche in altri composti, notò la stessa
regolarità e riproducibilità di dati che lo
portarono a formulare la legge delle proporzioni
multiple nota anche come legge di Dalton:
"Quando un elemento si combina con la stessa
massa di un secondo elemento per formare
composti diversi , le masse del primo elemento
stanno tra loro in rapporti esprimibili mediante
numeri interi e piccoli"
Classificazione della materia
**Ma cosa intendiamo per OMOGENEITA'?
Una miscela si definisce omogenea quando le
proprietà che possiede in un punto sono le stesse
considerato un altro punto scelto casualmente.
Nella miscela eterogenea, (essendo costituita da
due o più FASI distinte), le proprietà in differenti
punti delle diverse fasi saranno esse stesse
differenti.
***Ma cosa intendiamo per FASE?
La fase, in chimica, è definita come una specifica
porzione di materia che possiede proprietà uguali
in tutti i suoi punti. La soluzione omogenea sarà
dunque costituita da un'unica fase.
Struttura dell'atomo
●
Particelle elementari (proprietà)
I MODELLI ATOMICI
Nell’anno 1809 DALTON formulò il primo
modello atomico e segnò l’inizio della chimica
come scienza.
Nel modello atomico di Dalton ciascun tipo di
atomo è rappresentato da una piccola sfera
piena di massa e un tipo di atomi è differente da
un altro tipo di atomo quando ha diversa
massa.
MODELLO DI THOMSON
●
Nel 1879 THOMSON, studiando il fenomeno
dell’elettricità, dimostrò che la corrente elettrica
era generata da un flusso di particelle con
carica negativa che chiamò elettroni.
Poiché tali particelle provenivano dalla materia
e la materia era formata da atomi, gli elettroni
dovevano provenire dall’interno degli atomi.
Considerato che gli atomi sono neutri,
Thomson formulò un modello atomico secondo
il quale l’atomo era una sfera piena di massa
con carica positiva all’interno della quale erano
distribuiti omogeneamente tanti elettroni da
neutralizzare la carica positiva
MODELLO DI RUTHERFORD
Nel 1911 lo scienziato neozelandese E.
Rutherford bombardò una sottilissima lamina di
oro con raggi α. Le particelle alfa positive
passavano nel 99% dei casi attraverso la
lamina senza subire deviazioni. In qualche caso
venivano deviate con angoli superiori ai 90°e, in
un caso su 8000, venivano respinte indietro.
- poichè le particelle α nella maggior parte dei
casi oltrepassavano la lamina d'oro senza
subire deviazioni, significava che non
incontravano alcun ostacolo sul proprio
cammino e che quindi, l'atomo doveva essere
formato prevalentemente da spazio vuoto.
- poichè in qualche caso le particelle α
venivano deviate e in rarissimi casi venivano
riflesse, l'intera carica positiva (protoni)
dell'atomo doveva essere concentrata in un
"nocciolo" piccolissimo e centrale: il nucleo.
- gli elettroni negativi dovevano muoversi
lungo orbite circolari. Il diametro del nucleo
doveva essere centomila volte più piccolo del
diametro dell'atomo.
Anche se geniale, il modello atomico di
Rutherford
non
teneva
conto
di
un
importantissimo dato sperimentale della fisica:
una particella in movimento ed elettricamente
carica perde incessantemente energia.
Poichè ciò deve valere anche per l'elettrone
(carico negativamente), esso perdendo via via
energia avrebbe finito per muoversi lungo orbite
sempre più piccole, fino a cadere sul nucleo
Spettri di emissione e assorbimento
MODELLO DI BOHR
Sfruttando la contraddizione insita al modello di
Rutherford, Bohr propose una nuova visione,
più pertinente, dell'atomo.
VALIDO PER L' ATOMO DI IDROGENO
Tale legge prevede tre postulati:
●
●
●
L'atomo si trova in uno STATO STAZIONARIO
che non irradia energia;
Le orbite permesse all e- di massa m e velocità v
sono solo quelle aventi un raggio r tale da
rendere il suo moto angolare (mvr) pari ad un
multiplo intero del momento angolare h/2pigreco
L'atomo può assorbire o irradiare energia solo
quando passa da uno stato stazionario all'altro.
Dopo Bohr...
Mentre il modello atomico di Bohr considerava
che gli elettroni si muovessero intorno al nucleo
secondo orbite circolari, il modello atomico di
Schrodinger definisce le regioni dello spazio in
cui il quadrato della funzione d'onda raggiunge i
valori più alti. Tali regioni furono chiamate
orbitali. L'orbitale è quella zona in cui la
probabilità di trovare l'elettrone è maggiore del
90%.
Nel 1925 il tedesco Werner Heisenberg e
l'austriaco Erwin Schrödinger presentarono un
modello puramente quantistico dell'elettrone nel
quale esso non è più visto come una particella, ma
come un'onda materiale.
●
●
Non è possibile in linea di principio verificare
sperimentalmente
i
dettagli
del
moto
dell'elettrone a causa del principio di
indeterminazione.
ALL’ELETTRONE E’ POSSIBILE ATTRIBUIRE
SOLTANTO UNA CERTA PROBABILITA’ DI
TROVARSI, IN UN DATO ISTANTE, IN UN
CERTO INTORNO SPAZIALE
Riassumendo, dopo Bohr..
Configurazione elettronica degli
elementi
"Sovrapposizione" sottolivelli
energetici
Regola della diagonale