Diagnostica per
Immagini in MN
Dott. Marco De Marco
Fisica Sanitaria
071.596.4789
[email protected]
Radiomania
Radiofobia
Il contributo all’irraggiamento dovuto all’esposizione
ambientale corrisponde a circa 82% del totale.
Le Radiazioni di origine Naturale
L’Universo è composto di materia ed energia,
due aspetti della medesima entità E = mc2
Storia dell’Atomo
Da una parte Aristotele che ipotizza l'esistenza di una materia continua,
divisibile indefinitamente in frammenti sempre più piccoli e quindi
irriducibile ad unità elementari.
384 BC – 322 BC
Dall’altra Democrito di Abdera (460 BC - 360 BC) e Leucippo, che
ritiene invece la materia discontinua e sostiene pertanto l'esistenza
di particelle minuscole, chiamate atomi, invisibili, incorruttibili ed
eterne.
Tutta la materia è composta da Atomi, particelle tanto piccole
da non essere visibili ad occhio nudo. Gli atomi NON POSSONO
essere ulteriormente divisi in parti più piccole.
dal greco ατοµος,
ατοµος indivisibile.
Aristotle did not believe the Greek theory of atoms being different sizes, regular
shapes, and being in constant motion. Aristotle didn't think atoms could be in a
constant motion in a void (vuoto).
He developed his own theory that all matter consisted of four elements:
earth, air, water, and fire.
He also added four qualities:
dryness (asciutto), hotess, coldness (freddo), and moistness (umidità).
Aristotle's theory also had two forces; conflict and harmony. The conflict force was
thought to cause bad things and harmony was thought to cause good things.
Il problema di poter ricondurre l'enorme varietà di sostanze conosciute alla
combinazione di poche sostanze semplici significava fondamentalmente
razionalizzare il mondo e quindi “spiegare” i fenomeni complessi riconducendoli e
riducendoli alla loro composizione elementare.
Le prime definizioni moderne si devono a Boyle e a Newton.
Per R.Boyle (1627-1691) gli elementi sono "corpi primitivi, semplici, incontaminati,
che, non essendo costituiti da altri corpi o di loro mescolanze, sono ingredienti di cui i
corpi misti sono costituiti e nei quali questi possono essere in definitiva risolti".
Mentre Newton (1643 – 1727) immaginò gli atomi come
minuscole sfere, dominate solo da forze attrattive e repulsive.
In Opticks così scrive: "In principio Dio creò la materia in
particelle mobili, impenetrabili, dure, massicce, solide...."
La chimica moderna, che nasce tra la fine del ‘700 e l’inizio dell’800, giunge ad
unificare il concetto di atomo e di elemento. Tale unificazione si produce con la
formulazione da parte di Dalton della Teoria atomica
LA TEORIA ATOMICA DI DALTON 1800
Lo studioso inglese J.Dalton all'inizio del XIX
secolo, attraverso l'ingegnosa interpretazione
delle leggi fondamentali della chimica a quel
tempo note (la legge della conservazione della
massa e la legge delle proporzioni definite), alle
quali aggiunse quella da lui stesso formulata (la
legge delle proporzioni multiple) arrivò alla
conclusione che la materia è discontinua cioè
formata da particelle.
John Dalton. [1766 - 1844]
Sulla base di queste tre leggi Dalton nel 1803
formulò la prima teoria atomica della materia. Tale teoria può essere così
schematizzata:
1. La materia non é continua, ma é composta da particelle che non possono
essere ulteriormente divisibili né trasformabili: gli atomi;
2. Gli atomi di un particolare elemento sono tutti uguali tra loro e hanno la
stessa massa;
3. Gli atomi di elementi diversi hanno massa e proprietà differenti;
4. Le reazioni chimiche avvengono tra atomi interi e non tra frazioni di essi;
5. In una reazione chimica tra due o più elementi gli atomi, pur conservando la
propria identità, si combinano secondo rapporti definiti dando luogo a
composti.
Negli ultimi decenni dell'Ottocento la maggior parte degli scienziati aderiva alla
teoria atomica, ma i dati sperimentali che si andavano accumulando suggerivano
l’idea che l’atomo non fosse in realtà il costituente ultimo della materia, ma che
possedesse una struttura interna costituita di particelle elettricamente cariche. Al
fine di descrivere e giustificare in modo adeguato le nuove caratteristiche che si
evidenziavano a livello subatomico vennero creati, nei primi anni del ‘900, diversi
modelli atomici.
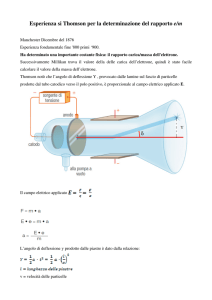
IL MODELLO ATOMICO DI THOMSON
Nel modello atomico di Thomson, formulato
nel 1898, da J.J.Thomson, si ammetteva che
l'atomo, piuttosto che la sferetta solida e
compatta ipotizzata da Dalton, fosse un
aggregato di particelle più semplici.
Alla luce dei pochi dati sperimentali in suo
possesso, J.J.Thomson ipotizzò che l'atomo
fosse costituito da una sfera omogenea
carica di elettricità positiva in cui gli
elettroni erano distribuiti in maniera uniforme
e senza una disposizione spaziale particolare.
J.J. Thompson. [1856 - 1940]
Rutherford 1911
Deciso a risolvere i dubbi rimasti, E. Rutherford incaricò due
ricercatori di bombardare con delle particelle α, che oggi
sappiamo essere composte da due protoni e due neutroni,
un sottilissimo foglio d'oro.
Secondo il modello di Thomson, le particelle avrebbero
dovuto subire un leggera deflessione del loro moto
rettilineo, nonché un'altrettanto lieve perdita di velocità,
dato che il campo elettrico all'interno dell'atomo è sempre
molto piccolo.
Tramite il suo esperimento, Rutherford sperava di trovare delle misure più precise
circa il modello del 'collega' rilevabili tramite la misura della deflessione.
I risultati non furono esattamente quelli previsti: non solo le particelle α
deviavano molto più di quanto teorizzato, ma spesso alcune invertivano
addirittura il proprio moto.
Questo fu il commento dello stesso Rutherford:
"Fu l’evento più incredibile che mi fosse mai capitato nella vita.
Altrettanto incredibile che se vi fosse capitato di sparare un proiettile da
quindici pollici su un pezzo di carta velina e questo fosse tornato indietro
a colpirvi."
THOMSON
RUTHERFORD
L’esperienza suggerisce che:
a) La struttura atomica sia estremamente rarefatta, visto l’alto numero di
particelle in grado di attraversarla
b) la diffusione sia provocata dalla repulsione tra particelle alfa incidenti
ed una carica positiva estremamente concentrata il cui valore cresca al
crescere del numero atomico.
Thomson: cariche distribuite in maniera uniforme
Rutherford: carica positiva centrale ed una nuvola di cariche negative
1 postulato (De Broglie)
ERRATO
2° postulato
Bohr e Sommerfeld
Numero quantico di spin
Livelli energetici dell’atomo