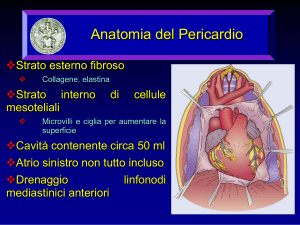
LINEE GUIDA
Linee guida ESC 2015
per la diagnosi e il trattamento delle malattie
del pericardio
Task Force per la Diagnosi
e il Trattamento delle Malattie del Pericardio
della Società Europea di Cardiologia (ESC)
con il patrocinio di:
Associazione Europea di Chirurgia Cardiotoracica (EACTS)
Autori/Membri della Task Force
Yehuda Adler (Chairperson) (Israele), Philippe Charron (Chairperson) (Francia), Massimo Imazio (Italia),
Luigi Badano (Italia), Gonzalo Barón-Esquivias (Spagna), Jan Bogaert (Belgio),
Antonio Brucato (Italia), Pascal Gueret (Francia), Karin Klingel (Germania),
Christos Lionis (Grecia), Bernhard Maisch (Germania), Bongani Mayosi (Sud Africa),
Alain Pavie (Francia), Arsen D. Ristić (Serbia), Manel Sabaté Tenas (Spagna),
Petar Seferovic (Serbia), Karl Swedberg (Svezia) e Witold Tomkowski (Polonia)
Revisori del Documento
Stephan Achenbach (Coordinatore CPG) (Germania), Stefan Agewall (Coordinatore CPG) (Norvegia),
Nawwar Al-Attar (UK), Juan Angel Ferrer (Spagna), Michael Arad (Israele), Riccardo Asteggiano (Italia),
Héctor Bueno (Spagna), Alida L.P. Caforio (Italia), Scipione Carerj (Italia), Claudio Ceconi (Italia),
Arturo Evangelista (Spagna), Frank Flachskampf (Svezia), George Giannakoulas (Grecia), Stephan Gielen (Germania),
Gilbert Habib (Francia), Philippe Kolh (Belgio), Ekaterini Lambrinou (Cyprus), Patrizio Lancellotti (Belgio),
George Lazaros (Grecia), Ales Linhart (Repubblica Ceca), Philippe Meurin (Francia), Koen Nieman (Olanda),
Massimo F. Piepoli (Italia), Susanna Price (UK), Jolien Roos-Hesselink (Olanda), François Roubille (Francia),
Frank Ruschitzka (Svizzera), Jaume Sagristà Sauleda (Spagna), Miguel Sousa-Uva (Portogallo),
Jens Uwe Voigt (Belgio) e Jose Luis Zamorano (Spagna)
G Ital Cardiol 2015;16(12):702-738
Parole chiave. Diagnosi; Eziologia; Linee guida; Miopericardite; Pericardio; Pericardiocentesi; Pericardite; Pericardite costrittiva; Prognosi; Tamponamento;
Terapia; Versamento pericardico.
© 2015 ESC
Tradotto da Adler Y, Charron P, Imazio M, et al. 2015 ESC Guidelines for the diagnosis and management of pericardial diseases: The Task Force for the
Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology (ESC). Endorsed by: The European Association for Cardio-Thoracic
Surgery (EACTS). Eur Heart J 2015;36:2921-64.
Si ringraziano i dr. Massimo Imazio, Antonio Brucato, Silvia Maestroni, Anna Valenti, Davide Cumetti e Mara Tiraboschi per la gentile collaborazione offerta
nella traduzione di questo documento.
Organismi dell’ESC che hanno partecipato alla stesura di questo documento:
Associazioni: Acute Cardiovascular Care Association (ACCA), European Association for Cardiovascular Prevention and Rehabilitation (EACPR), European
Association of Cardiovascular Imaging (EACVI), European Association of Percutaneous Cardiovascular Interventions (EAPCI), Heart Failure Association
(HFA).
Comitati: Council for Cardiology Practice (CCP), Council on Cardiovascular Nursing and Allied Professions (CCNAP), Council on Cardiovascular Primary
Care (CCPC).
Gruppi di Lavoro: Cardiovascular Pharmacotherapy, Cardiovascular Surgery, Grown-up Congenital Heart Disease, Myocardial and Pericardial Diseases,
Pulmonary Circulation and Right Ventricular Function, Valvular Heart Disease.
702
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
Abbreviazioni ed acronimi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Prefazione . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
1. Introduzione . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
1.1 Quali sono le novità nell’ambito delle malattie del pericardio?
2. Epidemiologia, eziologia e classificazione delle malattie
del pericardio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
2.1 Epidemiologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
2.2. Eziologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3. Sindromi pericardiche . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.1 Pericardite acuta . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.1.1 Gestione clinica e terapia . . . . . . . . . . . . . . . . . . . .
3.1.2 Prognosi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.2 Pericardite incessante e cronica . . . . . . . . . . . . . . . . . . . . . .
3.3 Pericardite ricorrente . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.3.1 Terapia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.3.2 Prognosi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.4 Pericardite associata a coinvolgimento miocardico
(miopericardite) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.4.1 Definizione e diagnosi . . . . . . . . . . . . . . . . . . . . . . .
3.4.2 Trattamento . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.4.3 Prognosi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.5 Versamento pericardico . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.5.1 Presentazione clinica e diagnosi . . . . . . . . . . . . . . . .
3.5.2 Triage e gestione clinica . . . . . . . . . . . . . . . . . . . . .
3.5.3 Terapia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.5.4 Prognosi e follow-up . . . . . . . . . . . . . . . . . . . . . . . .
3.6 Tamponamento cardiaco . . . . . . . . . . . . . . . . . . . . . . . . . .
3.7 Pericardite costrittiva . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.7.1 Presentazione clinica . . . . . . . . . . . . . . . . . . . . . . . .
3.7.2 Diagnosi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.7.3 Terapia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.7.4 Forme specifiche . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.7.4.1 Pericardite costrittiva transitoria . . . . . . . .
3.7.4.2 Pericardite effusivo-costrittiva . . . . . . . . . .
3.7.4.3 Pericardite costrittiva cronica . . . . . . . . . .
4. Imaging cardiovascolare multimodale e procedimento
diagnostico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
4.1 Imaging multimodale . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
4.1.1 Radiografia del torace . . . . . . . . . . . . . . . . . . . . . . .
4.1.2 Ecocardiografia . . . . . . . . . . . . . . . . . . . . . . . . . . . .
4.1.3 Tomografia computerizzata . . . . . . . . . . . . . . . . . . .
4.1.4 Risonanza magnetica cardiaca . . . . . . . . . . . . . . . . .
4.1.5 Medicina nucleare . . . . . . . . . . . . . . . . . . . . . . . . . .
4.1.6 Cateterismo cardiaco . . . . . . . . . . . . . . . . . . . . . . .
4.1.7 Imaging multimodale . . . . . . . . . . . . . . . . . . . . . . .
4.2 Proposta di un procedimento diagnostico generale . . . . . . .
5. Eziologie specifiche delle sindromi pericardiche . . . . . . . . . . . . .
5.1 Pericarditi virali . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.1.2 Definizione e spettro clinico . . . . . . . . . . . . . . . . . .
5.1.3 Patogenesi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.1.4 Diagnosi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.1.5 Identificazione degli acidi nucleici virali . . . . . . . . . .
5.1.6 Terapia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.2 Pericarditi batteriche . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.2.1 Pericardite tubercolare . . . . . . . . . . . . . . . . . . . . . . .
5.2.1.1 Diagnosi . . . . . . . . . . . . . . . . . . . . . . . . . .
5.2.1.2 Terapia . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.2.2. Pericardite purulenta . . . . . . . . . . . . . . . . . . . . . . .
5.2.2.1 Epidemiologia . . . . . . . . . . . . . . . . . . . . .
5.2.2.2 Diagnosi . . . . . . . . . . . . . . . . . . . . . . . . . .
5.2.2.3 Terapia . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.3 La pericardite nell’insufficienza renale . . . . . . . . . . . . . . . . .
5.4. Coinvolgimento pericardico nelle malattie
autoimmuni sistemiche e autoinfiammatorie . . . . . . . . . . .
5.5 Le sindromi post-lesione cardiaca . . . . . . . . . . . . . . . . . . . .
5.5.1 Definizione e diagnosi . . . . . . . . . . . . . . . . . . . . . . .
5.5.2 Terapia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.5.3 Prevenzione . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.5.4 Prognosi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.5.4.1 Pericardite postinfartuale . . . . . . . . . . . . .
5.5.4.2 Versamenti postoperatori . . . . . . . . . . . . .
5.6 Versamento pericardico traumatico ed emopericardio . . . .
5.7 Coinvolgimento del pericardio nella malattia neoplastica . .
5.8 Altre forme di malattia del pericardio . . . . . . . . . . . . . . . . .
5.8.1 Pericardite da radiazioni . . . . . . . . . . . . . . . . . . . . .
5.8.2 Chilopericardio . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.8.3 Pericardite e versamento pericardico
correlati ai farmaci . . . . . . . . . . . . . . . . . . . . . . . . .
5.8.4 Versamento pericardico nelle malattie del metabolismo
e del sistema endocrino . . . . . . . . . . . . . . . . . . . . . . . .
703
703
704
705
705
705
705
705
706
707
709
709
709
709
710
711
711
712
712
712
713
713
714
714
715
716
716
716
716
717
717
717
718
719
719
719
719
719
719
721
721
722
722
723
723
723
724
724
725
725
725
725
725
726
727
727
727
727
728
728
728
729
729
729
729
729
730
730
730
731
731
732
733
733
6.
7.
8.
9.
10.
11.
12.
5.8.5. Versamento pericardico nell’ipertensione arteriosa
polmonare . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.8.6 Cisti pericardiche . . . . . . . . . . . . . . . . . . . . . . . . . . .
Aspetti correlati all’età e al sesso nelle malattie del pericardio .
6.1 Età pediatrica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
6.2 Gravidanza, allattamento e questioni relative
alla funzione riproduttiva . . . . . . . . . . . . . . . . . . . . . . . . . .
6.3 Paziente anziano . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Tecniche interventistiche e chirurgia . . . . . . . . . . . . . . . . . . . . .
7.1 Pericardiocentesi e drenaggio pericardico . . . . . . . . . . . . . .
7.2 Pericardioscopia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
7.3 Analisi del liquido pericardico, biopsia del pericardio
e dell’epicardio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
7.4 Trattamento intrapericardico . . . . . . . . . . . . . . . . . . . . . . . .
7.5 Accesso pericardico per elettrofisiologia . . . . . . . . . . . . . . .
7.6 La chirurgia per le malattie del pericardio . . . . . . . . . . . . . .
7.6.1 Finestra pericardica . . . . . . . . . . . . . . . . . . . . . . . . .
7.6.2 Pericardiectomia . . . . . . . . . . . . . . . . . . . . . . . . . . .
Prospettive e questioni irrisolte . . . . . . . . . . . . . . . . . . . . . . . . .
Cosa fare e cosa non fare: messaggi dalle linee guida
sulle malattie del pericardio . . . . . . . . . . . . . . . . . . . . . . . . . . .
Addenda online . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Appendice
......................................
Bibliografia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
733
733
734
734
734
735
735
735
735
736
736
736
736
736
736
737
737
738
738
738
ABBREVIAZIONI ED ACRONIMI
CK
CMP
CMV
CP
EBV
ECG
ESRD
FANS
FDG
FMF
HR
IL-1
IMA
IVIG
LCE
OR
PAH
PCIS
PCR
PET
PPS
RMC
SSFP
STIR
TC
TNF
VEGF
VES
creatinina chinasi
cardiomiopatia
cytomegalovirus
Child-Pugh
virus di Epstein-Barr
elettrocardiogramma
insufficienza renale terminale
farmaci antinfiammatori non steroidei
fluorodeossiglucosio
febbre mediterranea familiare
hazard ratio
interleuchina-1
infarto miocardico acuto
immunoglobuline per via endovenosa
late contrast-enhanced
odds ratio
ipertensione arteriosa polmonare
sindromi post-lesione cardiaca
proteina C-reattiva
tomografia ad emissione di positroni
sindrome post-pericardiotomica
risonanza magnetica cardiaca
steady-state free-precession
short-tau inversion recovery
tomografia computerizzata
fattore di necrosi tumorale
fattore di crescita endoteliale vascolare
velocità di eritrosedimentazione
PREFAZIONE
Le linee guida hanno l’obiettivo di riassumere e valutare le evidenze disponibili in merito ad uno specifico argomento al momento della loro scrittura al fine di coadiuvare il medico nella
scelta della migliore strategia gestionale per ciascun paziente
affetto da una determinata patologia, tenendo conto non solo l’impatto prognostico ma anche il rapporto rischio-beneficio
connesso ad una particolare procedura diagnostica o terapeutica. Le linee guida e le raccomandazioni hanno lo scopo di assistere il medico nel processo decisionale della pratica clinica
quotidiana, anche se il giudizio finale spetta comunque al medico dopo aver consultato il paziente e/o chi lo assiste.
Negli ultimi anni sono state emanate numerose linee guida,
redatte sia dalla Società Europea di Cardiologia (ESC) sia da diverse organizzazioni o società scientifiche. In considerazione
del loro impatto sulla pratica clinica, sono stati definiti alcuni
criteri di qualità per l’elaborazione delle linee guida, affinché
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
703
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
tutte le decisioni risultassero trasparenti per l’utilizzatore finale. Le raccomandazioni per la stesura e l’emissione delle linee
guida ESC sono consultabili sul sito web dell’ESC (http://www.
escardio.org/guidelines-surveys/esc-guidelines/about/Pages/
rules-writing.aspx). Le linee guida ESC rappresentano la posizione ufficiale della Società in riferimento ad uno specifico argomento e sono soggette ad aggiornamenti periodici.
I membri di questa Task Force sono stati nominati dall’ESC
per rappresentare i professionisti sanitari coinvolti nella cura dei
pazienti affetti da questa patologia. Gli esperti designati hanno effettuato una revisione completa delle evidenze pubblicate per la gestione (includendo la diagnosi, il trattamento, la prevenzione e la riabilitazione) di una data condizione in accordo
con gli indirizzi del Comitato ESC per le Linee Guida Pratiche
(CPG). È stata eseguita una valutazione critica delle procedure
diagnostiche e terapeutiche includendo la valutazione del rapporto rischio-beneficio. Laddove i dati erano disponibili, sono
state incluse anche le stime degli outcome attesi. I livelli di evidenza e la forza delle raccomandazioni di specifiche opzioni
diagnostico-terapeutiche sono stati soppesati e classificati secondo scale predefinite come riportato nelle Tabelle 1 e 2.
Gli esperti delle commissioni di scrittura e revisione hanno
fornito le dichiarazioni di interessi che potrebbero essere percepite come potenziali o reali conflitti di interesse. Tali dichiarazioni sono disponibili sul sito web dell’ESC (http://www.escardio.org/guidelines). Qualsiasi variazione di conflitto di interesse che sia verificato durante il periodo di scrittura delle linee
guida è stato notificato all’ESC ed aggiornato. La Task Force è
stata interamente finanziata dall’ESC, senza alcuna compartecipazione dell’industria farmaceutica e delle case produttrici di
strumentazione elettromedicale o chirurgica.
Il CPG dell’ESC supervisiona e coordina la preparazione delle linee guida elaborate dalle task force, dai gruppi di esperti e dai
consensus panel, come pure è responsabile del relativo processo di endorsement. Le linee guida ESC vengono sottoposte ad
un’approfondita revisione da parte del CPG e di esperti esterni.
Dopo aver apportato le necessarie modifiche, il documento viene quindi approvato da tutti gli esperti della Task Force e la versione definitiva approvata dal CPG viene pubblicata sullo European Heart Journal. Le linee guida sono state elaborate dopo
un’accurata valutazione delle conoscenze mediche e scientifiche
e delle evidenze disponibili al momento della loro stesura.
Il compito di redigere linee guida prevede sia l’integrazione delle evidenze più recenti sia l’istituzione di mezzi formativi e di
programmi di attuazione delle raccomandazioni. Per implementare le linee guida, è necessario realizzare versioni tascabili, diapositive riassuntive, opuscoli con i messaggi essenziali,
schede riassuntive per i medici non specialisti e versioni elet-
Tabella 2. Livelli di evidenza.
Livello di evidenza A
Dati derivati da numerosi trial clinici
randomizzati o metanalisi
Livello di evidenza B
Dati derivati da un singolo trial clinico
randomizzato o da ampi studi non
randomizzati
Livello di evidenza C
Consenso degli esperti e/o studi di piccole
dimensioni, studi retrospettivi e registri
troniche per le applicazioni digitali (smartphone). Tuttavia, essendo queste versioni abbreviate, quando necessario si deve
sempre fare riferimento alla versione integrale, gratuitamente
disponibile sul sito web dell’ESC.
Le società nazionali affiliate all’ESC sono incoraggiate a supportare, tradurre ed implementare le linee guida ESC. I programmi di attuazione sono necessari in quanto è stato dimostrato un miglioramento dell’outcome ogni qualvolta siano state applicate rigorosamente le raccomandazioni cliniche.
La chiusura del cerchio composto dalla ricerca clinica, la stesura delle linee guida e la loro attuazione nella pratica clinica
può ottenersi solo se siano organizzati studi e registri volti a verificare che la reale pratica quotidiana sia in linea con quanto
raccomandato dalle linee guida.
I professionisti sanitari sono invitati a prendere in debita considerazione le linee guida ESC nell’esercizio del loro giudizio clinico, nonché nella definizione ed implementazione delle strategie
mediche preventive e diagnostico-terapeutiche. Le linee guida comunque non sopperiscono alla responsabilità individuale dei professionisti sanitari nel prendere le decisioni più appropriate per le
condizioni di salute di ciascun paziente dopo aver consultato il
paziente stesso o, laddove necessario e/o indicato, il suo tutore o
curatore. È altresì responsabilità del professionista sanitario verificare quali siano le normative e le direttive vigenti inerenti ai farmaci e ai dispositivi medicali al momento della loro prescrizione.
1. INTRODUZIONE
Il pericardio (dal greco περί, “attorno” e κάρδιον, “cuore”) è
un sacco a doppia parete che contiene il cuore e la radice dei
grandi vasi. Il sacco pericardico ha due strati, uno sieroso (anche noto come epicardio e in contatto con il miocardio) ed uno
fibroso parietale. Include la cavità pericardica che contiene il liquido pericardico. Il pericardio fissa il cuore al mediastino e lo
protegge dalle infezioni, agendo anche come lubrificante.
Le malattie del pericardico possono presentarsi sia come
processo isolato sia come parte di una malattie sistemica1-5. Le
Tabella 1. Classi delle raccomandazioni.
Classe della
raccomandazione
Definizione
Espressione consigliata
Classe I
Evidenza e/o consenso generale che un determinato trattamento o intervento
sia vantaggioso, utile ed efficace
È raccomandato/indicato
Classe II
Evidenza contrastante e/o divergenza di opinione circa l’utilità/efficacia
di un determinato trattamento o intervento
Classe IIa
Il peso dell’evidenza/opinione è a favore dell’utilità/efficacia
Classe IIb
L’utilità/efficacia risulta meno chiaramente accertata sulla base dell’evidenza/opinione
Può essere preso in considerazione
Evidenza o consenso generale che un determinato trattamento o intervento
non sia utile/efficace e che in taluni casi possa essere dannoso
Non è raccomandato
Classe III
704
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
Deve essere preso in considerazione
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
principali sindromi pericardiche che si possono riscontrare nella pratica clinica comprendono la pericardite (acuta, incessante, cronica e ricorrente), il versamento pericardico, il tamponamento cardiaco, la pericardite costrittiva e le masse pericardiche1,4,5. Tutte le terapie mediche per le malattie del pericardio
risultano non registrate (off-label) per una specifica indicazione
di patologia pericardica.
aggiornamento delle linee guida per la pratica clinica, anche se
i trial clinici randomizzati controllati sono numericamente contenuti e pertanto le raccomandazioni di classe I con livello di
evidenza A sono limitate.
1.1. Quali sono le novità nell’ambito delle malattie
del pericardio?
2.1 Epidemiologia
Le malattie del pericardio sono relativamente comuni nella pratica clinica e nuovi dati si sono resi disponibili dalla pubblicazione delle precedenti linee guida ESC del 2004 sull’argomento1.
Per il triage dei pazienti con pericardite e versamento pericardico sono state proposte nuove strategie diagnostiche, che
consentono la selezione di pazienti ad alto rischio da ricoverare o da avviare ad indagini diagnostiche aggiuntive4-9. Inoltre,
sono stati proposti specifici criteri diagnostici per la pericardite
acuta e ricorrente nelle pratica clinica2,4-15.
La diagnostica per immagini delle malattie del pericardio è
divenuta un approccio essenziale per una valutazione diagnostica moderna e completa. Sia la Società Americana di Ecocardiografia che l’Associazione Europea di Imaging Cardiovascolare hanno fornito raccomandazioni negli anni recenti2,3.
L’eziologia e la fisiopatologia delle malattie del pericardio
devono ancora essere meglio caratterizzate, ma sono emersi
nuovi dati che supportano la patogenesi immuno-mediata delle recidive e nuove forme correlate alle malattie autoinfiammatorie, specialmente nei pazienti pediatrici4,6. Inoltre sono divenuti disponibili i primi dati epidemiologici7,16.
Sono ora più chiare ed evidenti le problematiche correlate
all’età e al sesso con specifiche raccomandazioni per le donne
durante la gravidanza17-27.
I primi trial multicentrici randomizzati hanno determinato
importanti progressi in ambito terapeutico10,11,13-15. È stato dimostrato che la colchicina è il farmaco di prima scelta da associare alle terapie antinfiammatorie convenzionali sia nel trattamento del primo episodio di pericardite che nelle recidive, consentendo di migliorare la risposta alla terapia, aumentare i tassi di remissione e ridurre le recidive10,11,13-15. Allo scopo di migliorare la compliance del paziente, sono stati inoltre proposti
specifici dosaggi senza dose di carico e con dosi aggiustate per
il peso corporeo11,15.
Si sono rese disponibili nuove opzioni terapeutiche per il
trattamento della pericardite ricorrente refrattaria, quali le terapie immunosoppressive (azatioprina), le immunoglobuline per
via endovenosa (IVIG) e gli antagonisti dell’interleuchina-1 (IL1) (anakinra)20-23,28-32. La pericardiectomia si è dimostrata una
valida alternativa alle terapie mediche tradizionali nei pazienti
con pericardite ricorrente refrattaria33. I primi studi prospettici
e retrospettivi con più di 100 pazienti hanno valutato la prognosi e il rischio di complicanze nei pazienti con pericardite acuta e ricorrente7,9,34-38.
Le tecniche di diagnostica per immagini consentendo di rilevare l’infiammazione pericardica (risonanza magnetica cardiaca [RMC]) possono identificare forme reversibili di pericardite costrittiva, permettendo la scelta di terapie antinfiammatorie empiriche che possono ovviare alla necessità dell’intervento
chirurgico2,39-41.
In conclusione, dal 2004 ad oggi sono divenuti disponibili
nuovi dati significativi, rendendo assolutamente necessario un
2. EPIDEMIOLOGIA, EZIOLOGIA E CLASSIFICAZIONE
DELLE MALATTIE DEL PERICARDIO
Malgrado la frequenza relativamente elevata delle malattie del
pericardio, sono disponibili solo pochi dati epidemiologi, specie
derivati dal contesto della medicina generale. La pericardite è la
più comune malattia del pericardio che si riscontra nella pratica clinica. In un’area urbana italiana, è stata riportata un’incidenza di pericardite acuta di 27.7 casi per 100 000 abitanti/anno7. La pericardite è responsabile dello 0.1% di tutte le ospedalizzazioni e del 5% degli accessi ai dipartimenti di emergenza per dolore toracico4,5,42. Dati provenienti da un registro nazionale finlandese (2000-2009) hanno evidenziato un’incidenza standardizzata di ospedalizzazioni per pericardite acuta pari a 3.32 per 100 000 persone-anno16. Questi dati si riferivano
unicamente ai pazienti ospedalizzati e verosimilmente sono indicativi di una parte limitata della popolazione affetta, in quanto molti pazienti con pericardite non vengono solitamente ricoverati8,9,42,43. Sul totale dei pazienti ospedalizzati, gli uomini
nella fascia di età compresa tra 16 e 65 anni presentavano un
rischio più elevato di pericardite (rischio relativo 2.02) rispetto
alle donne, con una differenza di rischio ancora più marcata fra
gli adulti più giovani. Lo 0.20% di tutti i ricoveri per malattia
cardiovascolare era dovuto a pericardite acuta e la proporzione
dei ricoveri si riduceva del 51% per ogni incremento di 10 anni di età. La mortalità intraospedaliera correlata alla pericardite
acuta era dell’1.1% ed aumentava con l’età e la presenza concomitante di gravi infezioni (polmonite o sepsi)16. Tuttavia, questo studio era incentrato solo sulle ospedalizzazioni. Le recidive interessano circa il 30% dei pazienti entro 18 mesi dal primo episodio di pericardite acuta10,11.
2.2. Eziologia
Una semplice classificazione eziologica delle malattie del pericardio suddivide le forme infettive da quelle non infettive (Tabella 3)4,6,12,44. L’eziologia è varia ed è influenzata dall’epidemiologia locale, dal tipo di popolazione e dallo scenario clinico.
Nei paesi industrializzati, i virus sono usualmente i più comuni
agenti eziologici della pericardite6, mentre la tubercolosi è la
causa più frequente di malattie pericardica nei paesi in via di
sviluppo dove la tubercolosi è ancora endemica e rimane quindi la principale causa mondiale di patologia pericardica. In presenza di tubercolosi, è frequente l’associazione con l’infezione
da HIV, specialmente nell’Africa sub-sahariana44.
3. SINDROMI PERICARDICHE
Le sindromi pericardiche includono differenti presentazioni cliniche delle malattie pericardiche con segni e sintomi distintivi
che consentono di raggruppare le patologie in specifiche “sindromi”. Le classiche sindromi pericardiche comprendono la pericardite, il versamento pericardico, il tamponamento cardiaco
e la pericardite costrittiva. Versamento pericardico e tamponamento cardiaco possono verificarsi in assenza di pericardite e
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
705
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
Tabella 3. Eziologia delle malattie pericardiche. Il pericardio può essere coinvolto da tutte le categorie di patologia: infettiva, autoimmune,
neoplastica, iatrogena, traumatica e metabolica.
Tabella 4. Definizioni e criteri diagnostici per la pericardite (vedere il testo per la spiegazione).
Pericardite
Definizione e criteri diagnostici
Acuta
Sindrome infiammatoria pericardica da diagnosticare
sulla base di almeno 2 dei 4 seguenti criteri:
1. dolore pericardico
2. sfregamenti pericardici
3. nuovo e diffuso sopraslivellamento del tratto ST
o sottoslivellamento del tratto PR all’ECG
4. versamento pericardico (nuovo o in peggioramento).
Reperti aggiuntivi a supporto:
– elevazione dei marker di infiammazione (proteina
C-reattiva, velocità di eritrosedimentazione e conta
leucocitaria);
– evidenza di infiammazione pericardica per mezzo
di una tecnica di imaging (TC o RMC).
Incessante
Pericardite che persiste da oltre 4-6 settimane
ma da meno di 3 mesi senza remissione.
Ricorrente
Recidiva di pericardite dopo un primo episodio
documentato di malattia ed un intervallo libero
da malattia di almeno 4-6 settimanea.
Cronica
Pericardite che persiste da oltre 3 mesi.
A. Cause infettive
Virali (comuni): Enterovirus (coxsackievirus, ecovirus), herpesvirus (EBV,
CMV, HHV-6), adenovirus, prvovirus B19 (possibile sovrapposizione con
gli agenti eziologici della miocardite).
Batteriche: Mycobacterium tuberculosis (comune, altre cause
batteriche sono rare), Coxiella burnetii, Borrelia burgdorferi; raramente:
Pneumococcus spp, Meningococcus spp, Gonococcus spp,
Streptococcus spp, Staphylococcus spp, Haemophilus spp, Chlamydia
spp, Mycoplasma spp, Legionella spp, Leptospira spp, Listeria spp,
Providencia stuartii.
Fungine (molto rare): Histoplasma spp (più comune in soggetti
immunocompetenti), Aspergillus spp, Blastomyces spp, Candida spp
(più frequente in soggetti immunodepressi).
Parassitarie (molto rare): Echinococcus spp, Toxoplasma spp.
B. Cause non infettive
Autoimmuni (comuni): malattie sistemiche autoimmuni ed
autoinfiammatorie (lupus eritematoso sistemico, sindrome di Sjögren,
artrite reumatoide, sclerodermia), vasculiti sistemiche (granulomatosi
eosinofila con poliangite o granulomatosi allergica, precedentemente
denominata sindrome di Churg-Strauss, malattia di Horton, malattia di
Takayasu, sindrome di Behçet), sarcoidosi, febbre familiare mediterranea,
malattie infiammatorie croniche intestinali, malattia di Still.
Neoplastiche: tumori primari (rari, soprattutto il mesotelioma
pericardico).
Tumori secondari metastatici (comuni, soprattutto carcinoma polmonare
e della mammella, linfomi).
Metaboliche: uremia, ipotiroidismo, anoressia nervosa, altre rare.
Traumatiche e iatrogene:
Esordio precoce (rare):
• Danno diretto (trauma toracico penetrante, perforazione esofagea)
• Danno indiretto (trauma toracico non penetrante, danno da radiazioni)
Esordio tardivo: sindromi da lesioni pericardica (comuni) sindrome postinfartuale, sindrome post-pericardiotomica, sindrome post-traumatica,
include forme dopo trauma iatrogeno (procedura coronarica
percutanea, impianto di elettrocateteri da pacemaker, ablazione di
aritmie).
Correlate a farmaci (raro): sindrome lupoide (procainamide,
idralazina, metildopa, isoniazide, fenitoina); agenti antineoplastici
(spesso associati a cardiomiopatia, possono causare una
pericardiopatia): doxorubicina (adriamicina) e daunorubicina, citosina
arabinoside, 5-fluorouracile, ciclofosfamide; penicilline come pericardite
da ipersensibilità con eosinofilia; amiodarone, metisergide, mesalazina,
clozapina, minoxidil, dantrolene, practololo, fenilbutazone, diuretici
tiazidici, streptomicina, tiouracile, streptochinasi, acido p-aminosalicilico,
ciclosporina, bromocriptina, vaccini, GM-CSF, agenti anti-TNF.
Altre cause (comuni): amiloidosi, dissezione aortica, ipertensione
arteriosa polmonare e scompenso cardiaco cronico.
Altre cause (non comuni): assenza congenita parziale o completa del
pericardio.
CMV, cytomegalovirus; EBV, virus di Epstein-Barr; GM-CSF, granulocytemacrophage colony stimulating factor; HHV, herpesvirus umano; spp,
specie; TNF, fattore di necrosi tumorale.
saranno discussi in capitoli a parte. Specifiche considerazioni
valgono per la pericardite con concomitante coinvolgimento
infiammatorio miocardico, solitamente definite in letteratura
come “miopericardite”.
3.1 Pericardite acuta
La pericardite acuta è una sindrome infiammatoria pericardica con o senza versamento pericardico1-11,42. La diagnosi clinica si basa sul riscontro di almeno due dei seguenti criteri
(Tabella 4)2,4-15: (1) dolore toracico (>85-90% dei casi) – tipicamente acuto e pleuritico, attenuato dalla posizione seduta
706
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
ECG, elettrocardiogramma; RMC, risonanza magnetica cardiaca; TC, tomografia computerizzata.
asolitamente entro 18-24 mesi, anche se non è stato definito un limite temporale esatto.
e con flessione in avanti del busto a paziente seduto; (2) sfregamenti pericardici (in circa un terzo dei pazienti) – un suono
superficiale che simula un rumore di scricchiolamento/graffiamento e meglio percepibile con il diaframma dello stetoscopio sul margine sternale sinistro; (3) alterazioni elettrocardiografiche (fino al 60% dei casi) con insorgenza di nuovo e
diffuso sopraslivellamento del tratto ST o depressione del tratto PR nella fase acuta (Figura 1 online); e (4) versamento pericardico (generalmente lieve, fino al 60% dei casi) (Figura 2
online). Segni e sintomi aggiuntivi possono essere presenti in
base all’eziologia sottostante o alla presenza di una malattia
sistemica (segni e sintomi di un’infezione sistemica quale febbre e leucocitosi, o una malattia infiammatoria sistemica o
una neoplasia)45.
Un sopraslivellamento diffuso del tratto ST è stato riportato come un segno tipico della pericardite acuta (Figura 1 online). Tuttavia, le alterazioni ECG implicano un’infiammazione
dell’epicardio, in quanto il pericardio parietale è di per sé elettricamente silente5-7,34. L’evoluzione temporale delle tipiche alterazioni ECG in presenza di pericardite acuta, rilevabili fino al
60% dei casi10,11, è estremamente variabile da un paziente all’altro ed è condizionata dalla terapia. Le più importanti diagnosi differenziali comprendono le sindromi coronariche acute
con sopraslivellameno del tratto ST e la ripolarizzazione precoce6,12,46.
L’elevazione dei marker di infiammazione (proteina C-reattiva [PCR], velocità di eritrosedimentazione [VES], leucocitosi) è
un riscontro comune che supporta il sospetto diagnostico di
pericardite acuta e può essere utile nel monitorare l’attività della malattia e l’efficacia della terapia2,47. I pazienti con concomitante miocardite possono presentare un’elevazione dei marker di danno miocardico (creatina chinasi [CK], troponina)7,34.
In linea di massima, la radiografia del torace è normale nei
pazienti con pericardite acuta, in quanto un aumento dell’indice cardiotoracico si verifica solo in presenza di versamenti pericardici che superano i 300 ml48. In caso di malattia pleuro-
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
polmonare sono rilevabili segni radiologici della malattia pleuropolmonare2,3.
Raccomandazioni per la diagnosi di pericardite acuta
Classea
Livellob
In tutti i pazienti con sospetta pericardite
acuta è raccomandato un ECG.
I
C
In tutti i pazienti con sospetta pericardite
acuta è raccomandato un esame
ecocardiografico transtoracico.
I
C
In tutti i pazienti con sospetta pericardite
acuta è raccomandata una radiografia
standard del torace.
I
C
In tutti i pazienti con sospetta pericardite
acuta è raccomandata la valutazione
dei marker di infiammazione (PCR)
e di danno miocardico (CK, troponina).
I
C
Raccomandazioni
Ref.c
CK, creatina chinasi; PCR, proteina C-reattiva.
della raccomandazione.
b
livello di evidenza.
c
referenza bibliografica a supporto delle raccomandazioni.
aclasse
3.1.1 Gestione clinica e terapia
Non è obbligatoria la ricerca eziologica per tutti i pazienti, specialmente in paesi a bassa prevalenza di tubercolosi, in consi-
derazione del decorso clinico relativamente benigno che contraddistingue le cause comuni di pericardite e la scarsa resa diagnostica con le metodiche diagnostiche tradizionali6,8,12,49. Specifiche cause identificabili (non virali, non idiopatiche) così come determinate caratteristiche di alto rischio nel contesto di
una pericardite acuta sono state associate ad un aumentato rischio di complicanze al follow-up (tamponamento cardiaco, recidive, costrizione pericardica)9,12,43,50. All’analisi multivariata, i
principali fattori di rischio correlati ad una prognosi sfavorevole sono risultati una febbre elevata (>38°C), un decorso subacuto (sintomi persistenti per alcuni giorni senza esordio acuto),
grave versamento pericardico (definito come uno spazio ecoprivo diastolico >20 mm), il tamponamento cardiaco o la mancata risposta nei primi 7 giorni alla terapia con farmaci antinfiammatori non steroidei (FANS)9,43,50. Dovrebbero essere considerati anche altri fattori di rischio (“fattori di rischio minori”)
(ndt: non validati dall’analisi multivariata) basati sul parere degli esperti e sulla revisione della letteratura, quali pericardite associata a miocardite (miopericardite), immunodepressione,
trauma e terapia anticoagulante orale.
Su queste basi viene proposto un triage per la pericardite acuta (Figura 1; Tabella 6 online)5,6,43. Qualsiasi presentazione clinica
che lasci sospettare un’eziologia specifica sottostante (malattia
infiammatoria sistemica) o che sia associata ad almeno un predittore prognostico negativo (fattore di rischio maggiore o minore) pone l’indicazione al ricovero ospedaliero e alla ricerca eziologica9,43,49-51. Di contro, i pazienti senza queste caratteristiche pos-
Figura 1. Triage proposto per la pericardite acuta sulla base dell’epidemiologia locale e dei predittori prognostici negativi alla presentazione
(modificata da [5,6,8,12]). La presenza di almeno un predittore prognostico negativo è sufficiente per identificare un caso ad alto rischio. I criteri maggiori sono stati validati all’analisi multivariata9, i criteri minori sono basati sul parere degli esperti o la revisione della letteratura. I casi a
rischio moderato sono definiti come casi senza predittori prognostici negativi ma con risposta incompleta o assente alla terapia con farmaci antinfiammatori non steroidei (FANS). I casi a basso rischio includono quelli senza predittori prognostici negativi e con buona risposta alla terapia
antinfiammatoria. Per “eziologia specifica” si intende un’eziologia non idiopatica.
ECG, elettrocardiogramma; PCR, proteina C-reattiva.
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
707
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
sono essere trattati ambulatoriamente con terapia antinfiammatoria emprica con follow-up a breve termine e rivalutazione dopo 1 settimana per verificare la risposta al trattamento9.
Raccomandazioni per la gestione dei pazienti con pericardite
acuta
Classea
Livellob
Ref.c
Nei pazienti ad alto rischio con pericardite
acuta (almeno un predittore prognostico
negativod) è raccomandato il ricovero
ospedaliero.
I
B
8,9
Nei pazienti a basso rischio con pericardite
acuta è raccomandato il trattamento
ambulatoriale.
I
B
8,9
Si raccomanda di valutare la risposta
alla terapia antinfiammatoria dopo
1 settimana.
I
B
8,9
Raccomandazioni
medica e prevenire le recidive10,11,57-59. Non è obbligatoria
una riduzione scalare del dosaggio, che tuttavia può essere
presa in considerazione per prevenire la persistenza dei sintomi e le recidive5,6,56. La terapia corticosteroidea deve essere considerata una seconda scelta per i pazienti con controindicazioni o non responsivi all’aspirina o ai FANS, in quanto favorisce la cronicizzazione e lo sviluppo di dipendenza
dal farmaco; quando utilizzata sono raccomandate dosi medio-basse (prednisone 0.2-0.5 mg/kg/die o equivalente, e
non 1.0 mg/kg/die o equivalente) in associazione alla colchicina.35 La dose iniziale deve essere mantenuta fino a risoluzione dei sintomi e normalizzazione dei livelli di CRP, considerando successivamente la riduzione graduale della posologia5,6,35,47,56.
Raccomandazioni per il trattamento della pericardite acuta
a
classe della raccomandazione.
livello di evidenza.
creferenza bibliografica a supporto delle raccomandazioni.
d
vedere Figura 1 (sia predittori prognostici negativi maggiori che minori).
Raccomandazioni
Classea
Livellob
Ref.c
I
A
55
I
A
10,11,
58,59
IIa
C
IIa
C
IIa
C
IIa
C
III
C
b
Nei pazienti con una causa identificata differente da quella virale, è indicata una terapia specifica per la condizione sottostante49,51 e deve essere preso in considerazione il contesto
epidemiologico (alta vs bassa prevalenza di tubercolosi)8,12,52.
Per i pazienti che non svolgono attività sportiva a livello agonistico, la prima raccomandazione terapeutica non farmacologica è quella di limitare l’attività fisica al di fuori delle attività sedentarie ordinarie sino alla risoluzione dei sintomi e alla
normalizzazione della PCR53. Per gli atleti, il ritorno all’attività
sportiva agonistica è raccomandato solo dopo la regressione
dei sintomi e la normalizzazione dei reperti degli esami strumentali (PCR, ECG ed ecocardiogramma)53,54. Una minima limitazione di 3 mesi (dopo l’esordio della pericardite) è stata
raccomandata arbitrariamente secondo il parere degli esperti54. Si suggerisce di applicare tale limitazione solo agli atleti,
mentre un periodo di tempo anche più breve (fino alla remissione) può essere indicato per i non atleti. L’aspirina o i FANS
rappresentano il trattamento cardine della pericardite acuta5,6,55,56. Sono stati suggeriti differenti agenti antinfiammatori (Tabella 5).
La scelta del farmaco deve essere basata sull’anamnesi del
paziente (controindicazioni, precedente efficacia o effetti collaterali), la presenza di patologie associate (prediligere l’aspirina rispetto ai FANS nei pazienti già in trattamento antiaggregante) e l’esperienza medica56.
La colchicina è raccomandata a basse dosi, aggiustate per
il peso corporeo, al fine di migliorare la risposta alla terapia
L’aspirina o i FANS con gastroprotezione
sono raccomandati come trattamento
di prima scelta della pericardite acuta.
La colchicina è raccomandata come
trattamento di prima scelta
della pericardite acuta in associazione
alla terapia con aspirina/FANS.
I livelli sierici di PCR devono essere utilizzati
come guida per stabilire la durata
e verificare la risposta alla terapia.
I corticosteroidi a basse dosid devono
essere presi in considerazione nei pazienti
con pericardite acuta in caso di
controindicazioni o mancata risposta
ad aspirina/FANS e colchicina, quando
sia stata esclusa una causa infettiva o
sia presente una malattia autoimmune.
La restrizione all’esercizio fisico deve essere
presa in considerazione nei non atleti
con pericardite acuta sino a risoluzione
dei sintomi e normalizzazione della PCR,
ECG ed ecocardiogramma.
Negli atleti, deve essere presa in
considerazione una restrizione
all’esercizio fisico di almeno 3 mesi
sino a risoluzione dei sintomi e
normalizzazione della PCR, ECG ed
ecocardiogramma.
I corticosteroidi non sono raccomandati
come terapia di prima scelta per il
trattamento della pericardite acuta.
ECG, elettrocardiogramma; FANS, farmaci antinfiammatori non steroidei;
PCR, proteina C-reattiva.
aclasse della raccomandazione.
blivello di evidenza.
creferenza bibliografica a supporto delle raccomandazioni.
din aggiunta alla colchicina.
Tabella 5. Terapia antinfiammatoria comunemente prescritta per la pericardite acuta.
Farmaco
Dosaggio usualea
Durata della terapiab
Riduzione del dosaggioa
Aspirina
Ibuprofene
Colchicina
750-1000 mg ogni 8h
600 mg ogni 8h
0.5 mg/die (se peso <70 kg) o 0.5 mg
in monodose (se peso ≥70 kg)
1-2 settimane
1-2 settimane
3 mesi
Ridurre la dose di 250-500 mg ogni 1-2 settimane
Ridurre la dose di 200-400 mg ogni 1-2 settimane
Non obbligatorio, in alternativa 0.5 mg a giorni alterni
(se peso <70 kg) nelle ultime settimane
ala
riduzione della terapia dovrebbe essere considerata per l’aspirina e i farmaci antinfiammatori non steroidei.
durata della terapia è in funzione dalla durata dei sintomi e dei valori della proteina C-reattiva ed è generalmente di 1-2 settimane nei casi non complicati. Deve essere prescritta una gastroprotezione. La colchicina viene associata all’aspirina o all’ibuprofene.
bla
708
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
3.1.2 Prognosi
La maggior parte dei pazienti con pericardite acuta (generalmente quelli con presunta pericardite virale o idiopatica) hanno una buona prognosi a lungo termine36. Il tamponamento
cardiaco si verifica raramente nei pazienti con pericardite acuta idiopatica, mentre è più frequente nei pazienti con un’eziologia sottostante specifica come una neoplasia, la tubercolosi o
la pericardite purulenta. La pericardite costrittiva può riscontrarsi in meno dell’1% dei pazienti con pericardite acuta idiopatica ed è anch’essa molto più frequente in quelli con un’eziologia specifica. Il rischio di sviluppare una pericardite costrittiva
può essere classificato in basso (<1%) per la pericardite idiopatica o presunta eziologia virale, intermedio (2-5%) per l’eziologia autoimmune, immuno-mediata o neoplastica ed alto (2030%) per l’eziologia batterica, specialmente nelle forme tubercolare e purulenta36. Circa il 15-30% dei pazienti con pericardite acuta idiopatica non trattati con la colchicina sono destinati a sviluppare un decorso incessante o ricorrente, laddove
la colchicina può dimezzare i tassi di recidiva10,11,13-15.
3.2 Pericardite incessante e cronica
Il termine “incessante” è stato adottato per i casi con sintomi
persistenti senza una chiara remissione dopo l’episodio acuto.
Il termine “cronico” è generalmente riferito, specialmente per
i versamenti pericardici, ad una malattia che persiste da oltre 3
mesi48. La Task Force suggerisce di adottare il termine “acuto”
per la pericardite di nuova insorgenza, il termine “incessante”
per la pericardite con sintomi persistenti da oltre 4-6 settimane
(che è generalmente la durata approssimativa della terapia antinfiammatoria convenzionale e della successiva graduale riduzione del dosaggio)11,60 e il termine “cronico” per i casi con durata della malattia >3 mesi.
3.3 Pericardite ricorrente
La pericardite ricorrente è diagnosticata in presenza di un episodio documentato di pericardite acuta, seguito da una recidiva di pericardite dopo un intervallo libero da malattia di almeno 4-6 settimane (Tabella 4)11,13-15. La diagnosi di recidiva viene stabilita sulla base degli stessi criteri utilizzati per la pericardite acuta. L’elevazione della PCR2,47, la TC e/o la RMC possono fornire elementi a conferma della diagnosi in caso di presentazioni atipiche o dubbie, evidenziando la presenza di infiammazione pericardica attraverso il riscontro di edema o captazione del mezzo di contrasto2,39.
Il tasso di recidiva dopo un primo episodio di pericardite varia dal 15% al 30%10,11 e può arrivare al 50% dopo una prima
recidiva in pazienti non trattati con colchicina13-15, in particolare quando trattati con terapia corticosteroidea.
Nei paesi industrializzati, spesso l’eziologia non viene chiaramente identificata nella maggior parte dei soggetti immunocompetenti, ed è generalmente di presunta eziologia immunomediata60-62. L’occorrenza di recidive è frequentemente dovuta ad un trattamento inadeguato del primo episodio di pericardite. Quando vengono condotti studi aggiuntivi virologici sul
liquido o tessuto pericardico, può essere identificata un’eziologia virale fino al 20% dei casi63.
3.3.1 Terapia
La terapia della pericardite ricorrente deve essere mirata all’eziologia sottostante quando questa è identificabile. L’aspirina o i FANS rimangono il cardine della terapia (Tabella 6, Box
e Tabella 1 online). La colchicina è raccomandata in associazione alla terapia antinfiammatoria senza dose di carico e a
dosi aggiustate per il peso corporeo (0.5 mg/die se peso <70
kg o 0.5 mg bid se peso ≥70 kg per 6 mesi) (Tabella 6, Tabella 1B online) allo scopo di migliorare la risposta alla terapia medica, aumentare le probabilità di remissione e prevenire le recidive13-15,58,59.
In caso di parziale risposta all’aspirina/FANS e alla colchicina, possono essere usati i corticosteroidi, che tuttavia devono
essere aggiunti a dosi medio-basse all’aspirina/FANS e alla colchicina come triplice terapia e non rimpiazzare questi farmaci,
in modo da ottenere un miglior controllo della sintomatologia.
La somministrazione di farmaci corticosteroidei a dosi mediobasse (prednisone 0.2-0.5 mg/kg/die) deve essere evitata quando non può essere esclusa la presenza di infezioni, in particolare batteriche o tubercolari, oppure deve essere limitata ai pazienti con specifiche indicazioni (malattie infiammatorie sistemiche, sindromi post-pericardiotomiche, gravidanza) o con controindicazioni ai FANS (vera allergia, recente ulcera peptica o
sanguinamento gastrointestinale, terapia anticoagulante orale
con rischio di sanguinamento considerato alto o inaccettabile),
intolleranza o malattia persistente nonostante terapia a dosi
adeguate58. Sebbene i farmaci corticosteroidei consentano un
rapido controllo dei sintomi, essi favoriscono la cronicizzazione,
le recidive e gli effetti collaterali35,55,61 e, quando utilizzati, è
necessario ridurre molto gradualmente la posologia. È presente una soglia critica per l’insorgenza di recidive durante la riduzione della posologia, posta a 10-15 mg/die di prednisone o
corticosteroide equivalente. A questa soglia, sono utili decrementi di piccola entità come 1.0-2.5 mg ad intervalli di 2-6 settimane. In caso di recidiva, deve essere fatto ogni sforzo possibile per non aumentare la dose dello steroide o riprenderne la
somministrazione (Tabelle 6 e 7)5,6,35,61.
Dopo aver ottenuto una risposta completa, la riduzione del
dosaggio deve essere effettuata con una classe di farmaci alla
volta ed alla fine la colchicina è l’ultimo farmaco ad essere sospeso (dopo diversi mesi nei casi più complicati). Le recidive sono possibili dopo la sospensione di ciascun farmaco. Ogni riduzione del dosaggio deve essere effettuato solo quando il paziente è asintomatico e presenta normali livelli di PCR5,6,47,56.
La Task Force non raccomanda la vaccinazione antinfluenzale
come misura preventiva della pericardite nei pazienti con pericardite ricorrente, in quanto il virus influenzale non è una causa usuale di pericardite. La vaccinazione antinfluenzale deve essere somministrata seguendo le indicazioni specifiche oltre la
prevenzione della pericardite; inoltre considerata la patogenesi generalmente immuno-mediata, la stimolazione inappropriata e involontaria del sistema immunitario potrebbe scatenare o peggiorare un episodio di pericardite.
Un approccio alternativo efficace per ridurre al minimo gli
effetti collaterali sistemici correlati ai farmaci corticosteroidei
potrebbe essere la somministrazione intrapericardica di corticosteroidi non assorbibili64,65, ma questa tecnica richiede ulteriore ricerca. Per i pazienti che necessitano di un trattamento
prolungato ad alte dosi (prednisone 15-25 mg/die) per il controllo della pericardite o non rispondono alla terapia antiinfiammatoria, sono stati impiegati diversi altri farmaci quali azatioprina28, IVIG (immunomodulatrici ma anche antivirali)29,30 e
anakinra, un antagonista ricombinante del recettore dell’IL1β31,32, ma non esistono dati forti basati sull’evidenza scientifica (Tabella 2 online). L’impiego di altri trattamenti immunosoppressivi (ciclofosfamide, ciclosporina, metotrexate, idrossiG ITAL CARDIOL | VOL 16 | DICEMBRE 2015
709
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
Tabella 6. Terapia antinfiammatoria comunemente prescritta per la pericardite ricorrente (per ulteriori dettagli si vedano le Tabelle 1A e 1B online).
Farmaco
Dosaggio iniziale usualea
Durata della terapiab
Riduzione del dosaggioa
Aspirina
Ibuprofene
Indometacina
500-1000 mg ogni 6-8h (range 1.5-4 g/die)
600 mg ogni 8h (range 1200-2400 mg)
25-50 mg ogni 8h: iniziare con la dose più bassa
ed aumentare per evitare cefalea e vertigini
0.5 mg bid o 0.5 mg/die nei pazienti con peso
<70 kg o intolleranti alle dosi più elevate
settimane-mesi
settimane-mesi
settimane-mesi
Ridurre la dose di 250-500 mg ogni 1-2 settimaneb
Ridurre la dose di 200-400 mg ogni 1-2 settimaneb
Ridurre la dose di 25 mg ogni 1-2 settimaneb
Almeno 6 mesi
Non necessaria, in alternativa 0.5 mg a giorni alterni
(se peso <70 kg) o 0.5 mg in monodose
(se peso ≥70kg) nelle ultime settimane
Colchicina
a
la riduzione del dosaggio deve essere considerata per l’aspirina e i FANS.
intervalli di riduzione del dosaggio più graduali possono essere considerati per i casi più complessi e resistenti.
b
Tabella 7. Riduzione del dosaggio dei farmaci corticosteroidei35 (le informazioni fornite riguardano il prednisone).
Dose iniziale 0.25-0.50 mg/kg/diea
>50 mg
50-25 mg
25-15 mg
<15 mg
Riduzioneb
10 mg/die ogni 1-2 settimane
5-10 mg/die ogni 1-2 settimane
2.5 mg/die ogni 2-4 settimane
1.25-2.5 mg/die ogni 2-6 settimane
aevitare
dosi più alte tranne in determinati casi e solo per pochi giorni con
una rapida riduzione a 25 mg/die. 25 mg di prednisone equivalgono a 20 mg
di metilprednisolone.
bogni riduzione della dose del prednisone deve essere attuata solo quando
il paziente è asintomatico e presenta normali livelli di proteina C-reattiva,
specie per dosi <25 mg/die. Un supplemento di calcio di 1200-1500 mg/die
e di vitamina D di 800-1000 UI/die deve essere prescritto a tutti i pazienti in
terapia con glucocorticoidi. Inoltre, sono raccomandati i bifosfonati per la
prevenzione dell’osteoporosi negli uomini di età ≥50 anni e nelle donne in
età post-menopausale in cui venga iniziato un trattamento a lungo termine
con glucocorticoidi a dosi ≥5.0-7.5 mg/die di prednisone o equivalente.
clorochina, agenti anti-TNF) è stato riportato solo in casi aneddotici. Dovrebbero essere preferiti gli agenti meno tossici, eventualmente combinati, con una terapia adattata al singolo paziente e all’esperienza del clinico che lo segue (Figura 2). L’azatioprina è principalmente un agente risparmiatore di corticosteroidi a lenta durata d’azione, utile per il controllo della malattia nel lungo termine, mentre le IVIG e l’anakinra sono efficaci nella fase acuta, anche possono verificarsi recidive dopo la
loro sospensione29-32. Farmaci come le IVIG, l’anakinra e l’azatioprina possono essere considerati quando siano state escluse
cause infettive o nei casi dipendenti dalla terapia corticosteroidea o resistenti alla colchicina, dopo un’attenta valutazione dei
costi, dei rischi ed eventuale consultazione con esperti multidisciplinari, come immunologi e/o reumatologi, quando non sia
disponibili competenze specifiche. È anche obbligatorio educare i pazienti e chi li assiste in merito ai rischi connessi all’uso
dei farmaci immunomodulatori ed immunosoppresori e alle misure di sicurezza da adottare durante il trattamento. In ultimo,
può essere presa in considerazione la pericardiectomia ma solo dopo aver considerato l’insuccesso della terapia medica e
l’invio del paziente ad un centro esperto in questa chirurgia33.
Le restrizioni all’attività fisica raccomandate per la pericardite
acuta valgono anche in caso di recidive53,54.
3.3.2 Prognosi
Le complicanze gravi non sono frequenti nella pericardite ricorrente idiopatica37,60,61. Il tamponamento cardiaco è raro e
generalmente si verifica all’inizio della malattia. In questi pazienti non è mai stata riportata l’evenienza di pericardite costrittiva, malgrado anche numerose recidive, e il rischio complessivo è più basso di quello riportato dopo un primo episodio
710
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
Raccomandazioni per la gestione della pericardite ricorrente
Raccomandazioni
L’aspirina e i FANS sono il cardine del trattamento
e sono raccomandati a dosi piene se tollerate,
fino alla completa risoluzione dei sintomi.
La colchicina (0.5 mg bid o 0.5 mg/die
se peso nei pazienti <70 kg o intolleranti
alle dosi più alte) è raccomandata per 6
mesi in aggiunta ad aspirina/FANS.
La terapia prolungata con colchicina (>6
mesi) deve essere presa in considerazione
in alcuni casi sulla base della risposta clinica.
Il dosaggio della PCR deve essere preso in
considerazione per guidare la durata della
terapia e valutare la risposta al trattamento.
Dopo normalizzazione della PCR, deve
essere presa in considerazione la graduale
riduzione delle terapie sulla base dei sintomi
e dei livelli di PCR, interrompendo
una classe di farmaci alla volta.
Farmaci come IVIG anakinra e azatioprina
possono essere presi in considerazione
nei casi di pericardite ricorrente con
dipendenza dai corticosteroidi e non
rispondenti alla colchicina.
La restrizione all’esercizio fisico deve essere
presa in considerazione nei non atleti con
pericardite ricorrente fino alla risoluzione
dei sintomi e normalizzazione della PCR,
tenendo presente l’anamnesi e
le condizioni cliniche.
Una restrizione dell’attività sportiva di almeno
3 mesi deve essere presa in considerazione
negli atleti con pericardite ricorrente fino alla
risoluzione dei sintomi e normalizzazione
della PCR, ECG ed ecocardiogramma.
In caso di cardiopatia ischemica o necessità
di terapia antiaggregante, deve essere
presa in considerazione l’aspirina a dosi
medio-alte (1-2.4 g/die) (Box online).
Se i sintomi ricorrono durante la riduzione
della terapia, deve essere preso in
considerazione di non aumentare la dose
dei corticosteroidi per controllare i sintomi
ma di aumentare la dose massima di aspirina
o FANS, distribuendola bene, generalmente
ogni 8h, con somministrazioni e.v. se
necessario, aggiungendo la colchicina
e analgesici per il controllo del dolore.
La terapia corticosteroidea non è raccomandata
come trattamento di prima linea.
Classea Livellob Ref.c
I
A
55,56
I
A
13-15,
58,59
IIa
C
IIa
C
IIa
C
IIb
C
IIa
C
IIa
C
IIa
C
IIa
C
III
B
13-15,
35,37,55
ECG, elettrocardiogramma; FANS, farmaci antinfiammatori non steroidei;
IVIG, immunoglobuline per via endovenosa; PCR, proteina C-reattiva.
aclasse della raccomandazione.
b
livello di evidenza.
creferenza bibliografica a supporto delle raccomandazioni.
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
Figura 2. Algoritmo terapeutico per la pericardite acuta e ricorrente (si veda il testo per la spiegazione).
I corticosteroidi a basse dossi sono presi in considerazione quando esistono controindicazioni ad altri farmaci o quando si osserva una risposta
incompleta ad aspirina/FANS e colchicina; in questi casi il medico deve valutare l’opportunità di aggiungere questi farmaci invece di sostituirli
ad altre terapie antinfiammatorie.
al’azatioprina è un agente risparmiatore di steroidi che ha un inizio d’azione lento rispetto alle immunoglobuline e all’anakinra. Considerazioni
di ordine economico potrebbero favorire l’opzione a più basso costo (azatioprina), riservando le soluzioni più dispendiose (immunoglobuline ed
anakinra) ai casi refrattari.
di pericardite acuta (<1%)36,37,61. Diventa così importante riassicurare i pazienti sulla loro prognosi, spiegando la natura della malattia e il probabile decorso. Le complicanze sono correlate all’eziologia e non al numero di recidive. Il trattamento farmacologico deve tenere conto della prognosi favorevole ed evitare gli agenti più tossici. Tuttavia, la qualità di vita può essere
gravemente compromessa nei pazienti con recidive ripetute,
pericardite subacuta od incessante e dipendenza da glucocorticoidi.
3.4 Pericardite associata a coinvolgimento
miocardico (miopericardite)
La pericardite e la miocardite hanno in comune l’eziologia e
nella pratica clinica si possono riscontrare forme con sovrapposizione34,66. Sulla base del consenso della Task Force, la pericardite con un coinvolgimento noto o clinicamente sospetto
del miocardio viene definita “miopericardite”, mentre le forme
con prevalente coinvolgimento miocardico vengono definite
“perimiocarditi”. La presentazione classica è rappresentata dal
dolore toracico associato ad altri segni di pericardite (sfregamenti pericardici, sopraslivellamento del tratto ST e versamento pericardico) ed elevazione dei marcatori di danno miocardico (troponine). I dati clinici, seppure limitati, indicano che le infezioni virali sono tra le cause più comuni nei paesi industria-
lizzati, mentre altre cause infettive sono più frequenti nei paesi in via di sviluppo (specie la tubercolosi). I virus cardiotropi possono causare infiammazione pericardica e miocardica attraverso un effetto diretto citolitico o citotossico e/o successivi meccanismi immuno-mediati. Tali meccanismi sono coinvolti in maniera particolare nei casi associati a collagenopatie, malattie infiammatorie croniche intestinali, forme indotte da radiazioni,
coinvolgimento miopericardico indotto da farmaci o vaccini.
Molti casi di miopericardite sono subclinici. In altri pazienti, i
sintomi e segni cardiaci sono mascherati da manifestazioni sistemiche di infezione o infiammazione66. In molti casi, le manifestazioni di miopericardite sono precedute o talvolta concomitanti ad un’infezione respiratoria acuta (specie tonsillite acuta, polmonite) o una gastroenterite. L’aumentata sensibilità dei
test per il dosaggio della troponina e l’uso sempre più diffuso
delle troponine ha notevolmente incrementato il numero dei
casi diagnosticati7,34,66-68.
3.4.1 Definizione e diagnosi
La diagnosi di miopericardite (prevalente pericardite con coinvolgimento miocardico) può essere stabilita clinicamente se un
paziente con criteri definiti per pericardite acuta presenta un
aumento dei marcatori di danno miocardico (troponina I o T,
CK-MB) senza lo sviluppo di alterazioni focali o diffuse della
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
711
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
funzione ventricolare sinistra all’ecocardiografia o alla RMC34.
Il termine “miopericardite” indica una sindrome primariamente pericarditica con un coinvolgimento miocardico minore, che
attiene alla maggior parte dei casi di pericardite con concomitante miocardite riscontrati nella comune pratica clinica7,9,34,68.
In presenza di nuovi segni focali o diffusi di disfunzione ventricolare sinistra in pazienti con elevazione dei marker di danno miocardico e criteri clinici di pericardite acuta viene suggerito l’impiego del termine “perimiocardite” ad indicare la prevalenza della miocardite sul coinvolgimento pericardico34,66. La
conferma della presenza di miocardite richiede l’esecuzione della biopsia endomiocardica, in accordo con il documento di posizione del Myocardial and Pericardial Diseases Working Group
dell’ESC69. Tuttavia, la prognosi benigna dei pazienti con prevalente pericardite e screzio miocarditico (miopericarditi) in assenza di disfunzione ventricolare sinistra o quando questa è solo lieve senza sintomi di insufficienza cardiaca, non implica la
necessità clinica della biopsia endomiocardica6,34,66-68,70,71.
In casi di pericardite con sospetta associata miocardite, è
raccomandata la coronarografia al fine di escludere una sindrome coronarica acuta in accordo con la presentazione clinica e la valutazione dei fattori di rischio. La RMC è raccomandata per confermare il coinvolgimento miocardico e per escludere una necrosi ischemica miocardica in assenza di malattia
coronarica significativa: questa diagnostica ha implicazioni cliniche e terapeutiche34,66.
3.4.2 Trattamento
Il ricovero ospedaliero è raccomandato per la diagnosi e il monitoraggio nei pazienti con coinvolgimento miocardico e per la
diagnosi differenziale, specialmente nel caso di sindromi coronariche acute. Nel contesto di una miopericardite, il trattamento è simile a quello raccomandato per la pericardite. Solitamente viene prescritta una terapia antinfiammatoria empirica (aspirina 1500-3000 mg/die) o FANS (ibuprofene 1200-2400
mg/die o indometacina 75-150 mg/die) per il controllo del dolore toracico, mentre i corticosteroidi sono prescritti come seconda scelta in caso di controindicazioni, intolleranza o mancata risposta all’aspirina/FANS66. Nell’ambito della miopericardite, alcuni autori raccomandano di ridurre la posologia rispetto alle dosi adottate per la pericardite isolata, in quanto modelli animali di miocardite hanno evidenziato che i FANS non sono efficaci e potrebbero esacerbare il processo infiammatorio
aumentando la mortalità69,70,72,73. Tuttavia, l’applicazione di
questi riscontri nell’uomo sembrerebbe discutibile66. Inoltre,
non ci sono dati sufficienti per raccomandare l’uso della colchicina, che è un trattamento aggiuntivo ben codificato per la
pericardite acuta e ricorrente58. Malgrado la mancanza di terapie specifiche per la maggior parte dei casi, sono importanti diverse raccomandazioni non specifiche. Per tutti i pazienti con
miopericardite sono raccomandati il riposo e la restrizione dell’attività fisica al di fuori delle normali attività sedentarie53,54,66.
Fra il personale militare sono stati riportati casi di morte cardiaca improvvisa dopo esercizio fisico strenuo, così come in
atleti di sesso maschile senza sintomi prodromici (calcio, nuoto)53,54,66. Pertanto, mentre nella pericardite isolata il ritorno all’attività fisica è consentito quando non vi sia più evidenza di
malattia attiva nei non atleti o dopo 3 mesi per gli atleti, in accordo con il parere degli esperti e di precedenti raccomandazioni per la partecipazione ad attività agonistiche tale restrizione si applica per almeno 6 mesi dall’insorgenza della malattia
in caso di sospetto coinvolgimento miocarditico53,54,66.
712
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
3.4.3 Prognosi
Il coinvolgimento miocardico nella pericardite ha una buona
prognosi e diverse casistiche osservazionali hanno dimostrato
che non si associa a mortalità o evoluzione verso lo scompenso cardiaco34,66-68,70,71.
Raccomandazioni per la diagnosi e il trattamento della pericardite associata a miocardite
Raccomandazioni
Classea Livellob
In caso di pericardite con sospetta associata
miocardite, è raccomandata la
coronarografia (in base alla presentazione
clinica e alla valutazione dei fattori di
rischio) al fine di escludere la presenza
di sindrome coronarica acuta.
I
C
La risonanza magnetica cardiaca è
raccomandata per la conferma del
coinvolgimento miocardico.
I
C
Il ricovero ospedaliero è raccomandato per
la diagnosi ed il monitoraggio dei pazienti
con coinvolgimento miocardico.
I
C
Nei non atleti e negli atleti con
miopericardite sono raccomandati il
riposo e la restrizione dell’attività fisica
al di fuori delle normali attività
sedentarie per 6 mesi.
I
C
IIa
C
Le terapie antinfiammatorie empiriche
(alle dosi più basse) devono essere prese
in considerazione per il controllo
del dolore toracico.
aclasse
blivello
Ref.c
della raccomandazione.
di evidenza.
bibliografica a supporto delle raccomandazioni.
creferenza
3.5 Versamento pericardico
Il sacco pericardico normale contiene 10-50 ml di liquido pericardico come ultrafiltrato del plasma che agisce come lubrificante tra i foglietti pericardici. Qualsiasi processo patologico
provoca generalmente infiammazione con possibile aumentata produzione di liquido pericardico (essudato). Un meccanismo alternativo per l’accumulo del liquido pericardico può derivare dal ridotto assorbimento dovuto ad un aumento generalizzato della pressione venosa sistemica secondario a scompenso cardiaco congestizio o ipertensione polmonare (trasudato)48. Il versamento pericardico può essere classificato a seconda del tipo di esordio (acuto, subacuto vs cronico quando
persiste da oltre 3 mesi), della distribuzione (circonferenziale vs
saccato), dell’impatto emodinamico (nessuno, tamponamento
cardiaco, forma effusiva-costrittiva), della composizione (essudato, trasudato, sangue, raramente aria o gas a partenza da
infezioni batteriche). In particolare, il versamento pericardico
viene definito in base alla dimensione (Tabella 8) stimata mediante valutazione ecocardiografica semiquantitativa in lieve
(<10 mm), moderato (10-20 mm) o grave (>20 mm) (Figura 2
online)48. La valutazione semiquantitativa si è dimostrata utile
nella stima del rischio di un’eziologia specifica o di complicanze durante il follow-up della pericardite9,48,51. Negli ultimi 20
anni, sono state pubblicate cinque maggiori casistiche di pazienti con versamento pericardico moderato-grave (Tabella 3
online)74-78.
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
Tabella 8. Classificazione del versamento pericardico.
Esordio
Acuto
Subacuto
Cronico (>3 mesi)
Dimensioni
Lieve <10 mm
Moderato 10-20 mm
Grave >20 mm
Distribuzione
Circonferenziale
Saccato
Composizione
Trasudato
Essudato
zione semiquantitativa delle sue dimensioni e dei suoi effetti
emodinamici. Sebbene l’ecocardiografia rimanga il primo strumento diagnostico nello studio delle malattie pericardiche in
ragione della sua ampia disponibilità, portabilità ed economicità, la TC e la RMC consentono un campo visivo e permettono di rilevare versamenti pericardici saccati, l’ispessimento pericardico, la presenza di masse, nonché eventuali patologie toraciche associate2,3,84.
Raccomandazioni per la diagnosi di versamento pericardico
Classea Livellob
Raccomandazioni
Una proporzione significativa di pazienti con versamento
pericardico sono asintomatici e il versamento pericardico rappresenta un riscontro occasionale ed inaspettato all’esame radiologico o all’ecocardiogramma eseguiti per un’altra ragione.
Secondo queste casistiche, molti casi rimangono idiopatici nei
paesi industrializzati (fino al 50%), mentre le altre cause comuni identificabili comprendono in special modo le neoplasie
(10-25%), le infezioni (15-30%), le cause iatrogene (15-20%)
e le collagenopatie (5-15%), mentre la tubercolosi è la causa
principale nei paesi in via di sviluppo (>60%), dove tale patologia è endemica52,79. Nel contesto della pericardite con versamento pericardico, la prevalenza di eziologie infettive o neoplastiche varia dal 15% al 50% a seconda delle casistiche6,9.
3.5.1 Presentazione clinica e diagnosi
La presentazione clinica del versamento pericardico varia a seconda della velocità di accumulo del liquido pericardico. Se il
versamento pericardico si accumula rapidamente, come avviene nelle ferite penetranti o nelle perforazioni iatrogene, l’evoluzione è drammatica e persino piccole quantità di sangue possono provocare un aumento della pressione intrapericardica entro pochi minuti fino al tamponamento cardiaco. Al contrario,
nel caso di un versamento pericardico a lento accumulo, la raccolta di un grande versamento richiede giorni o settimane prima che un significativo aumento della pressione pericardica
possa provocare segni e sintomi (Figura 3 online)48,80,81.
I segni classici includono la dispnea da sforzo che può progredire verso l’ortopnea, il dolore toracico e/o il senso di oppressione. Sintomi aggiuntivi occasionali dovuti alla compressione locale possono comprendere nausea (diaframma), disfagia (esofago), raucedine (nervo laringeo ricorrente) e il singhiozzo (nervo frenico). Sintomi aspecifici comprendono tosse,
astenia, anoressia e palpitazioni, che riflettono gli effetti compressivi del liquido pericardico sulle strutture anatomiche contigue o il flusso ridotto di sangue e la tachicardia sinusale secondaria82-84. La febbre è un segno aspecifico che può associarsi a pericardite sia nelle forme infettive che immuno-mediate (malattie infiammatorie sistemiche)45.
L’esame obiettivo può essere assolutamente normale in pazienti senza compromissione emodinamica. Quando si sviluppa
il tamponamento cardiaco, compaiono sintomi classici come la
distensione delle vene giugulari con elevata pressione venosa
centrale, la presenza di polso paradosso e l’attenuazione dei
toni cardiaci all’auscultazione nei casi di versamento pericardico moderato-grave82-84. Gli sfregamenti pericardici sono raramente auscultabili e possono essere riscontrati solitamente nei
pazienti con concomitante pericardite8.
La diagnosi di versamento pericardico viene generalmente
eseguita con l’ecocardiografia, che consente anche la valuta-
In tutti i pazienti con sospetto versamento
pericardico è raccomandata
l’ecocardiografia transtoracica.
I
C
Nei pazienti con sospetto versamento
pericardico o patologia pleuropolmonare
è raccomandata la radiografia del torace.
I
C
Nei pazienti con versamento pericardico è
raccomandata la valutazione dei marker
di infiammazione sistemica (PCR).
I
C
IIa
C
In caso si sospetti la presenza di versamenti
saccati, ispessimento pericardico, masse e
patologie toraciche, devono essere prese
in considerazione la TC e la RMC.
Ref.c
PCR, proteina C-reattiva; RMC, risonanza magnetica cardiaca; TC, tomografia computerizzata.
aclasse della raccomandazione.
blivello di evidenza.
creferenza bibliografica a supporto delle raccomandazioni.
3.5.2 Triage e gestione clinica
Quando viene diagnosticato un versamento pericardico, il primo
passo è valutare la sua dimensione, gli effetti emodinamici (specie se produce tamponamento cardiaco) e l’eventuale presenza
di malattie associate (sia cardiovascolari che sistemiche). Il versamento pericardico è spesso associato ad una patologia nota o
ignota (es. ipotiroidismo) (fino al 60% dei casi)48,75,82. Se sono
presenti segni di infiammazione, la gestione clinica rispecchia
quella della pericardite. Il tamponamento cardiaco senza segni infiammatori è associato ad un più alto rischio di eziologia neoplastica (rapporto di probabilità di 2.9), mentre un versamento
grave senza tamponamento cardiaco o segni infiammatori è solitamente associato ad un’eziologia idiopatica cronica (rapporto
di probabilità di 20)75. Un approccio pratico clinico per il triage
del versamento pericardico è illustrato in Figura 348,82.
Raccomandazioni per la gestione iniziale del versamento pericardico
Classea Livellob
Raccomandazioni
Il ricovero è raccomandato per i pazienti
ad alto rischio con versamento pericardicod.
I
C
È raccomandato il triage dei pazienti
con versamento pericardico
come illustrato nella Figura 3.
I
C
Ref.c
a
classe della raccomandazione.
di evidenza.
creferenza bibliografica a supporto delle raccomandazioni.
dcriteri di rischio simili a quelli della pericardite (si veda Figura 1).
blivello
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
713
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
Figura 3. Algoritmo semplificato per il triage e la gestione del versamento pericardico.
Per i versamenti cronici senza eziologia definita non sono
disponibili dati sull’impiego dei FANS, colchicina e corticosteroidi. In presenza di un’elevazione dei marker di infiammazione potrebbe essere utile un tentativo di terapia antinfiammatoria con FANS e/o colchicina e/o corticosteroidi a basse dosi.
3.5.3 Terapia
La terapia del versamento pericardico dovrebbe essere mirata
quanto più possibile all’eziologia. In circa il 60% dei casi, il versamento è associato ad una malattia nota ed il trattamento è
essenzialmente quello della malattia sottostante48,75,82. Quando
il versamento pericardico è associato a pericardite, la gestione
clinica è quella della pericardite. Quando un versamento pericardico diventa sintomatico senza evidenza di infiammazione o
quando i farmaci antinfiammatori non risultano efficaci, deve
essere preso in considerazione il drenaggio pericardico. La pericardiocentesi con drenaggio pericardico prolungato fino a
quando si reduce a meno di 30 ml/die può essere presa in considerazione per favorire l’aderenza dei foglietti pericardici e prevenire l’ulteriore accumulo di liquido, anche se le evidenze a
supporto di questa indicazione derivano unicamente da casi clinici, studi retrospettivi e dall’opinione degli esperti48,82,84.
Sfortunatamente, non ci sono terapie farmacologiche efficaci in grado di ridurre un versamento pericardico isolato. In
assenza di infiammazione, generalmente i FANS, la colchicina
ed i corticosteroidi non sono efficaci82,85. La pericardicentesi da
sola può essere sufficiente a risolvere un versamento grave, ma
essendo frequenti anche le recidive, e ogni qual volta il versamento pericardico si riaccumula, diventa saccato o venga richiesto materiale bioptico devono essere prese in considerazione la pericardiectomia od opzioni meno invasive (finestra pericardica)48.
714
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
Raccomandazioni per la terapia del versamento pericardico
Raccomandazioni
Classea Livellob
Si raccomanda di indirizzare la terapia
del versamento pericardico all’eziologia.
I
C
Aspirina/FANS/colchicina e il trattamento
della pericardite sono raccomandati
quando il versamento pericardico è
associato a infiammazione sistemica.
I
C
La pericardiocentesi o la chirurgia cardiaca
sono indicate per il tamponamento
cardiaco o per versamenti pericardici
sintomatici moderato-gravi non responsivi
alla terapia medica o quando si sospetti
un’eziologia batterica o neoplastica.
I
C
Ref.c
FANS, farmaci antinfiammatori non steroidei.
della raccomandazione.
livello di evidenza.
creferenza bibliografica a supporto delle raccomandazioni.
aclasse
b
3.5.4 Prognosi e follow-up
La prognosi del versamento pericardico è essenzialmente correlata all’eziologia48,82,86. La dimensione del versamento è correlata alla prognosi in quanto versamenti pericardici moderati o
gravi sono più frequenti in caso di eziologie specifiche come
quelle batteriche o neoplastiche9,48. Un versamento pericardico
o una pericardite idiopatici hanno nel complesso una buona prognosi con un rischio molto basso di complicanze, in particolare
se il versamento è lieve-moderato. Contrariamente a ciò, un recente studio prospettico ha evidenziato come in soggetti con
versamento pericardico anche di lieve entità possano avere una
prognosi peggiore rispetto a controlli di pari età e sesso87.
I versamenti pericardici idiopatici gravi e cronici (>3 mesi)
hanno un rischio stimato del 30-35% di progredire in tampo-
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
namento cardiaco88. Anche gli stessi versamenti pericardici subacuti (4-6 settimane) gravi non responsivi alla terapia convenzionale e con segni di compressione sulle camere destre all’ecocardiografia potrebbero avere un rischio aumentato di progressione secondo alcuni autori, che pertanto ne raccomandano il drenaggio preventivo89. Una pericardite idiopatica ha un
rischio molto basso di evoluzione costrittiva anche malgrado diverse recidive: in questo caso il rischio è correlato all’eziologia e
non al numero delle recidive36. Il follow-up dei versamenti pericardici è basato principalmente sui sintomi e sulle dimensioni
ecocardiografiche, così come su alcune caratteristiche aggiuntive come le alterazioni dei marcatori di infiammazione (PCR)48.
Di solito, un versamento pericardico idiopatico lieve (<10
mm) è asintomatico e, in linea generale, ha una buona prognosi, non richiedendo quindi un monitoraggio specifico48. Versamenti moderati o gravi (>10 mm) possono progredire e, specialmente quelli gravi, possono evolvere in tamponamento cardiaco in circa un terzo dei casi. Un timing appropriato per il follow-up ecocardiografico potrebbe prevedere un controllo ogni
6 mesi per i versamenti idiopatici moderati e un controllo ogni
3-6 mesi per i versamenti gravi. È inoltre indicato un follow-up
individualizzato che tenga conto della stabilità o dell’evoluzione nelle dimensioni48. Specifiche considerazioni sui versamenti pericardici postoperatori sono discusse nella sezione dedicata alle sindromi da danno cardiaco.
3.6 Tamponamento cardiaco
Il tamponamento cardiaco è caratterizzato da una lenta o rapida compressione del cuore che può mettere in pericolo la vita
del paziente, dovuta all’accumulo di liquido, pus, sangue, coaguli o gas, o secondaria ad infiammazione, trauma, rottura di
cuore o dissezione aortica81,84. I segni clinici del tamponamento cardiaco comprendono tachicardia, ipotensione, polso paradosso, aumentata pressione venosa giugulare, toni attenuati, ridotti voltaggi dei complessi QRS all’ECG, cardiomegalia all’Rx torace per i versamenti a lento accumulo81-84. Un segno
patognomonico è rappresentato dal polso paradosso (definito
come una riduzione inspiratoria della pressione arteriosa sistolica di oltre 10 mmHg durante normale respiro). Il polso paradosso è dovuto alla presenza di un aumentata interdipendenza ventricolare che si verifica durante il tamponamento cardiaco, quando il volume delle camere cardiache diviene fisso ed i
cambiamenti di dimensione di un ventricolo provocano la variazione opposta dell’altro ventricolo (aumento inspiratorio del
ritorno venoso e delle camere cardiache destre con riduzione di
quelle sinistre e riduzione della pressione arteriosa sistemica).
L’entità delle alterazioni cliniche ed emodinamiche dipende dalla velocità di accumulo e dalle dimensioni del versamento pericardico, dalla distensibilità del pericardio e dalle pressioni di
riempimento e dalla compliance delle camere cardiache (Figura 3 online). Le diverse cause di tamponamento cardiaco sono
elencate nella Tabella 9.
La relativa rigidità del pericardio determina l’entità dell’incremento del liquido pericardico che innesca il tamponamento cardiaco, come si denota dalla caratteristica curva di pressione/volume pericardica: la curva ha un’ascesa iniziale lenta, seguita da
un innalzamento quasi verticale (Figura 3 online), che rende conto della caratteristica del tamponamento cardiaco di essere un
“fenomeno dell’ultima goccia”, dove l’incremento finale produce la compressione cardiaca critica e il primo decremento determina il maggior beneficio decompressivo relativo80-84.
Tabella 9. Cause di tamponamento cardiaco.
Cause comuni
• Pericardite
• Tubercolosi
• Iatrogene (correlate a procedure invasive, post-cardiochirurgia)
• Trauma
• Neoplasie
Cause non comuni
• Collagenopatie (lupus eritematoso sistemico, artrite reumatoide,
sclerodermia)
• Danno indotto da radiazioni
• Complicanza dell’infarto miocardico
• Uremia
• Dissezione aortica
• Infezione batterica
• Pneumopericardio
In pazienti con sospetto clinico di tamponamento cardiaco,
sono necessari diversi strumenti diagnostici. L’ECG può mostrare segni di pericardite con voltaggi del QRS particolarmente bassi e alternanza elettrica. Entrambi questi segni ECG sono
generalmente considerati come espressione dell’effetto di attenuazione sul segnale elettrico da parte del liquido pericardico e dai movimenti ondeggianti del cuore nel liquido pericardico. L’esame ecocardiografico è il test di diagnostica per immagini più utile per identificare la presenza di versamento pericardico e valutarne le dimensioni, la localizzazione e l’impatto emodinamico. L’ecocardiografia può essere inoltre utilizzata
per guidare l’esecuzione della pericardiocentesi con eccellente
sicurezza ed efficacia. I segni di tamponamento cardiaco possono essere identificati con l’ecocardiografia: cuore ondeggiante, collasso diastolico precoce del ventricolo destro, collasso diastolico tardivo dell’atrio destro, movimento settale anomalo, aumentata variabilità respiratoria (>25%) del flusso transmitralico, riduzione inspiratoria ed incremento espiratorio del
flusso diastolico anterogrado venoso polmonare, variazione respiratoria dei volumi delle camere cardiache e del flusso transaortico (polso paradosso ecocardiografico) e congestione della
vena cava inferiore2,3,82,84. La TC e la RMC sono disponibili meno prontamente e non sono generalmente necessari a meno
che l’ecocardiografia Doppler non sia disponibile. Il cateterismo
cardiaco è raramente utilizzato per la diagnosi di tamponamento cardiaco. Quando viene utilizzato, dimostra equalizzazione delle pressioni diastoliche e le caratteristiche variazioni
reciproche delle pressioni intracardiache: un incremento inspiratorio delle pressioni ventricolari destre e contemporanea riduzione di quelle ventricolari sinistre (polso paradosso). Ad eccezione del tamponamento cardiaco a bassa pressione, le pressioni diastoliche sono solitamente comprese tra 15 e 30 mmHg.
Il trattamento del tamponamento cardiaco comporta il drenaggio del liquido pericardico preferibilmente transcutaneo con
guida ecocardiografica o fluoroscopica, che dovrebbe essere
eseguito senza ritardo nei pazienti instabili. In alternativa, il drenaggio viene eseguito chirurgicamente, specie in situazioni come la pericardite purulenta o situazioni urgenti come nel caso
di sanguinamento intrapericardico. Un sistema per il triage del
paziente con tamponamento cardiaco è stato proposto dal
Working Group on Myocardial and Pericardial Diseases dell’ESC
(Figura 4 online) per guidare la decisione sui tempi in cui eseguire la pericardiocentesi e l’eventuale possibilità di una procedura differita per il trasferimento del paziente ad un centro di
riferimento84. Tale sistema di triage è basato essenzialmente sul
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
715
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
parere degli esperti e richiede un’ulteriore validazione per poter essere raccomandato nella pratica clinica.
Raccomandazioni per la diagnosi e il trattamento del tamponamento cardiaco
Raccomandazioni
Classea Livellob
Nei pazienti con sospetto tamponamento
cardiaco è raccomandata l’ecocardiografia
come prima tecnica di diagnostica per
immagini per valutare dimensioni,
localizzazione ed impatto emodinamico
del versamento pericardico.
I
C
Per il trattamento del tamponamento
cardiaco è raccomandata la
pericardiocentesi urgente o
la cardiochirurgia.
I
C
Per guidare il timing della pericardiocentesi,
si raccomanda una valutazione clinica
giudiziosa che tenga conto dei rilievi
ecocardiografici.
I
C
Per definire quando eseguire la
pericardiocentesi, può essere preso
in considerazione un sistema
di triage (Figura 4 online).
IIb
C
In presenza di tamponamento cardiaco,
i vasodilatatori e i diuretici non
sono raccomandati.
III
C
aclasse
blivello
Ref.c
della raccomandazione.
di evidenza.
bibliografica a supporto delle raccomandazioni.
creferenza
vata in assenza di una precedente o concomitante malattia
miocardica o malattia pericardica avanzata. I pazienti possono
riferire astenia, edema periferico, dispnea ed ascite. L’intervallo tra l’iniziale infiammazione pericardica e l’esordio dei segni/sintomi di costrizione è variabile e probabilmente costituisce la diretta evoluzione di una pericardite subacuta o cronica
in pericardite costrittiva36. Possono verificarsi congestione venosa, epatomegalia, versamento pleurico e ascite. L’alterazione
emodinamica può essere ulteriormente aggravata dalla presenza di disfunzione sistolica dovuta a fibrosi miocardica o atrofia nei casi più avanzati.
Sebbene i casi classici ed avanzati si manifestano con ispessimento pericardico e calcificazioni nelle forme croniche, la costrizione pericardica può presentarsi anche con normale spessore pericardico in circa il 20% dei casi94. La pericardiectomia
è ugualmente efficace con pericardio ispessito o non ispessito.
3.7.2 Diagnosi
La diagnosi di pericardite costrittiva si basa sull’associazione di
segni e sintomi di scompenso cardiaco destro ed alterato riempimento diastolico dovuto a costrizione pericardica evidenziabile con almeno una o più modalità di diagnostica per immagini, compresa l’ecocardiografia95, la TC, la RMC e il cateterismo cardiaco2,3,96. La principale diagnosi differenziale si pone
con la cardiomiopatia restrittiva (Tabella 10).
Raccomandazioni per la diagnosi di pericardite costrittiva
Raccomandazioni
3.7 Pericardite costrittiva
La pericardite costrittiva può verificarsi teoricamente dopo ogni
tipo di malattia pericardica, ma solo raramente dopo la pericardite ricorrente37. Il rischio di progressione è correlato in particolar modo all’eziologia: basso (<1%) nella pericardite idiopatica e virale, intermedio (2-5%) nelle pericarditi immuno-mediate e nelle patologie pericardiche associate a neoplasie, e alto (20-30%) nella pericardite batterica, specie la pericardite purulenta36. Sono disponibili alcune casistiche storiche di pazienti con pericardite costrittiva provenienti da centri di riferimento di terzo livello (Stanford, Mayo Clinic, Cleveland Clinic, e
Groote Schuur Hospital) che sono stati sottoposti a pericardiectomia (Tabella 4 online)90-93. La causa più comune riportata nei paesi industrializzati è virale o idiopatica (42-49%), postchirurgica (11-37%), post-irradiazione (9-31%) (principalmente per malattia di Hodgkin o carcinoma mammario), da collagenopatia (3-7%), post-infettiva (pericardite tubercolare o purulenta nel 3-6% dei casi) e cause varie (neoplasie, trauma, forme indotte da farmaci, asbestosi, sarcoidosi, pericardite uremica in meno del 10% dei casi). La tubercolosi è oggi una causa
rara di pericardite costrittiva nei paesi industrializzati, mentre
rappresenta la causa principale nei paesi in via di sviluppo93.
Tuttavia, queste forme potrebbero aumentare nei pazienti con
infezione da HIV e per effetto dei fenomeni di immigrazione.
3.7.1 Presentazione clinica
La pericardite costrittiva è caratterizzata da un riempimento diastolico ventricolare alterato a causa della malattia pericardica.
Il quadro clinico classico è caratterizzato da segni e sintomi di
scompenso cardiaco destro con funzione biventricolare preser-
716
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
Classea Livellob
In tutti i pazienti con sospetta pericardite
costrittiva è raccomandata
l’ecocardiografia transtoracica.
I
C
In tutti i pazienti con sospetta pericardite
costrittiva è raccomandata la radiografia
del torace (postero-anteriore e laterale)
con opportune caratteristiche tecniche.
I
C
La TC e/o la RMC sono indicate come
metodiche diagnostiche di secondo livello
per la valutazione delle calcificazioni (TC),
dello spessore pericardico e del grado ed
estensione del coinvolgimento pericardico.
I
C
Il cateterismo cardiaco è indicato quando le
tecniche diagnostiche non invasive non
sono in grado di fornire la diagnosi
di certezza.
I
C
Ref.c
aclasse
della raccomandazione.
di evidenza.
creferenza bibliografica a supporto delle raccomandazioni.
blivello
3.7.3 Terapia
Sebbene il trattamento fondamentale della pericardite costrittiva cronica sia la chirurgia, la terapia medica può avere un ruolo in almeno tre condizioni. Prima di tutto, la terapia medica
per il trattamento di eziologie specifiche (pericardite tubercolare) può contribuire a prevenire l’evoluzione costrittiva. La terapia antitubercolare può ridurre in maniera significativa il rischio di costrizione da >80% a <10%79,97.
In secondo luogo, la terapia medica (generalmente basata
sui farmaci antinfiammatori) può risolvere i casi di costrizione
transitoria che si verificano nel 10-20% dei casi entro pochi mesi, solitamente come un fenomeno transitorio durante la riso-
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
Tabella 10. Pericardite costrittiva vs cardiomiopatia restrittiva: una breve revisione delle caratteristiche cliniche per la diagnosi differenziale (modificata da 25).
Valutazione diagnostica
Pericardite costrittiva
Cardiomiopatia restrittiva
Esame obiettivo
Segno di Kussmaul, pericardial knock (tono aggiunto
pericardico)
Insufficienza valvolare, probabile segno di Kussmaul, terzo
tono (forme avanzate)
ECG
Bassi voltaggi, alterazioni non specifiche della
ripolarizzazione, fibrillazione atriale
Bassi voltaggi, aspetto pseudoinfartuale, possibile allargamento
del QRS, deviazione assiale sinistra, fibrillazione atriale
Radiografia del torace
Calcificazioni pericardiche (un terzo dei casi)
Ecocardiografia
•
•
•
•
•
Assenza di calcificazioni pericardiche
Movimento anomalo del setto
Ispessimento pericardico e calcificazioni
Variazione respiratoria del flusso transmitralico
>25% e variazione del picco diastolico
del flusso venoso polmonare >20%
Velocità di propagazione al color-M-mode
(Vp) >45 cm/s
Doppler tessutale: picco e’ >8.0 cm/s
•
•
•
•
•
Ventricolo sinistro piccolo con atrio dilatato e possibile
aumento degli spessori parietali
Rapporto E/A >2, tempo di decelerazione corto,
Assenza di significative variazioni respiratorie dei flussi mitralici
Velocità di propagazione al color-M-mode (Vp) <45 cm/s
Doppler tessuale: picco e’ <8.0 cm/s
Cateterismo cardiaco
“Segno della “radice quadrata”, analoga pressione
diastolica ventricolari sinistra e destra, interdipendenza
ventricolare (valutata mediante l’indice di area sistolica
>1.1)a
Marcato aumento della pressione sistolica ventricolare destra
(>50 mmHg) e pressione ventricolare diastolica sinistra
aumentata e maggiore di quella destra (LVEDP > RVEDP)
a riposo o durante esercizio di almeno 5 mmHg o più
(RVEDP <1/3 RVSP)
TC/RMC
Spessore pericardico >3-4 mm, calcificazioni
pericardiche (TC), interdipendenza ventricolare
(cine-RMC in tempo reale)
Normale spessore pericardico (<3.0 mm), coinvolgimento
miocardico in base alla morfologia e allo studio funzionale
(RMC)
ECG, elettrocardiogramma; LVEDP, pressione telediastolica ventricolare sinistra; RMC, risonanza magnetica cardiaca; RVEDP, pressione telediastolica ventricolare destra; segno di Kussmaul, aumento paradosso della pressione venosa giugulare in inspirazione; TC, tomografia computerizzata.
dell’area sistolica è definito come il rapporto tra l’area del ventricolo destro (mmHg x s) e quella del ventricolo sinistro (mmHg x s) in inspirazione
vs espirazione96.
Specifici criteri diagnostici ecocardiografici per la diagnosi di pericardite costrittiva sono stati proposti recentemente dalla Mayo Clinic e comprendono: movimento anomalo del setto interventricolare con e’ mediale >8 cm/s o rapporto di reflusso diastolico espiratorio delle vene sovraepatiche >0.78 (sensibilità
87%, specificità 91%; la specificità può aumentare al 97% se sono presenti tutti i criteri con una contemporanea riduzione della sensibilità al 64%95.
al’indice
luzione della pericardite51,98,99. Il riscontro di un’elevazione della PCR e l’evidenza di infiammazione pericardica mediante enhancement contrastografico con TC e/o RMC può essere utile
per identificare i pazienti con forme di costrizione potenzialmente reversibili, laddove la terapia antinfiammatoria empirica
potrebbe essere considerata per ovviare alla necessità della pericardiectomia100.
In terzo luogo, la terapia medica è di supporto per il controllo dei sintomi di congestione nei casi avanzati e quando la
cardiochirurgia è controindicata o ad alto rischio. In queste circostanze, la terapia medica non deve causare un ritardo della
cardiochirurgia, quando fattibile, poiché i casi avanzati hanno
una mortalità più elevata e una prognosi peggiore quando la
chirurgia è ritardata51.
3.7.4 Forme specifiche
La descrizione classica di pericardite cronica costrittiva permanente è stata recentemente messa in discussione da specifiche
sindromi costrittive (pericardite costrittiva transitoria, forme effusivo-costrittive). Le definizioni, le principali diagnosi differenziali ed i trattamenti delle principali sindromi costrittive pericardiche sono riassunti nella Tabella 1151.
3.7.4.1 Pericardite costrittiva transitoria
Dopo una pericardite con versamento lieve si sviluppa generalmente una forma reversibile di costrizione, che si risolve con la terapia antinfiammatoria entro alcune settimane98,99. Il tipico decorso clinico implica la presenza di una pericardite infiammatoria acuta con costrizione dovuta all’infiammazione, che si risolve
con il trattamento del processo infiammatorio98,99. Pertanto, in
assenza di una chiara evidenza di cronicità (cachessia, fibrillazio-
ne atriale, disfunzione epatica o calcificazioni pericardiche), i pazienti emodinamicamente stabili con una nuova diagnosi di pericardite costrittiva possono ricevere un trattamento medico per
2-3 mesi prima di essere sottoposti a pericardiectomia. Poiché il
pericardio infiammato si evidenzia con il contrasto alla TC o
RMC, queste metodiche diagnostiche possono essere utili per
identificare la presenza di infiammazione pericardica2,3,100.
3.7.4.2 Pericardite effusivo-costrittiva
La cavità pericardica è tipicamente obliterata nei pazienti con
pericardite costrittiva, pertanto normalmente il liquido pericardico è assente. Tuttavia, in alcuni casi può essere presente versamento pericardico e, in queste circostanze, il pericardio fibrotico può non solo esercitare un effetto costrittivo ma anche
aumentare la pressione del liquido pericardico, portando al
tamponamento cardiaco. Questa combinazione fisiopatologica è chiamata pericardite effusivo-costrittiva101.
La pericardite effusivo-costrittiva sembra relativamente rara nei paesi industrializzati, con solo pochi dati pubblicati101. La
maggior parte dei casi di pericardite effusivo-costrittiva sono
idiopatici nei paesi sviluppati, riflettendo la frequenza generale delle forme idiopatiche di patologia pericardica. La tubercolosi è la causa più comune nei paesi in via di sviluppo102; altre
cause riportate comprendono l’irradiazione, le neoplasie, la
chemioterapia e le infezioni (in particolare la tubercolosi e le
forme purulente) e le forme post-chirurgiche102.
Generalmente, i pazienti con pericardite effusivo-costrittiva
hanno caratteristiche cliniche proprie del versamento e della costrizione o di entrambe. La diagnosi di pericardite effusivo-costrittiva spesso diviene manifesta durante la pericardiocentesi in
pazienti a cui viene inizialmente diagnosticato tamponamento
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
717
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
Tabella 11. Definizioni e terapia delle principali sindromi costrittive pericardiche (adattata da Imazio et al.51).
Sindrome
Definizione
Terapia
Costrizione transitoria (d.d. costrizione
permanente, CMP restrittiva)
Quadro di costrizione reversibile dopo risoluzione
della pericardite o dopo terapia medica.
Terapia antinfiammatoria empirica per 2-3 mesi.
Pericardite effusivo-costrittiva
(d.d. tamponamento cardiaco, pericardite
costrittiva)
Mancata riduzione della pressione atriale destra
Pericardiocentesi seguita da terapia medica.
del 50% o di meno di 10 mmHg dopo pericardiocentesi. Chirurgia per casi persistenti.
Può essere diagnosticata anche con metodiche di
imaging non invasivo.
Costrizione cronica (d.d. costrizione
transitoria, CMP restrittiva)
Costrizione persistente dopo 3-6 mesi.
Pericardiectomia, terapia medica per le forme
avanzate o ad alto rischio operatorio o forme
miste con coinvolgimento miocardico.
CMP, cardiomiopatia; d.d., diagnosi differenziale.
cardiaco non complicato101. Per queste ragioni, quando possibile, si raccomanda di monitorare le pressioni intrapericardiche,
le pressioni destre e la pressione arteriosa sistemica durante pericardiocentesi elettiva. Una pressione atriale destra elevata dopo una pericardiocentesi efficace può essere anche dovuta a
scompenso cardiaco destro o ad insufficienza tricuspidale.
Tuttavia, anche le metodiche di imaging possono essere utili nel porre diagnosi di pericardite effusivo-costrittiva102. Il foglietto epicardico, che è responsabile della componente costrittiva del processo, non è tipicamente ispessito in modo tale
da essere evidenziato alle metodiche diagnostiche per immagini. Ciononostante, reperti eco-Doppler di costrizione possono
essere rilevati dopo pericardiocentesi per tamponamento cardiaco e, in questi casi, le forme effusivo-costrittive possono essere sospettate senza monitoraggio emodinamico. Dati utili
possono essere ricavati anche dalla RMC. L’utilità di questa metodica nella pericardite costrittiva è ben nota, consentendo non
solo la valutazione dello spessore pericardico, della morfologia
e funzione cardiaca ma anche lo studio delle strutture intratoraciche, permettendo di differenziare la pericardite costrittiva
dalla cardiomiopatia restrittiva. La valutazione dell’accoppiamento ventricolare con la cine-RM in tempo reale durante il respiro libero consente l’analisi dell’interdipendenza ventricolare
e del movimento anomalo del setto interventricolare2,3.
Poiché è il foglietto viscerale e non quello parietale che esercita l’effetto costrittivo, deve necessariamente essere eseguita
la pericardiectomia viscerale. Tuttavia, tale intervento è spesso
difficile, in quanto richiede la dissezione di molti piccoli frammenti del pericardio fino a quando non viene osservato un miglioramento della cinesi ventricolare. Pertanto, la pericardiectomia delle forme effusivo-costrittive deve essere eseguita solo in
centri con esperienza specifica in questo tipo di chirurgia101.
3.7.4.3 Pericardite costrittiva cronica
La pericardiectomia è lo standard accettato di trattamento per
i pazienti con pericardite costrittiva cronica che hanno sintomi
persistenti (classe NYHA III o IV). Tuttavia, l’intervento chirurgico deve essere considerato con cautela sia nei pazienti con
malattia lieve o molto avanzata che in quelli con costrizione
post-attinica, disfunzione miocardica o significativa disfunzione renale. La rimozione chirurgica del pericardio comporta una
significativa mortalità operatoria che varia dal 6% al 12%103-105.
La pericardiectomia deve essere quanto più completa possibile e deve essere eseguita da chirurghi esperti. Pertanto, qualora
vi sia una limitata esperienza con questo tipo di chirurgia, può
essere opportuno il trasferimento del paziente in un centro
esperto.
718
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
I pazienti con malattia costrittiva in stadio terminale traggono solo un beneficio minimo o nullo dalla pericardiectomia
e il rischio operatorio è in accettabilmente alto. Le manifestazioni di malattia in stadio terminale comprendono cachessia,
fibrillazione atriale, sindrome da bassa portata (indice cardiaco
<1.2 l/m2/min) a riposo, ipoalbuminemia dovuta ad enteropatia protido-disperdente e/o disfunzione epatica dovuta a congestione cronica o cirrosi cardiogenica.
Una precedente terapia radiante è associata ad una prognosi a lungo termine sfavorevole, in quanto induce una cardiomiopatia oltre alla patologia pericardica. I predittori di una
prognosi negativa con sopravvivenza limitata comprendono
precedente terapia radiante, disfunzione renale, pressione sistolica polmonare elevata, disfunzione ventricolare sinistra, iponatremia ed età avanzata. Le calcificazioni pericardiche non
hanno alcun impatto sulla sopravvivenza103-105. La sopravvivenza dopo pericardiectomia radicale in pazienti con score
Child-Pugh (CP) B o C (CP score ≥7) hanno una prognosi peggiore rispetto a quelli con CP-A. Ad una un’analisi multivariata, un CP score ≥7, l’irradiazione mediastinica, l’età avanzata e
la malattia renale in stadio terminale identificavano un aumentato rischio di morte dopo pericardiectomia radicale106. Pertanto, nei pazienti con pericardite costrittiva, sembra pertanto
opportuno applicare il CP score per la predizione della mortalità dopo pericardiectomia radicale.
Raccomandazioni per la terapia della pericardite costrittiva
Raccomandazioni
Classea Livellob
Il cardine del trattamento della costrizione
permanente cronica è la pericardiectomia.
I
C
La terapia medica di forme specifiche di
pericardite (pericardite tubercolare) è
raccomandata per la prevenzione
dell’evoluzione costrittiva.
I
C
IIb
C
La terapia antinfiammatoria può essere
presa in considerazione nei casi transitori
o di nuova diagnosi con concomitante
evidenza di infiammazione pericardica
(elevazione della PCR o enhancement
pericardico alla TC/RMC).
Ref.c
PCR, proteina C-reattiva; RMC, risonanza magnetica cardiaca; TC, tomografia computerizzata.
a
classe della raccomandazione.
blivello di evidenza.
c
referenza bibliografica a supporto delle raccomandazioni.
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
4. IMAGING CARDIOVASCOLARE MULTIMODALE
E PROCEDIMENTO DIAGNOSTICO
4.1 Imaging multimodale
4.1.1 Radiografia del torace
Sebbene la radiografia del torace possa evidenziare le calcificazioni pericardiche come densità curvilinee ai margini della silhouette cardiaca, soprattutto nella proiezione laterale107, altre
tecniche (ecocardiografia, TC) risultano sicuramente più accurate nella valutazione di cuore e polmoni, fornendo informazioni riguardo alle dimensioni cardiache e alla presenza di patologia polmonare (segni di stasi polmonare, polmoniti, lesioni
tubercolari, neoplasie), versamenti pleurici e ingrandimento ilare e mediastinico.
4.1.2 Ecocardiografia
L’ecocardiografia transtoracica è la metodica di imaging di prima scelta nei pazienti con sospetta malattia pericardica, in
quanto evidenzia in modo accurato il versamento pericardico e
il tamponamento, così come la disfunzione ventricolare dovuta ad un coinvolgimento miocardico2,3. Sebbene i pazienti che
presentino esclusivamente una pericardite acuta fibrinosa possano avere un ecocardiogramma normale, la presenza di versamento pericardico è frequente nelle pericarditi acute ed è uno
dei suoi criteri diagnostici maggiori2,5,6,10,11. Nell’ambito dei pazienti con dolore toracico, l’ecocardiografia può aiutare nel differenziare la pericardite acuta dall’ischemia miocardica, escludendo le discinesie dovute ad alterazioni del flusso coronarico.
Tuttavia, circa il 5% dei pazienti con pericardite acuta e coinvolgimento miocardico può mostrare anomalie della cinetica
parietale.
Clinicamente l’ecocardiografia Doppler bidimensionale rappresenta la modalità diagnostica con migliore rapporto costobeneficio nella diagnosi del versamento pericardico e nella valutazione del suo impatto emodinamico48. Le dimensioni del
versamento pericardico all’ecocardiografia bidimensionale vengono stimate con metodica qualitativa, misurando la distanza
telediastolica dello spazio libero ecografico tra l’epicardio e il
pericardio parietale: lieve (<10 mm), moderato (10-2 0mm),
grave (>20 mm) (Figura 2 online)48.
Per consentire studi di follow-up, si raccomanda che le immagini siano documentate digitalmente e che la dimensione
del versamento sia descritta in modo dettagliato nel referto
ecocardiografico, includendo non solo la misura, ma anche la
sede di ogni misurazione. Tuttavia, la tolleranza emodinamica
è più legata alla rapidità della comparsa del versamento che
non al volume totale48,80.
I versamenti pericardici saccati o i versamenti contenenti
coaguli (ad esempio dopo interventi di chirurgia cardiaca) possono essere difficili da diagnosticare con un approccio transtoracico e possono richiedere l’utilizzo di un approccio ecografico transesofageo3,4. Gli specifici reperti delle diverse sindromi
pericardiche sono discussi nei paragrafi pertinenti.
4.1.3 Tomografia computerizzata
La TC deve essere considerata una preziosa metodica di imaging complementare allo studio ecocardiografico3,4,41,108,109; è
inoltre la tecnica più accurata nella descrizione delle calcificazioni tissutali2,3. L’attuale utilizzo della TC multidetettore combina velocità di acquisizione, un elevato contrasto e un’elevata
risoluzione spaziale con la scansione volumetrica, fornendo un
eccellente dettaglio anatomico del cuore e del pericardio. La
regione anatomica studiata dalla TC può limitarsi al cuore e al
pericardio (TC cardiaca), sebbene in pazienti con malattia neoplastica, infiammatoria o aortica può estendersi all’intero torace ed eventualmente includere anche l’addome e le pelvi108.109.
È inoltre possibile eseguire una TC cardiaca a basso dosaggio di
radiazioni utilizzando il triggering prospettico elettrocardiografico108,109. Sebbene le conseguenze funzionali della malattia pericardica sul cuore possano essere valutate mediante TC – anche se a scapito di un’esposizione alle radiazioni significativamente superiore – l’ecocardiografia e la RMC rimangono le metodiche più appropriate per questo tipo di studio. È raccomandata la somministrazione endovenosa di mezzo di contrasto iodato per aumentare la densità del sangue ed evidenziare l’infiammazione pericardica. Il pericardio normale è visibile come
una sottile struttura curvilinea circondata dalle aree ipodense
del grasso mediastinico ed epicardico, e ha uno spessore compreso tra 0.7 e 2.0 mm. I seni pericardici e i rispettivi recessi sono generalmente visibili, in particolare quando contengono piccole quantità di liquido pericardico. I principali reperti TC di versamento pericardico e della pericardite sono riassunti nella Tabella 1241,108,109.
Nei i pazienti con malattia neoplastica, il coinvolgimento
pericardico può verificarsi per invasione tumorale diretta o diffusione metastatica. La TC è importante sia nella pianificazione del trattamento che nel follow-up del paziente. La diagnosi delle cisti pericardiche (formazioni congenite), rappresentate
come strutture ben definite di aspetto misto liquido-solido lungo il margine sinistro o destro del cuore, così come la diagnosi
differenziale con altre strutture cistiche, quali cisti broncogene
o da duplicazione, è di solito semplice. Infine, la TC può essere utile per stabilire la diagnosi di assenza congenita del pericardio, mostrando la dislocazione delle strutture cardiache attraverso il difetto del pericardio. La TC è anche essenziale per
la valutazione preoperatoria di alcuni pazienti con pericardite
costrittiva, soprattutto per definire l’estensione delle calcificazioni e per quelli con una storia di precedenti interventi di chirurgia cardiotoracica109.
4.1.4 Risonanza magnetica cardiaca
Nel corso degli anni, la RMC è passata da imaging di definizione morfologica a tecnica di valutazione globale, consentendo la visualizzazione e la caratterizzazione tissutale del pericardio (e del cuore in generale) nei pazienti con malattia pericardica e la valutazione delle conseguenze delle anomalie pericardiche sulla funzione cardiaca e sul pattern di riempimento110,111. Come tale, essa rappresenta probabilmente la tecnica di imaging di elezione per valutare in modo ottimale le malattie pericardiche112,113. L’anatomia cardiaca e pericardica vengono valutate mediante tecniche dark-blood T1-pesate spinecho e bright-blood cine steady-state free-precession (SSFP).
La cine SSFP imaging è diventata la sequenza di riferimento
per valutare e quantificare i volumi cardiaci, la massa miocardica e la funzione ventricolare. Quando acquisite in tempo reale, queste sequenze possono essere usate per definire l’interdipendenza ventricolare valutando i cambiamenti di forma del
setto ventricolare e il suo movimento durante il ciclo respiratorio109,110. La caratterizzazione tissutale del cuore e del pericardio si ottiene mediante sequenze dark-blood T1-pesate e
dark-blood T2-pesate, short-tau inversion recovery (STIR) imaging spin-echo, cine SSFP imaging e imaging T1-pesate con
contrasto e/o con contrasto tardivo (late contrast-enhanced,
LCE) in seguito alla somministrazione endovenosa di gadoliG ITAL CARDIOL | VOL 16 | DICEMBRE 2015
719
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
Tabella 12. Il contributo diagnostico delle diverse tecniche di imaging nelle malattie del pericardio.
Ecocardiografia
Tomografia computerizzata
Risonanza magnetica cardiaca
Pericardite acuta – reperti normali nella maggioranza dei
pazienti
– strati pericardici ispessiti ed iperecogeni
– quantità variabile di liquido pericardico
– ± strand fibrinici intrapericardici
– anomalie della cinetica parietale
nelle miopericarditi
– strati pericardici ispessiti, ispessimento
più evidente dopo somministrazione
di mdc
– anomalie che coinvolgono l’intero
pericardio
– quantità variabile di liquido pericardico
– ± strand fibrinici intrapericardici
–
–
–
–
–
Pericardite
ricorrente
– aspetti simili a quelli riscontrati nella
pericardite acuta
– aspetti simili a quelli riscontrati nella
pericardite acuta
– possibile distribuzione eterogenea
causata da adesioni fibrotiche
– delimitazione pericardica irregolare
(deformazione fibrotica)
– aspetti simili a quelli riscontrati nella
pericardite acuta
– possibile distribuzione eterogenea
causata da adesioni fibrotiche
– delimitazione pericardica irregolare
(deformazione fibrotica)
Pericardite
costrittiva
–
–
–
–
–
– strati pericardici ispessiti ± calcificazioni
pericardiche
– l’ispessimento può essere da lieve
a moderato
– anomalie generalmente più pronunciate
a carico della base dei ventricoli (VD>VS),
solchi atrioventricolari e atri
– possibile estensione dei processi
fibrocalcifici all’adiacente miocardio
– compressione del contenuto cardiaco
dal pericardio rigido e deformato
– alterata forma del setto interventricolare
– atri dilatati, congestione della vena
cava/vene sovraepatiche e del fegato
– reflusso del contrasto a livello della
cava/vene sovraepatiche
– ± liquido pleurico
– ± ascite
– presentazioni atipiche
* forme costrittive focali
* forme effusivo-costrittive
– strati pericardici ispessiti
– calcificazioni pericardiche
non visibili alla RMC!
– l’ispessimento può essere
da lieve a moderato
– anomalie generalmente più pronunciate
a carico della base dei ventricoli
(VD>VS), solchi atrioventricolari e atri
– il LGE pericardico riflette residua
infiammazione
– possibile estensione dei processi
fibrocalcifici all’adiacente miocardio
– compressione del contenuto
cardiaco causata dal pericardio
rigido e deformato
– atri dilatati, vena cava/vene
sovraepatiche
– ± liquido pleurico
– ± ascite
– aumento della dipendenza
interventricolare stimata mediante
cine-RMC in tempo reale e/o
phase-contrast imaging in tempo reale
– adesione fibrotica degli strati
pericardici contrassegnati alla RMC
– presentazioni atipiche
* forme costrittive focali
* forme effusivo-costrittive
– accumulo di liquidi nel sacco pericardico
e/o nei seni pericardici
– spessore pericardico >4 mm considerato
come una anomala quantità di liquido
– vantaggiosa per descrivere versamenti
focali e quantificare con precisione
la quantità di liquido
– valori di attenuazione del liquido
pericardico (HU) producono informazioni
riguardo la natura del liquido:
* versamento semplice: 0-20 HU
* proteinaceo/emorragico: >20 HU
* un HU molto elevato successivo alla
somministrazione di mdc iodato
è sospetto per perdita di contrasto
intrapericardico (ex rottura di
dissezione aortica)
* chilopericardio: valori negativi di HU
* pneumopericardio: aria (uso di
specifica finestra/settaggio)
– gli strati pericardici hanno normale
spessore
* se ispessiti e evidenziati da mdc
sospetta infiammazione
* se ispessiti e calcifici escludere
pericardite costrittiva
– accumulo di liquidi nel sacco pericardico
e/o nei seni pericardici
– spessore pericardico >4 mm considerato
come una anomala quantità di liquido
– vantaggiosa per descrivere versamenti
focali e quantificare con precisione la
quantità di liquido
– combinazione di sequenze con
differente “weighting” forniscono
informazioni riguardo alla natura
del versamento
– gli strati pericardici hanno normale
spessore
* se ispessiti e evidenziati da mdc
sospetta infiammazione
– vantaggiosa per valutare il resto del
cuore
* caratterizzazione del tessuto
miocardico (edema, infarto,
infiammazione fibrosi)
* funzione miocardica/valvolare
* pattern di afflusso
– può essere associato a tamponamento
pericardico
–
–
–
–
–
–
–
–
–
Versamento
pericardico
strati pericardici ispessiti e iperecogeni
± liquido pleurico
± ascite
atri dilatati
movimento inspiratorio del setto
interventricolare verso il ventricolo sinistro
(septal bounce) meglio documentato
in M-mode
marcata dilatazione e assente o ridotto
collasso della VCI e delle vene
sovraepatiche
prematura apertura della valvola
polmonare
pattern di riempimento diastolico del VD
e del VS tipo restrittivo
riduzione >25% della velocità del flusso
mitralico and aumento >40% della
velocità a livello tricuspidale al primo
battito dopo l’inspirazione
variazioni di segno opposto durante
espirazione
normale o aumentata propagazione
della velocità del flusso protodiastolico
mitralico al color-M-mode
ridotta velocità espiratoria a livello
delle vene sovraepatiche con
significativa inversione diastolica
normale o aumentata velocità anulare
mitralica al Doppler tissutale (>7 cm/s)
annulus reversus (e’ settale > e’ laterale)
– accumulo di liquidi nel sacco pericardico
e/o nei seni pericardici
– spazio pericardico ecogeno durante
l’intero ciclo cardiaco
– distribuzione del liquido
– valutazione semi-quantitativa della
gravità del versamento
strati pericardici ispessiti
intenso LGE pericardico dopo contrasto
quantità variabile di liquido pericardico
± strand fibrinici intrapericardici
LGE miocardico in caso di miopericarditi
(subepicardico e medio-parietale)
– l’appiattimento inspiratorio del setto
causato dalla ridotta compliance
pericardica, può evidenziarsi
in cine-RMC in tempo reale
(continua)
720
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
(segue) Tabella 12. Il contributo diagnostico delle diverse tecniche di imaging nelle malattie del pericardio.
Ecocardiografia
Tomografia computerizzata
Risonanza magnetica cardiaca
– può essere associato a tamponamento
pericardico
– TC del cuore può essere parte di un più
esteso esame che includa ila rimanente
porzione del torace ± addome
Tamponamento – valutazione semi-quantitativa della gravità
cardiaco
del versamento
– distribuzione del liquido
– valutazione del suo impatto emodinamico
– guida e monitoraggio della pericardiocentesi
– rivalutazione per definizione dei tempi
di rimozione del catetere di drenaggio
HU, unità Hounsfield; LGE, late gadolinium enhancement; mdc, mezzo di contrasto; RMC, risonanza magnetica cardiaca; TC, tomografia computerizzata;
VCI, vena cava inferiore; VD, ventricolo destro; VS, ventricolo sinistro.
nio paramagnetico3,4,114. La sequenza LGE utilizza un prepulse inversion recovery per aumentare il contrasto dell’immagine, ed è molto adatta per visualizzare l’infiammazione del pericardio114,115.
L’afflusso ventricolare e il pattern di flusso venoso possono
essere valutati utilizzando l’imaging a contrasto di fase111. Come nella TC, il pericardio normale appare nelle sequenze T1-pesate come una sottile struttura curvilinea ipo-intensa (“dark”)
circondata da strutture iper-intense (“bright”), quali il grasso
mediastinico ed epicardico. Lo spessore pericardico normale varia da 1.2 al 1.7 mm. Gli aspetti caratteristici del versamento pericardico e della pericardite alla RMC sono riportati nella Tabella 12. Va sottolineato che la RMC è in grado di distinguere con
precisione tra malattie con interessamento miopericardico come le forme infiammatorie miste (miopericarditi o perimiocarditi) e le lesioni pericardiche post-infartuali116,117. Nei pazienti
con pericardite costrittiva, la RMC è particolarmente importante per la diagnosi di presentazioni atipiche, come nei casi con
pericardio minimamente ispessito o con pericardite effusiva-costrittiva e nei casi con forme potenzialmente reversibili o transitorie di pericardite costrittiva, mostrando alle sequenze con
LGE l’aumentata captazione degli strati pericardici115,118,119. Rispetto alla TC, la RMC ha il vantaggio di fornire informazioni riguardo alle conseguenze emodinamiche sul riempimento cardiaco di un pericardio non elastico109-111 ed è in grado di mostrare la fusione fibrotica degli strati pericardici120.
Nei pazienti con patologia congenita del pericardio e neoplasie pericardiche, la RMC ha gli stessi vantaggi della TC, ma
consente una migliore caratterizzazione tissutale e la possibilità di valutare le conseguenze funzionali121. Inoltre, nuove tecniche di risonanza magnetica, come la diffusione pesata e
l’imaging dinamico con mezzo di contrasto, aprono nuove prospettive per una migliore caratterizzazione tissutale nei pazienti con tumori pericardici122.
4.1.5 Medicina nucleare
In casi selezionati, la tomografia ad emissione di positroni (PET)
da sola, o preferibilmente in combinazione con la TC (TC/PET)
può essere indicata per descrivere l’attività metabolica nelle malattie del pericardio. La captazione a livello pericardico di 18Ffluorodeossiglucosio (FDG) in pazienti con tumori solidi e con
linfoma è indicativa di un coinvolgimento (maligno) del pericardio, fornendo così informazioni essenziali per la diagnosi, la
stadiazione e la valutazione della risposta terapeutica123. La
captazione è solitamente intensa e spesso associata alla pre-
senza di una lesione focale a livello dei tessuti molli124. La
TC/PET può inoltre essere utile nell’identificare l’eziologia della
pericardite infiammatoria. In particolare, la pericardite tubercolare produce captazioni di FDG più elevate rispetto alle forme idiopatiche125. Tuttavia, la differenziazione tra malattia pericardica benigna e maligna, nonché la differenziazione tra captazioni fisiologiche e patologiche di FDG a livello cardiaco mediante la TC/PET rimane difficoltosa123.
4.1.6 Cateterismo cardiaco
Il cateterismo cardiaco non viene usato di routine per la diagnosi di malattia pericardica, data la attuale disponibilità di tecniche non invasive generalmente in grado di risolvere la diagnosi differenziale di sospetta malattia cardiaca con coinvolgimento del pericardio. Tuttavia, ancora oggi, il cateterismo cardiaco destro può essere utile in alcune circostanze. Il riconoscimento precoce di anomalie emodinamiche associate a tamponamento cardiaco durante le procedure invasive (es. ablazione
epicardica, impianto percutaneo della valvola aortica, angioplastica complessa o procedure complesse che coinvolgono
punture transettali) può contribuire ad evitare conseguenze catastrofiche per il paziente. Inoltre, la differenziazione tra pericardite costrittiva e cardiomiopatia restrittiva è talvolta difficile
e può richiedere un test invasivo.
Nel tamponamento cardiaco, la curva della pressione atriale destra ha una discesa attenuata o assente dell’onda Y. La discesa assente dell’onda Y è secondaria all’equalizzazione diastolica delle pressioni nell’atrio destro e nel ventricolo destro e
alla mancanza di un flusso efficace attraverso la valvola tricuspide nella fase precoce della diastole ventricolare. Può essere,
inoltre presente l’equalizzazione delle pressioni media atriale
destra, ventricolare destra, polmonare diastolica, e della pressione di incuneamento polmonare. Altre anomalie emodinamiche comprendono un’elevazione della pressione di riempimento in tutte le quattro camere cardiache, picchi delle pressioni sistoliche del ventricolo destro e del ventricolo sinistro discordanti, variazioni superiori a 10-12 mmHg del picco di pressione aortica e una diminuzione della gittata cardiaca126,127.
Rimane tuttora difficile la differenziazione della pericardite
costrittiva dalla cardiomiopatia restrittiva. La visualizzazione del
pericardio mediante TC o RMC può essere d’aiuto nell’individuare anomalie del pericardio, ma questi esami forniscono informazioni anatomiche e non riflettono necessariamente l’anomalia fisiopatologica presente. Per di più, pazienti con pericarditi costrittive accertate chirurgicamente possono avere un peG ITAL CARDIOL | VOL 16 | DICEMBRE 2015
721
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
ricardio di aspetto normale agli studi di imaging. Al contrario alcuni pazienti possono avere un anomalo spessore del pericardio in assenza di costrizione, soprattutto in seguito a radioterapia o precedenti interventi cardiaci. Classicamente, la misurazione diretta delle pressioni mostra un aspetto ad M o a W
della curva di pressione atriale e un aspetto a “radice quadrata” o “dip-and-plateau” della curva di pressione del ventricolo
destro, indicativi di compromissione del riempimento ventricolare. Nella pericardite costrittiva l’equalizzazione della pressione telediastolica tra le camere cardiache (tipicamente entro i 5
mmHg) si verifica a causa dello spazio fisso e limitato all’interno del pericardio ispessito e rigido. La pressione sistolica arteriosa polmonare è di solito normale nella costrizione pericardica; pressioni polmonari elevate suggeriscono una cardiomiopatia restrittiva126.
Recentemente, un nuovo parametro emodinamico è stato
testato per differenziare queste due entità96. Nello specifico, il
rapporto tra le aree sottese dalla curva pressione–tempo sistolica del ventricolo destro e del ventricolo sinistro, valutato in inspirazione rispetto all’espirazione (systolic area index) è stato
utilizzato come misura della maggiore interdipendenza ventricolare. In pazienti con pericardite costrittiva chirurgicamente
documentata, durante l’inspirazione vi è un aumento dell’area
sottesa dalla curva pressoria del ventricolo destro rispetto all’espirazione. L’area sottesa dalla curva pressoria del ventricolo
sinistro si riduce durante l’inspirazione rispetto all’espirazione.
Al contrario, i pazienti con malattia miocardica restrittiva documentata mediante biopsia endomiocardica presentano generalmente una riduzione dell’area sottesa dalla curva di pressione del ventricolo destro durante l’inspirazione rispetto a all’espirazione. L’area sottesa della curva di pressione del ventricolo sinistro è invariata durante l’inspirazione rispetto all’espirazione. Il systolic area index ha mostrato una sensibilità del
97% e un valore predittivo positivo del 100% nell’identificare i
pazienti con pericardite costrittiva accertata chirurgicamente96.
4.1.7 Imaging multimodale
L’ecocardiografia, la TC cardiaca e la RMC sono spesso utilizzate come tecniche di imaging complementari (Tabella 13). La
scelta di uno o più indagini strumentali è guidata dal contesto
clinico o dalle condizioni del paziente. Un approccio moderno
per la gestione delle malattie pericardiche dovrebbe includere
l’integrazione di diverse modalità di imaging per migliorare l’accuratezza diagnostica e la gestione clinica dei pazienti2,3.
4.2 Proposta di un procedimento diagnostico generale
Nella gestione delle malattie del pericardio è particolarmente
controversa l’attuazione di una lunga indagine eziologica e il
ricovero per tutti i pazienti con pericardite o versamento pericardico1,4,6,51. Il contesto epidemiologico risulta essenziale nella programmazione di una gestione razionale secondo un rapporto costo-beneficio e il medico deve individuare soprattutto
le cause che richiedono terapie mirate4,5,51,128-130. L’approccio
può essere diverso per la ricerca, quando si ha come obiettivo
la riduzione del numero di casi “idiopatici”. La diagnosi di casi
idiopatici è essenzialmente una diagnosi di esclusione, supportata da un decorso clinico tipico.
Su questa base, l’auscultazione, l’ECG, l’ecocardiografia, la
radiografia del torace, gli esami del sangue di routine, tra cui i
marcatori di infiammazione (PCR e/o VES) e gli indici di lesione
miocardica (CK, troponine) sono raccomandati in tutti i casi di
722
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
Tabella 13. Confronto tra modalità di imaging non invasivo per studiare il pericardio.
ETT
Aspetti tecnici
Disponibilità
Costo
Durata dell’esame (min)
Sicurezza
Accesso del paziente e monitoraggio
+++
Basso
15-30
+++
+++
TC
RMC
++
+
Moderato Elevato
10
30-40
+a
++b
++
+/-
Pericardio
Spessore pericardico
Calcificazioni pericardiche
Infiammazione del pericardio
Mobilità degli strati (aderenze)
Identificazione del versamento
Caratterizzazione del versamento
Masse pericardiche
Guida/monitoraggio della pericardiocentesi
+/+
+/++
++
+
+
+++
+++
+++
++
+
+++
++
+/++
-
+++
+++
+++
+++
++
++/+++
-
Morfologia cardiaca
(compresa la caratterizzazione tissutale)
++
++
+++
+++
+++
+++
++c
+/-
+++
++
+++
++
+/-
++
Funzione cardiaca
Sistolica
Diastolica
Movimento del setto
(interdipendenza ventricolare)
Modifiche respiratorie
ETT, ecocardiografia transtoracica; RMC, risonanza magnetica cardiaca; TC,
tomografia computerizzata.
(-) non possibile o scarso; (+) moderato; (++) buono; (+++) eccellente.
aradiazioni ionizzanti, potenziale nefrotossicità del mezzo di contrasto, reazioni allergiche al mezzo di contrasto; bpazienti portatori di dispositivi metallici, claustrofobia, potenziale nefrotossicità del mezzo di contrasto, reazioni allergiche al mezzo di contrasto, limitata solo ai pazienti emodinamicamente stabili; cuso di ECG sincronizzati per l’acquisizione dei dati.
sospetta pericardite. Ulteriori test devono essere correlati al sospetto eziologico e alla presentazione clinica5,6,128-130.
Le principali cause specifiche da escludere sono la pericardite batterica (soprattutto la tubercolosi), la pericardite neoplastica e le pericarditi associate a una malattia sistemica (solitamente una malattia autoimmune (Tabella 5 online)9,77,129-131.
Ognuna di queste cause specifiche ha una frequenza di circa il
5% di tutti i casi non selezionati di pericardite dei paesi industrializzati (Tabella 5 online)9,77,129-131, mentre la frequenza aumenta nei casi di versamento pericardico di grado da moderato a grave (Tabella 3 online)8,74-78. Cause aggiuntive emergenti comprendono eventi iatrogeni (interventi coronarici percutanei, inserimento di pacemaker, ablazioni transcatetere)132. Lo
spettro eziologico è diverso nei paesi in via di sviluppo con una
alta prevalenza di tubercolosi (dal 70% all’80% di casi di pericardite nell’Africa sub-sahariana, e spesso associata a infezione da HIV)52,79.
Alcune caratteristiche cliniche presenti all’esordio possono
essere associate ad un aumentato rischio di eziologie specifiche
(non virali o non idiopatiche) e di complicanze durante il followup (recidive, tamponamento, costrizione), e sono proposte come “caratteristiche ad alto rischio” utili per il triage della pericardite, per stabilire la necessità di una ricerca eziologica completa e del ricovero per il singolo paziente (Figura 1, Tabella 6 online)8,9. Fattori indicati come “maggiori” sono stati validati da
una analisi multivariata, mentre i fattori indicati come “minori”
si basano su parere di esperti e revisione della letteratura9: sono
fattori di rischio essenzialmente teorico di complicanze e suggeriscono l’indicazione per l’ammissione e l’attento controllo
dell’evoluzione clinica. I fattori di rischio maggiori includono:
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
Raccomandazioni per il procedimento diagnostico generale nelle malattie del pericardio
Raccomandazioni
Classea Livellob
In tutti i casi di sospetta malattia del
pericardio è raccomandata una prima
valutazione con:
– auscultazione
– ECG
– ecocardiografia transtoracica
– Rx torace
– esami ematici di routine, includendo
marker di infiammazione (PCR e/o
VES), conta leucocitaria, indici di
funzione renale, epatica e di lesione
miocardica (CK, troponine).
I
C
Si raccomanda di ricercare predittori
indipendenti di una causa specifica
identificabile e trattabile di pericardite
(pericardite batterica, neoplastica,
malattia infiammatoria sistemica) per
identificare i pazienti ad elevato rischio
di complicanze. I fattori predittivi
maggiori comprendono:
– febbre >38°C
– decorso subacuto (sintomi che si
protraggono per molti giorni o settimane)
– grave versamento pericardico (spazio
diastolico echo-free >20 mm di spessore)
– tamponamento cardiaco and
– inefficacia di aspirina o FANS.
I
B
La TC e/o RMC sono raccomandate
come esami di secondo livello
per la diagnosi di pericardite.
I
La pericardiocentesi o il drenaggio
chirurgico sono indicati in caso
di tamponamento cardiaco o sospetta
pericardite batterica o neoplastica.
I
C
La biopsia pericardica percutanea o
chirurgica può essere presa in
considerazione in casi selezionati
nel sospetto di pericardite neoplastica
o tubercolare.
IIb
C
Ulteriori accertamenti sono indicati
in pazienti ad alto rischio (come
precedentemente definiti) in rapporto
alle condizioni cliniche.
I
Ref.c
re considerata una gestione ambulatoriale8. Questo approccio
è sicuro, senza un eccesso di complicanze e nuove diagnosi impreviste che richiedano una terapia specifica8,9,128. La stessa impostazione è utile anche per i pazienti con recidive che possono generalmente essere trattati come pazienti ambulatoriali, a
meno che non siano presenti predittori di prognosi sfavorevole
o non possa essere esclusa un’eziologia specifica. Con una chiara diagnosi di origine idiopatica e un decorso caratterizzato da
recidive con intervalli liberi da sintomi tra gli episodi, non appare
necessario ripetere una nuova ricerca eziologica ad ogni ricorrenza, a meno che divengano evidenti nuove caratteristiche cliniche. Gli accertamenti generali di primo e secondo livello sono riportati nelle raccomandazioni e nelle Tabelle 14-16.
8,9
5. EZIOLOGIE SPECIFICHE DELLE SINDROMI
PERICARDICHE
5.1 Pericarditi virali
5.1.2 Definizione e spettro clinico
Nei paesi industrializzati la maggior parte delle pericarditi sono
di eziologia virale o autoreattiva5,6,133-135. Le pericarditi acute
Tabella 14. Indagini di primo e secondo livello per la pericardite.
C
C
CK, creatina chinasi; ECG, elettrocardiogramma; PCR, proteina C-reattiva;
VES, velocità di eitrosedimentazione.
a
classe della raccomandazione.
b
livello di evidenza.
c
referenza bibliografica a supporto delle raccomandazioni.
febbre >38°C (hazard ratio [HR] 3.56), un decorso subacuto (sintomi che decorrono per diversi giorni o settimane, HR 3.97), un
versamento pericardico grave (spazio diastolico ecograficamente libero >20 mm di spessore) o un tamponamento cardiaco (HR
2.15) e l’inefficacia della terapia con aspirina o FANS (HR 2.50)8.
Il versamento pericardico grave e il tamponamento (HR 2.51) e
il fallimento della terapia con aspirina o FANS (HR 5.50) identificano anche un aumento del rischio di complicanze durante il
follow-up (recidive, tamponamento, costrizione)9. Fattori di rischio minori sono l’associazione pericardite-miocardite, l’immunodepressione, i traumi e la terapia anticoagulante orale.
Per i pazienti con predittori maggiori o minori di prognosi
sfavorevole (Figura 1) sono giustificati l’ospedalizzazione e una
ricerca eziologica completa5,6,8,9,128. Al contrario, quando questi predittori negativi sono assenti, i pazienti sono a basso rischio di eziologie specifiche e complicanze, pertanto può esse-
Livello
Indagine
Primo livello
(tutti i casi)
Marker di infiammazione (VES, PCR, conta
leucocitaria)
Test di funzione renale ed epatica, funzione tiroidea
Marker di lesione miocardica (troponine, CK)
ECG
Ecocardiografia
Radiografia del torace
Secondo livello
(se gli esami di
primo livello non
sono sufficienti
per la diagnosi)
TC e/o RMC
Analisi del liquido pericardico da pericardiocentesi
o drenaggio chirurgico per (a) tamponamento
cardiaco o (b) sospetta pericardite batterica o
neoplastica, o (c) versamenti pericardici sintomatici
da moderati a gravi non responsivi a terapia
antinfiammatoria convenzionale.
Test aggiuntivi devono essere indirizzati alla ricerca
di specifiche eziologie in rapporto al quadro
clinico (presenza di criteri di rischio elevato)
CK, creatina chinasi; ECG, elettrocardiogramma; PCR, proteina C-reattiva;
RMC, risonanza magnetica cardiaca; TC, tomografia computerizzata; VES,
velocità di eritrosedimentazione.
Tabella 15. Analisi principali da eseguire sul liquido pericardico.
Analisi
Test
Analisi chimica
Proteine >3 g/dl, rapporto proteine liquido/siero
>0.5, LDH >200 UI/l, rapporto liquido/siero
>0.6a, conta leucocitaria
Citologia
Citologia (volumi di liquido più elevati, la
centrifugazione e una rapida analisi migliorano
l’approccio diagnostico)
Reazione polimerasica Per la tubercolosi
a catena
Microbiologia
Colture di Mycobacterium, colture di aerobi
e anaerobi
LDH, lattato deidrogenasi.
aelevati valori di proteine e LDH sono comunemente interpretati come essudato, come nelle analisi del liquido pleurico, ma non sono stati validati per
il liquido pericardico.
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
723
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
Tabella 16. Flowchart diagnostica per alcune delle condizioni più comuni in pazienti ad alto rischio.
Liquido pericardicoa
Condizioni cliniche
Esami ematici
Imaging
Probabile condizione
autoimmune
– ANA, ENA, ANCA
– (ACE e calcio urinario
nelle 24h se sospetto
di sarcoidosi)
– Ferritina se sospetto
di malattia di Still
Considerare PET se sospetto
di vasculite dei grossi vasi
(Horton o Takayasu) o
sarcoidosi
Probabile tubercolosi
IGRA test (Quantiferon,
ELISpot, ecc.)
TC torace
– Colorazione bacillo acido
– Colture e PCR su escreato
veloce, colture per
o altri liquidi biologici
Mycobacterium
– Considerare biopsia
– PCR per genoma. Adenosina
pericardica
deaminasi >40 U/l, IFN-γ
non stimolato
Probabile neoplasia
Specifici marker neoplastici
non specifici o sensibili
(CA 125 è spesso non
specificatamente elevato
nel sangue quando sono
presenti versamenti sierosi)
TC torace e addome,
considerare PET
Citologia (più elevati volumi
di liquido, centrifugazione e
analisi rapide migliorano
l’approccio diagnostico).
Marker tumorali
(CEA >5 ng/ml o CYFRA 21-1
>100 ng/ml)
Considerare biopsia
pericardica
Probabile infezione
virale
– Per molti virus la ricerca
del genoma con PCR è
preferita alla sierologiab
– Considerare sierologia
per HCV e HIV
Ricerca del genoma con PCR
per specifici agenti infettivi,
es. enterovirus, adenovirus,
parvovirus B19, HHV-6,
CMV, EBVb
Consulenza con specialista in
malattie infettive in caso di
positività
Probabile infezione
batterica
– Emocolture prima di
TC torace
iniziare antibiotici
– Sierologia per Coxiella
burnetii se sospetto
di febbre Q
– Sierologia per Borrelia spp.
se sospetto di malattia
di Lyme
– Colture per aerobi e anaerobi
– Glucosio
Considerare biopsia
pericardica
Probabile malattia
autoinfiammatoria
(febbre periodica)
Mutazioni FMF e TRAPS
Possibili indizi di TRAPS sono
la familiarità e la scarsa
risposta alla colchicina
Versamento
pericardico cronico
TSH. Test di funzionalità
renale
Considerare esami appropriati
per sospetto di neoplasia
o tubercolosi
Probabile costrizione
BNP (quasi normale)
RMC, TC torace, cateterismo
biventricolare
Altro
Può essere utile una consulenza
specialistica. Ipereosinofilia
(Churg-Strauss), afte orali
e genitali (Behçet);
differente pressione arteriosa
alle due braccia (Takayasu),
secchezza oculare (Sjogren,
sarcoidosi), macroglossia
(amiloidosi)
Tutti gli esami per sospetta
tubercolosi
ACE, enzima di conversione dell’angiotensina; ANA, anticorpi antinucleo; ANCA, anticorpi anti-citoplasma dei neutrofili; BNP, peptide natriuretico cerebrale;
CEA, antigene carcino-embrionario; CMV, cytomegalovirus; EBV, virus di Epstein-Barr; ENA, anticorpi antigeni nucleari estraibili; FMF, febbre familiare mediterranea; HCV, virus dell’epatite C; HHV, herpesvirus umano; HIV, virus dell’immunodeficienza umana; IFN, interferone; IGRA, test di rilascio di interferone-γ; PCR, reazione polimerasica a catena; PET, tomografia ad emissione di positroni; RMC, risonanza magnetica cardiaca; spp, specie; TC, tomografia
computerizzata; TRAPS, sindrome periodica associata al recettore del fattore di necrosi tumorale; TSH, ormone tireotropo.
aprendere in considerazione di conservare un campione sterile per ulteriori analisi; bsi veda il paragrafo sulla pericardite virale – ad oggi, queste indagini non
hanno implicazioni prognostiche e terapeutiche.
Gli IGRA sono esami ematici che posso aiutare nella diagnosi di infezione da Mycobacterium tuberculosis; non sono di ausilio nel differenziare le infezioni tubercolari latenti dalla malattia tubercolare.
virali si manifestano spesso come malattia che si autolimita,
senza determinare complicanze nella maggior parte dei pazienti5,6,9,36. Tuttavia, come conseguenza di una pericardite virale, si possono avere tamponamento cardiaco, pericardite recidivante e più raramente pericardite costrittiva36.
5.1.3 Patogenesi
I virus cardiotropici possono causare una pericardite o una miocardite mediante un meccanismo diretto citolitico o citotossico
(enterovirus) e/o mediante un meccanismo T e/o B-cellulo-immunomediato (herpesvirus). La persistenza di acidi nucleici virali, senza che ci sia replicazione virale nel peri(mio)cardio, sostiene l’infiammazione e quindi il versamento pericardico, at-
724
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
traverso un processo (auto-) immune diretto contro le proteine
specifiche cardiache mediante il meccanismo di mimetismo molecolare133.
5.1.4 Diagnosi
La diagnosi definitiva di pericardite virale richiede un procedimento comprensivo di indagini istologiche, citologiche, immunoistologiche e molecolari sul liquido pericardico e biopsie peri/epicardiche ottenute tramite pericardioscopia, permettendo
la valutazione di possibili algoritmi per una terapia basata sull’eziologia133. Al contrario, i test sierologici sono risultati inutili
nella diagnosi di pericardite virale. Mentre nel siero di pazienti
con pericardite non si nota nessuna espressione di citochine
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
proinfiammatorie, nel liquido pericardico sono presenti TNF-α,
fattore di crescita endoteliale vascolare (VEGF), fattore di crescita basico dei fibroblasti (bFGF), IL-6, IL-8 e interferone-gamma (IFN-γ), indicando la presenza di reazioni locali infiammatorie134,135. Allo stesso modo, non vi è correlazione tra anticorpi
antivirali nel siero o isolamenti virali dalla gola o dai tamponi
rettali con la positività della reazione polimerasica a catena/analisi di ibridazione in situ per la rilevazione di virus cardiotropi
nel tessuto e nel liquido pericardico136.
5.1.5 Identificazione di acidi nucleici virali
Gli acidi nucleici di differenti RNA o DNA virus cardiotropi sono
stati rilevati principalmente con tecniche quantitative di reazione polimerasica a catena, nelle biopsie epicardiche e pericardiche e nel liquido pericardico di bimbi e adulti con pericardite
acuta, ma anche in pazienti con pericardite recidivante e costrittiva133,137. Per quanto riguarda gli RNA virus, sono stati
identificati nei pazienti con pericardite acuta e costrittiva vari
sottotipi di enterovirus, inclusi gli echovirus e i coxsackievirus
del gruppo A (A4, A16) e B (CVB2, CVB3, CVB4)137,138. Tra gli
RNA virus, sospetti agenti eziopatologici sono il virus dell’influenza A (H1N1, H5N1, H3N2) e occasionalmente il chikungunya virus, il coronavirus umano NL-63, il virus respiratorio
sinciziale e il virus della dengue.
A differenza degli RNA virus, gli acidi nucleici dei DNA virus,
inclusi il parvovirus B19 e gli herpesvirus (virus di Epstein-Barr
[EBV] e herpesvirus umano 6 [HHV-6]), sono presenti nelle biopsie pericardiche e nel liquido pericardico con maggior frequenza e con un numero maggiore di copie di DNA virale133. Mentre il parvovirus B19 è stato principalmente rilevato nel tessuto
epicardico fino a 7 x 106 GE/lg DNA, l’EBV viene trovato più
frequentemente nel liquido pericardico133. Il DNA del virus della varicella zoster, dell’herpes simplex virus e dell’adenovirus è
ritrovato raramente nei pazienti con pericardite. Le pericarditi
associate a cytomegalovirus (CMV) sono frequenti nei pazienti
immunocompromessi o con HIV1. Nei paesi in via di sviluppo
con una terapia antiretrovirale che inizia tardivamente, sono
comuni le reazioni infiammatorie del pericardio e del miocardio
associate al virus HIV (spesso correlato alla tubercolosi)139. Tuttavia, ad oggi, queste indagini non vengono eseguite solitamente, a causa della loro complessità, costo, natura invasiva e
bassa accessibilità.
5.1.6 Terapia
La pericardite virale acuta si presenta spesso come malattia che
si autolimita e che risponde bene ad un breve trattamento con
FANS, con l’aggiunta della colchicina, specialmente nella prevenzione delle recidive4-6,50,58,59. L’identificazione di caratteristiche virali specifiche aiuta a capire i meccanismi patogenetici
della pericardite e potrebbe permettere un approccio terapeutico specifico individualizzato sulla base eziologica, distinguendo così le pericarditi ad eziologia virale dalle forme autoreattive133. Alcuni esperti suggeriscono un trattamento virale simile
a quello per le miocarditi (IVIG nelle infezioni acute sistemiche
da enterovirus, CMV, EBV e parvovirus B19; valganciclovir orale nelle perimiocarditi da HHV6; IFN-γ nelle pericarditi enterovirali)133. Questi trattamenti sono tuttavia ancora in fase di osservazione e raramente utilizzati. È raccomandato invece il coinvolgimento di specialisti infettivologi. Non è disponibile finora
una terapia che risolva il problema della persistenza virale e la
conseguente infiammazione, indotta specialmente dalle infezioni da herpesvirus e parvovirus B19133. Nelle pericarditi virali
i corticosteroidi non sono generalmente indicati, in quanto è
noto che riattivino le infezioni virali e quindi alimentano l’infiammazione133.
Raccomandazioni per la diagnosi e la terapia delle pericarditi
virali
Classea
Livellob
Per la diagnosi definitivad di pericardite
virale deve essere preso in considerazione
un procedimento comprensivo di indagini
istologiche, citologiche, immunoistologiche
e molecolari sul liquido pericardico e su
biopsie peri/epicardiche.
IIa
C
La sierologia virale non è raccomandata
di routine, con la possibile eccezione
per HIV e HCV.
III
C
La terapia corticosteroidea non è
raccomandata nelle pericarditi virali.
III
C
Raccomandazioni
Ref.c
HCV, virus dell’epatite C; HIV, virus dell’immunodeficienza umana.
della raccomandazione.
di evidenza.
c
referenza bibliografica a supporto delle raccomandazioni.
din assenza di questi dati, deve essere usato il termine di “pericardite
presunta virale”.
aclasse
blivello
5.2 Pericarditi batteriche
Le pericarditi batteriche sono relativamente poco comuni nella
pratica clinica nei paesi industrializzati con bassa prevalenza di
tubercolosi. La pericardite tubercolare è la forma di pericardite
più diffusa al mondo e prima causa di malattia del pericardio
nei paesi in via di sviluppo. Approfondiremo soprattutto questa
forma e descriveremo successivamente la pericardite purulenta che è meno comune.
5.2.1 Pericardite tubercolare
La pericardite tubercolare è presente per ≤4% tra le malattie
del pericardio nei paesi industrializzati5,6,52. Viceversa, la tubercolosi è la prima causa di versamento pericardico in oltre
il 90% di individui infetti da HIV e nel 50-70% degli individui
non infetti da HIV ma che vivono in paesi in via di sviluppo,
dove la tubercolosi è endemica77. La malattia può presentarsi ad ogni età e gli uomini sono colpiti maggiormente che le
donne140. La presentazione clinica più comune è un quadro di
compressione cronica cardiaca che mima lo scompenso cardiaco79,93. Le manifestazioni cliniche sono il versamento pericardico, la pericardite effusivo-costrittiva o la pericardite costrittiva79. La pericardite tubercolare ha un tasso di mortalità
del 17-40% a 6 mesi dalla diagnosi141. Deve essere enfatizzato che la maggior parte delle informazioni sulla pericardite
tubercolare proviene dalle aree endemiche dei paesi sottosviluppati e dai pazienti immunodepressi, pertanto l’applicabilità di queste informazioni nei paesi del mondo occidentale è
discutibile.
5.2.1.1 Diagnosi
Una diagnosi “certa” di pericardite tubercolare è basata sulla
presenza di bacilli tubercolari nel liquido pericardico o sulle sezioni istologiche del pericardio, attraverso la coltura o mediante reazione polimerasica a catena (Xpert MTB/RIF), mentre viene posta una diagnosi “probabile” se c’è prova di tubercolosi
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
725
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
altrove in un paziente con pericardite inspiegabile, se c’è un essudato linfocitico pericardico con un elevato livello di IFN-γ non
stimolato (uIFN-γ), adenosina deaminasi (ADA) o livelli di lisozima e/o se c’è un’appropriata risposta alla terapia antitubercolare nelle aree endemiche79. Il uIFN-γ offre un’accuratezza maggiore per la diagnosi microbiologica di pericardite tubercolare rispetto all’analisi ADA e al test Xpert MTB/RIF142. Nella Tabella
17 viene proposto un protocollo di valutazione in caso di sospetto versamento pericardico tubercolare.
5.2.1.2 Terapia
Un regime costituito da rifampicina, isoniazide, pirazinamide
ed etambutolo per almeno 2 mesi, seguito da isoniazide e rifampicina (per un totale di 6 mesi di terapia) è efficace nel trattamento della tubercolosi extrapolmonare. Un trattamento di
≥9 mesi non fornisce risultati migliori e ha lo svantaggio di costi maggiori e il rischio di una scarsa compliance143.
L’evoluzione verso una forma di pericardite costrittiva costituisce una complicanza potenziale e seria. La costrizione generalmente si sviluppa entro 6 mesi dalla presentazione della
pericardite effusiva (pericardite effusivo-costrittiva)79. La costrizione pericardica tubercolare è quasi sempre associata ad ispessimento pericardico. Prima dell’introduzione di una terapia antitubercolare efficace, più del 50% dei pazienti con pericardite
effusiva tubercolare progrediva verso una costrizione. Il trattamento antitubercolare basato sulla rifampicina riduceva l’incidenza di costrizione del 17-40%. Una terapia antibiotica appropriata è essenziale nel prevenire la costrizione79,144. In aggiunta, due interventi possono ridurre l’incidenza di costrizione:
primo, l’urochinasi intrapericardica145; secondo, il trial IMPI (Investigation of the Management of Pericarditis) ha dimostrato
che alte dosi aggiuntive di prednisolone riducono l’incidenza di
pericardite costrittiva del 46% indipendentemente dalla presenza del HIV97.
La terapia steroidea aggiuntiva con prednisolone per 6 settimane ha un effetto neutrale sull’outcome combinato di morte per tutte le cause, tamponamento cardiaco che richiede
pericardiocentesi o pericardite costrittiva, ma questa terapia è
associata ad un aumentato rischio di neoplasie HIV-correlate
nel gruppo trattato con prednisolone97. La terapia aggiuntiva
steroidea è associata ad una riduzione dell’incidenza di costrizione pericardica e di ospedalizzazione. Gli effetti benefici
del prednisolone sulla costrizione e sull’ospedalizzazione sono simili nei pazienti HIV-positivi e HIV-negativi. Basandosi su
questi dati, è ragionevole nei pazienti con pericardite tubercolare senza infezione da HIV usare in aggiunta gli steroidi ed
evitarli negli individui con HIV per il rischio aumentato di neoplasie97.
Tabella 17. Protocollo a step per la valutazione di sospetta pericardite tubercolare e di versamento pericardico tubercolare.
Fase 1:
Valutazione iniziale non invasiva
•
•
•
•
•
•
•
Fase 2:
Pericardiocentesi
Fase 3:
Biopsia pericardica
•
•
La pericardiocentesi terapeutica è assolutamente indicata in presenza di tamponamento cardiaco.
La pericardiocentesi diagnostica deve essere presa in considerazione in tutti i pazienti con pericardite sospetta
tubercolare, eseguendo i seguenti test sul liquido pericardico:
1. Inoculazione diretta del liquido pericardico nel terreno di coltura Kirchner medium base (o equivalente
medium) e colturale per M. tuberculosis.
2. Testare la reazione polimerasica a catena (Xpert MTB/RIF) per M. tuberculosis.
3. Test biochimici per distinguere tra essudato e trasudato (proteine del versamento pericardico e sieriche;
LDH del versamento pericardico e sieriche).
4. Analisi e conta dei leucociti e citologia: un essudato linfocitico depone per infezione tubercolare.
5. Test indiretti per infezione tubercolare: interferone-γ (IFN-γ), ADA o determinazione del lisozima.
•
Biopsia “terapeutica”: durante un drenaggio chirurgico nei pazienti con tamponamento cardiaco che recidiva
dopo pericardiocentesi o che richiede un drenaggio di liquido pericardico a cuore aperto a causa di un
accumulo recidivante di liquido pericardico o di risposta fallita alla terapia medica.
Biopsia “diagnostica”: in zone dove la tubercolosi è endemica, non è richiesta una biospia diagnostica prima
di iniziare il trattamento empirico antitubercolare. Nelle zone dove la tubercolosi non è endemica, una biopsia
diagnostica è raccomandata nei pazienti con >3 settimane di malattia e senza diagnosi eziologica raggiunta
con altre indagini.
•
Fase 4:
Chemioterapia antitubercolare
empirica
Rx torace: può rilevare lesioni suggestive di tubercolosi polmonare nel 30% dei casi.
Ecocardiogramma: la presenza di un versamento pericardico abbondante denso simile al porridge è
suggestivo di un essudato ma non specifico per eziologia tubercolare.
TC e/o RM del torace sono modalità di imaging alternative quando disponibili: evidenza di versamento
pericardico o ispessimento pericardico (>3 mm), linfoadenopatie tipiche mediastiniche e tracheobronchiali
(>10 mm, con centro ipodenso), con risparmio dei linfonodi ilari.
Analisi colturali per Mycobacterium tuberculosis (M. tuberculosis) dello sputo, aspirato gastrico e/o urine
devono essere prese in considerazione in tutti i pazienti.
Biopsia dei linfonodi: se il versamento pericardico non è accessibile e se sono presenti linfoadenopatie.
Il test cutaneo della tuberculina non è utile negli adulti indipendentemente dalla prevalenza di tubercolosi nel
proprio paese.
Se il versamento pericardico non è accessibile, nei pazienti che vivono nelle aree endemiche, è altamente
suggestivo per pericardite tubercolare lo score diagnostico con punteggio ≥6, basato sui seguenti criteri:
febbre (1), sudorazione notturna (1), perdita di peso (2), livelli di globuline >40 g/l (3) e conta periferica
leucocitaria <10 x 109/l (3).
•
•
Tubercolosi endemica nella popolazione: la chemioterapia antitubercolare empirica è raccomandata per
versamenti pericardici essudativi, dopo l’esclusione di altre cause tra cui neoplasie, uremia, traumi, pericarditi
purulente e malattie autoimmuni.
Tubercolosi non endemica nella popolazione: se le indagini sistematiche falliscono nel diagnosticare la
tubercolosi, non è giustificato iniziare un trattamento antitubercolare.
ADA, adenosina deaminasi; LDH, lattato deidrogenasi; RM, risonanza magnetica; TC, tomografia computerizzata.
726
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
Raccomandazioni per la diagnosi e il trattamento della pericardite tubercolare e del versamento tubercolare
Raccomandazioni
Classea Livellob
La pericardiocentesi diagnostica deve
essere presa in considerazione in tutti
i pazienti con sospetta pericardite
tubercolare.
IIa
C
Un esteso drenaggio o l’urochinasi
intrapericardica possono essere presi in
considerazione per ridurre il rischio di
evoluzione in pericardite tubercolare
effusiva costrittiva.
IIb
C
Nei pazienti che vivono in aree non .
endemiche, il trattamento antitubercolare
empirico non è raccomandato quando
le indagini sistematiche non conducono
ad una diagnosi di pericardite tubercolare
III
C
Nei pazienti che vivono in aree endemiche,
la terapia antitubercolare empirica è
raccomandata nei casi di versamento
essudativo pericardico dopo aver escluso
altre cause.
I
C
Una terapia steroidea aggiuntiva può essere
presa in considerazione nei pazienti con
pericardite tubercolare HIV-negativi,
mentre va evitata nei pazienti con
pericardite tubercolare associata ad HIV.
IIb
C
Ref.c
dell’immunosoppressione iatrogena HIV-associata è testimone
degli organismi più inusuali.
5.2.2.2 Diagnosi
La pericardite purulenta è oggigiorno rara e solitamente si manifesta in modo serio con febbre. La sottostante sepsi può predominare la malattia146-149. Il sospetto di pericardite purulenta
è indicazione per la pericardiocentesi in urgenza1,5,12, che è diagnostica. Il versamento può essere francamente purulento. Un
basso rapporto glucosio nel liquido/sierico (media 0.3) ed
un’elevata conta leucocitaria nel liquido pericardico con predominanza di neutrofili (conta cellulare media 2.8/μl, 92% neutropili) differenzia la pericardite purulenta da quella tubercolare (rapporto glucosio 0.7, conta leucociti 1.7/μl, 50% neutrofili) e neoplastica (rapporto glucosio 0.8, conta 3.3/μl, 55%
neutrofili)150. Il liquido pericardico deve essere inviato per analisi batterica, fungina e tubercolare, il sangue per le colture e altri campioni presi in base alla presentazione clinica12.
5.2.2.3 Terapia
La pericardite purulenta deve essere gestita aggressivamente in
quanto la morte è inevitabile se non trattata, mentre con una
terapia adeguata si ha una sopravvivenza dell’85% con una
prognosi a lungo termine buona50,146. Deve essere iniziata empiricamente una terapia antimicrobica per via endovenosa in
attesa dei risultati microbiologici. Il drenaggio è cruciale. Il li-
HIV, virus dell’immunodeficienza umana.
della raccomandazione.
blivello di evidenza.
creferenza bibliografica a supporto delle raccomandazioni.
aclasse
Raccomandazioni per la diagnosi della pericardite purulenta
Raccomandazioni per la gestione generale della pericardite costrittiva tubercolare
Raccomandazioni
Classea Livellob
La terapia antitubercolare standard è
raccomandata per 6 mesi per la
prevenzione della pericardite costrittiva
tubercolare.
I
C
La pericardiectomia è raccomandata se le
condizioni del paziente non migliorano
o si deteriorano dopo 4-8 settimane
di terapia antitubercolare.
I
C
Ref.c
Classea Livellob
Raccomandazioni
Per la diagnosi di pericardite purulenta è
raccomandata la pericardiocentesi
in urgenza.
I
C
Si raccomanda di inviare il liquido pericardico
ad analisi batteriologiche, fungine,
tubercolari ed ottenere campioni
di emocolture.
I
C
Ref.c
a
classe della raccomandazione.
di evidenza.
referenza bibliografica a supporto delle raccomandazioni.
blivello
c
aclasse
della raccomandazione.
livello di evidenza.
bibliografica a supporto delle raccomandazioni.
b
creferenza
Raccomandazioni per la terapia della pericardite purulenta
Classea Livellob
Raccomandazioni
5.2.2 Pericardite purulenta
5.2.2.1 Epidemiologia
La pericardite purulenta è rara, meno dell’1% dei casi5,6. Nei
paesi occidentali, gli organismi più comuni sono gli stafilococchi, streptococchi e pneumococchi, quando le manifestazioni
predominanti associate sono l’empiema (50%) o la polmonite
(33%)146. Nei pazienti immunodepressi o in seguito a chirurgia
toracica, lo Staphylococcus aureus (30%) ed i funghi (20%) sono molto comuni147. Vengono riportati in letteratura anche gli
anaerobi che originano dall’orofaringe148. La semina può essere ematogena o per diffusione contigua dallo spazio retrofaringeo, dalle valvole cardiache e sotto il diaframma149. Neisseria meningitidis può coinvolgere il pericardio con un versamento sterile tramite un meccanismo immuno-mediato o un
versamento purulento per infezione diretta. La moderna era
Per la pericardite purulenta è raccomandato
un efficace drenaggio pericardico.
I
C
Per il trattamento della pericardite purulenta
è indicata la somministrazione endovenosa
di antibiotici.
I
C
Devono essere presi in considerazione
la pericardiotomia sottoxifoidea e il lavaggio
della cavità pericardica.
IIa
C
Deve essere presa in considerazione
la trombolisi intrapericardica.
IIa
C
In caso di spesse aderenze, versamento
purulento saccato o spesso, recidive di
tamponamento, infezione persistente o
progressione alla costrizione deve essere
presa in considerazione la pericardiectomia.
IIa
C
Ref.c
a
classe della raccomandazione.
livello di evidenza.
referenza bibliografica a supporto delle raccomandazioni.
b
c
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
727
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
quido purulento è spesso loculato e tende a riaccumularsi rapidamente. La trombolisi intrapericardica costituisce un possibile trattamento nei casi di versamento pericardico saccato per
ottenere un adeguato drenaggio prima di ricorrere alla chirurgia151. Devono essere prese in considerazione la pericardiotomia sottoxifoidea e il lavaggio della cavità pericardica1. Questo
permette un drenaggio più completo del versamento tramite
una lisi manuale delle locuzioni.
5.3 Pericardite nell’insufficienza renale
La malattia renale ed in generale l’insufficienza renale terminale (ESRD) sono associate a possibile coinvolgimento pericardico152. Nei pazienti uremici si riscontrano tre differenti manifestazioni: la pericardite uremica – prima della terapia dialitica
o entro 8 settimane dal suo inizio; la pericardite dialitica – dopo aver iniziato stabilmente la dialisi (di solito ≥8 settimane dal
suo inizio)153; e molto raramente la pericardite costrittiva. L’incidenza globale della pericardite nei pazienti con ESRD si è ridotta al 5% circa in quelli che hanno iniziato la dialisi152. La frequenza di pericardite dialitica riportata varia dal 2% al 21%,
anche se mancano dati recenti.
Il coinvolgimento pericardico nella ESRD si manifesta più
comunemente come pericardite acuta e versamento pericardico cronico e meno frequentemente come pericardite costrittiva cronica. Le caratteristiche tipiche di questa forma di pericardite includono una percentuale minore di dolore toracico pleuritico (fino al 30% dei pazienti sono asintomatici) e l’assenza di
anomalie all’ECG nella maggior parte dei casi, probabilmente
dovute alla mancanza di infiammazione miocardica152-154. I pazienti con ESRD sono molto più propensi a sviluppare un versamento pericardico cronico dovuto al continuo volume scambiato152. Non tutti i versamenti pericardici sono dovuti ad infiammazione ed il normale volume di liquido pericardico è maggiore nei pazienti sottoposti stabilmente ad emodialisi rispetto
ai controlli normali155. Con l’avvento della terapia emodialitica
l’incidenza di versamenti emodinamicamente significativi è diminuita152,156,157. La più probabile causa di pericardite uremica
Raccomandazioni per il trattamento della pericardite nell’insufficienza renale
Raccomandazioni
Classea Livellob
In caso di pericardite uremica deve essere
presa in considerazione la dialisi.
IIa
C
Quando i pazienti con adeguato trattamento
dialitico sviluppano una pericardite deve
essere presa in considerazione
un’intensificazione della dialisi.
IIa
C
Nei pazienti non responsivi alla dialisi può
essere presa in considerazione l’aspirazione
e/o il drenaggio del liquido pericardico.
IIb
C
In caso di dialisi intensiva inefficace possono
essere presi in considerazione i FANS e i
corticosteroidi (sistemici o intrapericardici).
IIb
C
La colchicina è controindicata nei pazienti
con pericardite e insufficienza renale
severa (si veda Tabella 1B online).
III
C
FANS, farmaci antinfiammatori non steroidei.
della raccomandazione.
blivello di evidenza.
creferenza bibliografica a supporto delle raccomandazioni.
aclasse
728
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
Ref.c
è la ritenzione di metaboliti tossici152,157. Dal momento che nei
pazienti uremici il versamento pericardico è spesso ematico, gli
anticoagulanti devono essere considerati con prudenza o evitati
nei pazienti che iniziano la dialisi152,157.
5.4 Coinvolgimento pericardico nelle malattie
autoimmuni sistemiche e autoinfiammatorie
Il coinvolgimento pericardico nelle malattie sistemiche autoimmuni può essere sintomatico (pericardite e versamento pericardico sintomatico) o asintomatico (solitamente versamento
pericardico) e generalmente riflette il grado di attività della malattia sottostante45. Circa il 5-15% dei pazienti con pericardite
acuta o recidivante può avere una malattia autoimmune sistemica, nota o misconosciuta (Tabella 1, Tabella 5 online)9,77,129-131.
Il coinvolgimento pericardico è comune nel lupus eritematoso
sistemico, nella sindrome di Sjögren, nell’artrite reumatoide e
nella sclerodermia, ma può essere anche presente nelle vasculiti sistemiche, nella sindrome di Behçet, nella sarcoidosi e nelle malattie infiammatorie intestinali. Il coinvolgimento pericardico raramente è la prima manifestazione di queste malattie.
Nella maggior parte dei pazienti la malattia sottostante è già
stata diagnosticata attraverso i classici sintomi e segni. Il coinvolgimento infiammatorio miocardico può complicare la presentazione e deve essere escluso. Se le caratteristiche cliniche
suggeriscono una possibile malattia autoimmune sistemica, deve essere fatta una ricerca eziologica mirata consultando gli
specialisti della disciplina. Il trattamento è mirato in particolare
al controllo della sottostante malattia sistemica45.
Una specifica sottocategoria di pazienti include quelli con le
febbri periodiche, che sono disordini genetici caratterizzati dalla mutazione dei geni coinvolti nella regolazione della risposta
infiammatoria, senza il coinvolgimento di cellule specifiche T o
di autoanticorpi158-161. Questi disordini sono solitamente diagnosticati nella popolazione pediatrica, sebbene la malattia insorga in alcuni pazienti in età adulta. Le più comuni sindromi
autoinfiammatorie includono la febbre mediterranea familiare
(FMF), nella quale gli episodi di sierosite durano solo 1-3 giorni e la sindrome periodica associata al recettore del fattore di
necrosi tumorale (TRAPS), nella quale gli episodi durano per
settimane. Le mutazioni associate a questi disordini sono rare
nella pericardite recidivante158-161. Queste condizioni possono
essere caratterizzate dall’esagerata espressione di IL-1161. Tra i
parenti di questi pazienti è stata riportata una percentuale del
10% di pericardite familiare162-164. Questi dati suggeriscono
una predisposizione genetica in almeno una categoria di pazienti; in questi casi viene consigliato un counseling genetico.
Una storia familiare di pericardite o febbri periodiche, una scarsa risposta alla colchicina, così come la necessità di farmaci immunosoppressivi sono elementi identificativi della possibile presenza di una malattia autoinfiammatoria160; particolarmente in
queste condizioni, possono essere considerati i farmaci anti-IL1 ed anti-TNF31,32,160.
5.5 Le sindromi post-lesione cardiaca
Il termine “sindrome post-lesione cardiaca” (post-cardiac injury, PCIS) indica un gruppo di sindromi infiammatorie pericardiche che includono le pericarditi postinfartuali, la sindrome postpericardiotomica (PPS) e le pericarditi post-traumatiche (sia iatrogene che no)132. Si presume che tali sindromi abbiano una
patogenesi autoimmune determinata da un iniziale danno al
tessuto pericardico e/o pleurico in seguito ad una necrosi mio-
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
cardica (pericardite tardiva dopo un infarto miocardico o sindrome di Dressler), ad un trauma chirurgico (PPS), ad un trauma toracico accidentale (pericardite traumatica) o ad un trauma iatrogeno con o senza sanguinamento (pericardite dopo interventi cardiaci invasivi)131. La patogenesi immuno-mediata è
supportata dal periodo di latenza generalmente di qualche settimana dalla comparsa della prima manifestazione e dalla risposta alla terapia antinfiammatoria (FANS, corticosteroidi, colchicina) con la possibilità di recidive. Il sanguinamento pericardico e l’incisione pleurica sono i fattori che scatenano la sindrome165,166. Alcune forme, come la sindrome di Dressler, sono
diventate ormai rare con l’avvento della riperfusione precoce
nell’infarto miocardico; tuttavia, si possono vedere specialmente nei casi di sanguinamento minore nel pericardio167.
5.5.1 Definizione e diagnosi
In accordo a quanto proposto per la PPS168-170, si può far diagnosi di PCIS dopo un insulto cardiaco con i seguenti criteri clinici: (a) febbre senza cause alternative, (b) dolore toracico pericardico o pleuritico, (c) sfregamenti pericardici o pleurici, (d)
evidenza di versamento pericardico e/o (e) versamento pleurico con elevata PCR. Devono essere presenti almeno 2 dei 5 criteri. Il razionale per l’utilizzo di questi specifici criteri anziché
quelli per la pericardite è che queste sindromi possono avere
un concomitante coinvolgimento pleuropericardico e possibili
infiltrati polmonari e non sono semplici pericarditi170. Inoltre a
volte è difficile differenziare la PCIS dalle semplici conseguenze meccaniche della chirurgia (come il versamento pleuropericardico). La dimostrazione di un’attività infiammatoria è essenziale per stabilire la diagnosi. La valutazione diagnostica basale di un paziente con sospetta PCIS include l’esame obiettivo,
l’ECG, l’ecocardiogramma, l’ecografia toracica e/o l’Rx torace132,165. Detto ciò, l’ecocardiografia è raccomandata quando si
sospetta una complicanza iatrogena dopo un intervento cardiovascolare2,3,132.
5.5.2 Terapia
Il trattamento della PCIS è essenzialmente basato sulla terapia
antiinfiammatoria empirica, che può migliorare il tasso di remissione e ridurre il rischio di recidive171. Lo stesso schema terapeutico adottato per le pericarditi è efficace anche per tutte
queste forme, incluse le pericarditi postinfartuali (Tabella 3). La
colchicina non è raccomandata per i versamenti post-intervento chirurgico in assenza di un’infiammazione sistemica172-174.
Allo stesso modo, i FANS non sono generalmente indicati nei
versamenti post-chirurgici asintomatici e il loro utilizzo può invece essere associato ad un rischio aumentato di eventi avversi da FANS173,174.
5.5.3 Prevenzione
Sono state studiate diverse strategie preventive, ma si tratta di
studi limitati, con l’aspirina175, il metilprednisone176, il desametasone177 e la colchicina168,169,172. Quattro studi clinici controllati per la prevenzione primaria della PPS sono stati inclusi
in una revisione sistematica di 894 pazienti: 3 studi erano trial
randomizzati controllati in doppio cieco. Il trattamento paragonava colchicina vs placebo (2 trial con 471 pazienti arruolati), metilprednisolone vs placebo (un trial con 246 pazienti pediatrici) e aspirina vs controlli storici (uno studio non randomizzato con 177 pazienti pediatrici). La metanalisi mostrava
che solo la colchicina era associata ad una riduzione del rischio
di PPS (odds ratio [OR] 0.38). I dati sul metilprednisolone (OR
1.13) e sull’aspirina (OR 1.00) erano negativi178. Il trial COPPS2 (Colchicine for Prevention of the Post-pericardiotomy Syndrome and Post-operative Atrial Fibrillation) confermava l’efficacia complessiva dell’uso perioperatorio della colchicina, ma
evidenziava anche una incidenza più elevata di eventi avversi
gastrointestinali172 in confronto all’utilizzo postoperatorio della colchicina169. La colchicina non è raccomandata nel trattamento perioperatorio e come prevenzione di versamenti postchirurgici in assenza di infiammazione sistemica172. In un altro
trial177, alte dosi di desametasone (1 mg/kg in singola dose intraoperatoria) non erano efficaci nel prevenire la PPS o la PPS
complicata.
5.5.4 Prognosi
Nonostante i dati pubblicati siano limitati, la prognosi della PPS
è generalmente buona178. Ci sono molti pochi dati disponibili
sulle altre forme di PCIS. Nella serie più numerosa pubblicata su
pazienti con PPS dopo cardiochirurgia166, l’incidenza di complicanze era bassa: <4% di recidive, <2% di tamponamento
cardiaco e nessun caso di costrizione, sebbene l’ospedalizzazione in questi pazienti fosse prolungata. Lo sviluppo di pericardite costrittiva è stato riportato in circa il 3% dei casi36.
5.5.4.1 Pericardite postinfartuale
In seguito ad un infarto miocardico acuto (IMA) possono verificarsi tre principali complicanze: (a) versamento pericardico, (b)
pericardite precoce associata ad infarto (spesso chiamata pericardite precoce postinfartuale, tipicamente pochi giorni dopo
IMA), (c) pericardite tardiva postinfartuale o sindrome di Dressler (tipicamente dopo 1-2 settimane dall’IMA).
La pericardite precoce postinfartuale di solito si verifica appena dopo l’IMA ed è transitoria. Questa complicanza è rara
nell’era dell’angioplastica coronarica percutanea primaria ed è
soprattutto correlata alla riperfusione tardiva o al fallimento
della riperfusione coronarica167. I criteri diagnostici non differiscono da quelli della pericardite acuta. Le alterazioni ECG sono
eclissate dalle alterazioni dovute all’infarto miocardico, anche se
il tratto ST può persistere elevato, con onde T verticali, così come le onde T possono diventare verticali dopo essersi invertite.
Deve essere effettuata l’ecocardiografia nei pazienti sospetti
per essere nella fase post-IMA, per valutare la presenza di versamento pericardico. La RMC può essere usata per mostrare la
presenza di concomitante infiammazione pericardica179. I pazienti con un versamento pericardico post-IMA >10 mm di
spessore dovrebbero essere indagati per una possibile rottura
cardiaca subacuta180,181. Il trattamento è solitamente di supporto, visto che molti casi si autolimitano, ma una minoranza
di pazienti può avere dei sintomi persistenti che richiedono più
di un trattamento di supporto. Per questi pazienti può essere
considerata l’aspirina in associazione alla colchicina.
La pericardite tardiva post-IMA (sindrome di Dressler) è rara (<1%) nell’era della procedura coronarica percutanea primaria e può riflettere un IMA molto esteso e/o una riperfusione tardiva167. La diagnosi e il trattamento sono simili a quelli
raccomandati generalmente per la PCIS.
Sebbene la pericardite sia associata ad un infarto maggiormente esteso, l’ospedalizzazione, la mortalità ad 1 anno e gli
eventi avversi cardiaci maggiori sono simili nei pazienti con o
senza pericardite. Un intervento coronarico percutaneo primario tempestivo può ridurre la frequenza di pericardite post-IMA.
La pericardite precoce post-IMA rimane un marker di infarto
esteso ma senza significato prognostico indipendente167.
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
729
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
Raccomandazioni per la gestione e la prevenzione delle sindromi post-lesione cardiaca
Classea
Livellob
Ref.c
Nei pazienti con PCIS è raccomandata la
terapia antinfiammatoria per accelerare
la remissione dei sintomi e ridurre
le recidive
I
B
171
L’aspirinad è raccomandata come prima
scelta nella terapia antinfiammatoria
delle pericarditi postinfartuali e in quei
pazienti che già assumono terapia
antiaggregante.
I
C
La colchicina aggiunta all’aspirina o ai FANS
deve essere presa in considerazione
nella terapia della PCIS, così come nelle
pericarditi acute.
IIa
B
58
La colchicina deve essere presa in
considerazione dopo un intervento
cardiochirurgico utilizzando dosi
aggiustate in base al peso corporeo
(0.5 mg/die per i pazienti ≤70 kg e 0.5 mg
bid per i pazienti >0 kg) e senza una
dose di carico per la prevenzione della
PPS se non sussistono controindicazioni
ed è tollerata. La somministrazione
preventiva di colchicina è raccomandata
per 1 mese.
IIa
A
168,169
Dopo PCIS deve essere preso in
considerazione un attento follow-up al
fine di escludere la possibile evoluzione
verso una pericardite costrittiva con
controlli ecocardiografici ogni 6-12 mesi
sulla base delle caratteristiche cliniche e
dei sintomi.
IIa
C
Raccomandazioni
FANS, farmaci antinfiammatori non steroidei; IMA, infarto miocardico acuto;
PCIS, sindrome post-lesione cardiaca; PPS, sindrome post-pericardiotomica.
aclasse della raccomandazione.
blivello di evidenza.
creferenza bibliografica a supporto delle raccomandazioni.
dl’effetto antiaggregante dell’aspirina è stato dimostrato fino alla dose di
1.5 g/die. Non ci sono dati che suggeriscono o controindicano l’uso di alte
dosi in questo contesto.
5.5.4.2 Versamenti postoperatori
I versamenti pericardici postoperatori sono relativamente comuni dopo cardiochirurgia. Di solito scompaiono entro 7-10
giorni, ma a volte persistono più a lungo e possono essere pericolosi. I versamenti precoci post-chirurgia cardiaca devono essere interpretati nel contesto clinico del paziente. Sono stati riportati come asintomatici nel 22% dei pazienti dopo 2 settimane dall’intervento cardiaco182. La prognosi è buona per i versamenti lievi che si verificano in due casi su tre, ma i versamenti
moderati o estesi (uno su tre) possono progredire verso il tamponamento cardiaco in circa il 10% dei casi ad 1 mese dall’intervento182,183. Nel trial POPE (Post-Operative Pericardial Effusion), il trattamento con diclofenac si è rivelato inutile nei versamenti asintomatici e può essere associato ad un aumentato
rischio di effetti avversi da FANS173. Viceversa, il tamponamento cardiaco che si verifica entro 1h dall’intervento cardiochirurgico è solitamente dovuto ad emorragia nello spazio pericardico ed in questa situazione è obbligatorio il reintervento.
5.6 Versamento pericardico traumatico
ed emopericardio
quenza) può essere responsabile di emopericardio e di tamponamento cardiaco per perforazione delle coronarie o delle camere cardiache. Il versamento pericardico indotto da trauma è
incluso nel concetto esteso di PCIS132. Tuttavia, nel caso di un
chiaro trauma toracico complicato da tamponamento cardiaco,
l’entità del trauma è la principale causa della sindrome. La diagnosi include la presenza di una storia pregressa di trauma toracico come fattore scatenante la sindrome in aggiunta a segni
e sintomi di pericardite (ossia dolore toracico, sfregamenti pericardici, dispnea, febbricola) e marker di infiammazione (elevazione della PCR, leucocitosi, VES). L’ECG è solitamente usato
per escludere l’IMA come possibile causa di pericardite. L’Rx torace può aiutare a identificare una cardiomegalia e versamento pleurico. L’ecocardiografia transtoracica è usata per identificare la presenza, le dimensioni e l’importante emodinamica del
versamento pericardico. Un recente trial randomizzato ha dimostrato che l’utilizzo dell’ecocardiografia transtoracica migliora la tempistica dall’ingresso in ospedale del paziente traumatizzato alla sala operatoria e riduce il tasso di mortalità184.
Il trattamento è quindi differente a seconda della gravità
della sindrome. Per i pazienti con pericardite post-traumatica
senza compromissione emodinamica, il trattamento è essenzialmente basato sulla terapia empirica antinfiammatoria, con
l’aggiunta della colchicina, che si è dimostrata sicura ed efficace nella prevenzione della pericardite57. Per i casi potenzialmente fatali di trauma con penetrazione del torace o del cuore, è raccomandata la toracotomia d’urgenza per migliorare la
sopravvivenza, anziché la classica strategia di effettuare la pericardiocentesi come ponte all’intervento chirurgico185,186. Generalmente viene impiegata la toracotomia sinistra antero-laterale, che consente di eseguire la pericardiotomia, con efficace regressione del tamponamento cardiaco, e il massaggio cardiaco diretto quando necessario.
In caso di dissezione aortica con emopericardio e sospetto
tamponamento cardiaco, si devono eseguire un’ecocardiogra-
Raccomandazioni per la gestione del versamento pericardico
traumatico e dell’emopericardio nella dissezione aortica
Raccomandazioni
730
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
Ref.c
Una tecnica di imaging urgente
(ecocardiogramma transtoracico o TC) è
indicata nei pazienti con storia di trauma
toracico e ipotensione arteriosa sistemica.
I
B
184
Una toracotomia immediata è indicata
nel tamponamento cardiaco da trauma
penetrante il cuore e il torace.
I
B
185
IIa
C
IIb
B
Nel contesto della dissezione aortica con
emopericardio, deve essere preso in
considerazione un drenaggio pericardico
controllato con evacuazione di minime
quantità di liquido ematico al fine di
stabilizzare temporaneamente il paziente
e mantenere una pressione di circa
90 mmHg.
La pericardiocentesi in attesa della
toracotomia può essere presa in
considerazione in caso di tamponamento
cardiaco da trauma penetrante il cuore
e il torace.
TC, tomografia computerizzata.
classe della raccomandazione.
b
livello di evidenza.
c
referenza bibliografica a supporto delle raccomandazioni.
a
Qualsiasi intervento cardiaco (es. interventi coronarici percutanei, inserzione dei fili del pacemaker, ablazione in radiofre-
Classea Livellob
185
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
fia transtoracica o una TC per confermare la diagnosi. In questo scenario, un drenaggio pericardico controllato dell’emopericardio con evacuazione di minime quantità di liquido viene
consigliato per stabilizzare temporaneamente il paziente permettendogli di mantenere una pressione di circa 90 mmHg187.
5.7 Coinvolgimento del pericardio nella malattia
neoplastica
La diagnosi differenziale fra patologia del pericardio di natura
neoplastica e le altre forme di pericardite è importante, e generalmente è possibile grazie a tecniche di imaging, come la
TC, all’esame citologico su liquido pericardico, eventualmente
alla biopsia. I tumori primitivi del pericardio sono molto rari188,189, e vengono classificati in tumori di origine benigna (lipoma e fibroma) o maligna (mesotelioma, angiosarcoma, fibrosarcoma). Il tumore maligno più frequente è il mesotelioma, quasi sempre incurabile. Il coinvolgimento metastatico del
pericardio è più frequente in presenza di neoplasia del polmone, della mammella, nel melanoma, nei linfomi e nelle leucemie. I versamenti pericardici di origine neoplastica possono essere di lieve, moderata o grave entità; possono portare ad un
quadro di tamponamento cardiaco imminente (con frequenti
recidive) o costrizione. Il riscontro di versamento pericardico
può essere la spia di una patologia oncologica misconosciuta190. La diagnosi si basa sulla conferma dell’infiltrazione maligna del pericardio188,189. Da segnalare, come, in quasi due terzi dei pazienti con neoplasia documentata, il riscontro di versamento pericardico può essere causato da altre condizioni patologiche non maligne, ad esempio, pericardite da radiazioni,
da altre terapie, o infezioni opportunistiche189. La radiografia
del torace, la TC, la PET e la RMC possono rivelare un allargamento patologico del mediastino, espansi della regione ilare,
versamento pleurico. L’analisi citologica del liquido pericardico
e la biopsia del pericardio o epicardio sono essenziali per la conferma della malattia neoplastica del pericardio188-191.
L’utilità, a fini diagnostici, di ricercare i marcatori tumorali
nel liquido pericardico rimane tuttora controversa: il dosaggio
di antigene carcino-embrionario (CEA), CYFRA 21-1, enolasi
neurone-specifica (NSE), CA-19-9, CA-72-4, SCC, GATA3, e
VEGF può essere utile, ma nessuno dei marcatori tumorali ha
dimostrato una sufficiente accuratezza nel distinguere un coinvolgimento neoplastico del pericardio dal versamento di natura benigna192,193. La mutazione del recettore del fattore di crescita dell’epidermide (EGFR) deve essere valutata in pazienti con
versamento pericardico maligno secondario ad adenocarcinoma polmonare194 al fine di definirne il trattamento.
Il trattamento del tamponamento cardiaco è la pericardiocentesi (indicazione di classe I). In caso di versamento pericardico esteso di origine neoplastica in assenza di tamponamento è indicato: (a) il trattamento chemioterapico antineoplastico
come terapia di base189, (b) la pericardiocentesi per alleviare i
sintomi e stabilire la diagnosi, (c) l’instillazione intrapericardica
di farmaci citostatici/sclerosanti per evitare recidive. Il drenaggio pericardico è raccomandato in tutti i pazienti con versamento pericardico di entità grave, a causa dell’alto tasso di recidiva (40-70%)193-196. La prevenzione delle recidive può essere ottenuta mediante instillazione intrapericardica di agente
sclerosante e agenti citotossici197-204. Tale trattamento deve essere però adattato alla tipologia del tumore: il cisplatino si è dimostrato più efficace in caso di tumore polmonare200,204; la
thiotepa in casi di coinvolgimento neoplastico del pericardio da
Raccomandazioni per la diagnosi e la gestione del coinvolgimento neoplastico del pericardio
Classea
Livellob
La pericardiocentesi è raccomandata
nel tamponamento cardiaco per
alleviare i sintomi e per la diagnosi
di versamento pericardico di natura
neoplastica.
I
B
Le analisi citologiche del liquido
pericardico sono raccomandate per
confermare la natura maligna della
malattia pericardica.
I
B
La biopsia pericardica o epicardica deve
essere presa in considerazione per
confermare l’origine neoplastica della
malattia pericardica.
IIa
B
La ricerca dei marcatori tumorali nel
liquido pericardico deve essere presa
in considerazione per distinguere il
versamento di natura maligna
dalle forme benigne.
IIa
B
Il trattamento chemioterapico sistemico è
raccomandato nei casi confermati di
origine neoplastica.
I
B
Il mantenimento del drenaggio pericardico
è raccomandato nei pazienti con
versamento pericardico sospetto o
di origine neoplastica al fine di prevenire
le recidive e favorire una terapia
intrapericardica.
I
B
L’instillazione intrapericardica di agenti
citostatici/sclerosanti deve essere presa
in considerazione in quanto può
prevenire le recidive in pazienti
con versamento pericardico maligno.
IIa
B
197-204
L’instillazione intrapericardica di cisplatino
deve essere presa in considerazione nel
coinvolgimento neoplastico del
pericardio da neoplasia polmonare.
L’instillazione intrapericardica
di thiotepa deve essere presa in
considerazione in presenza di
metastasi del pericardio da neoplasia
della mammella.
IIa
B
197,198,
200,204
La radioterapia deve essere presa in
considerazione per controllare il
versamento pericardico di natura
neoplastica in pazienti con tumori
radiosensibili, come linfomi e leucemie.
IIa
B
La pericardiotomia deve essere presa in
considerazione quando la
pericardiocentesi non può essere eseguita.
IIa
B
IIb
B
La creazione della finestra pericardica per
via minitoracotomica sinistra può essere
presa in considerazione come opzione
chirurgica nel tamponamento cardiaco
di origine neoplastica.
IIb
B
In caso di procedure interventistiche deve
essere sempre presa in considerazione
il rischio di disseminazione delle cellule
neoplastiche, la prognosi e la qualità
complessiva di vita del paziente.
IIa
C
Raccomandazioni
La pericardiotomia percutanea con
palloncino può essere presa in
considerazione per la prevenzione delle
recidive dei versamenti pericardici di
origine neoplastica.
Ref.c
191
193
205
207
a
classe della raccomandazione.
di evidenza.
creferenza bibliografica a supporto delle raccomandazioni.
blivello
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
731
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
tumore della mammella197,198. L’utilizzo delle tetracicline come
agenti sclerosanti può portare ad una stabilizzazione del versamento pericardico in circa l’85% dei casi, ma tale trattamento
è gravato da numerosi effetti collaterali e le complicanze sono
abbastanza frequenti: febbre (19%), dolore toracico (20%) e
aritmie atriali (10%)189,199. La radioterapia è molto efficace
(93%) nel controllo del versamento pericardico in pazienti con
tumori radiosensibili, come linfomi e leucemie, ma la radioterapia effettuata sul cuore non è scevra da effetti collaterali o
complicanze, quali miocardite e pericardite189. La pericardiotomia è indicata quando non può essere effettuata la pericardiocentesi205 e può essere eseguita in anestesia locale, ma tale procedura può essere gravata da complicanze serie, quali la lacerazione del miocardio, il pneumotorace, fino all’exitus189,205. La
pericardiotomia chirurgica, se confrontata alla pericardiocentesi, non migliora gli esiti clinici, ed è associata ad una incidenza più elevata di complicanze202. La pleuropericardiotomia permette il drenaggio del liquido pericardico nello spazio pleurico.
Rispetto alla pericardiocentesi o alla pericardiotomia è associata ad una incidenza più alta di complicanze e non offre alcun
vantaggio. La pericardiectomia è indicata in rari casi, soprattutto in presenza di costrizione pericardica o complicanze legate alle precedenti procedure189. La pericardiotomia percutanea con palloncino crea una comunicazione diretta pleuropericardica, che permette il drenaggio del liquido nello spazio
pleurico: tale procedura si è dimostrata efficace (90-97%) e sicura204 sia in casi di versamento pericardico di entità severa, sia
in presenza di tamponamento cardiaco ricorrente. Una procedura altrettanto sicura ed efficace nel trattamento chirurgico
del tamponamento cardiaco da versamento pericardico neoplastico è la creazione di una finestra nel pericardio per via minitoracotomica sinistra205. Nella pratica clinica, tale approccio,
viene riservato alla gestione con finalità palliative degli stadi
avanzati di malattia, allo scopo di dare sollievo e migliorare la
qualità di vita dei pazienti piuttosto che al trattamento della
malattia di base206.
5.8 Altre forme di malattia del pericardio
5.8.1 Pericardite da radiazioni
La pregressa esposizione del torace a radiazioni è una causa
importante di malattia del pericardio. Le forme più frequenti di
pericarditi da radiazioni sono quelle secondarie a pregressi trattamenti radioterapici per il linfoma di Hodgkin, il tumore della
mammella o del polmone. I casi di pericardite secondaria a trattamento radioterapico del linfoma di Hodgkin, inizialmente più
gravi e frequenti, hanno avuto un calo significativo in termini di
severità ed incidenza (dal 20% al 2.5%)208, grazie all’utilizzo di
tecniche di radioterapia sempre più moderne (schermatura e
calcolo della dose) ed a dosi più basse. Meno frequentemente
l’esposizione a radiazioni può causare altre patologie (es. cancro esofageo), o può essere associata ad incidenti nucleari. Il
paziente può sviluppare una pericardite acuta con o senza versamento subito dopo l’esposizione alla radiazione208. Più frequente è invece un’insorgenza tardiva della malattia del pericardico, stimata fino al 20% dei pazienti entro 2 anni dopo irradiazione209, con una latenza fino a 15-20 anni, e non è necessariamente preceduta da pericardite acuta210. La malattia
tardiva del pericardio può presentarsi come pericardite effusivocostrittiva o pericardite costrittiva classica (4-20% dei pazienti);
sembra essere dose-dipendente ed è correlata alla presenza di
versamento pericardico nella fase acuta tardiva209. In alternati-
732
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
va, i danni da radiazioni del pericardio possono portare ad un
versamento pericardico di entità severa, con o senza tamponamento. Il versamento può essere sieroso o emorragico, con elevata probabilità di sviluppare aderenze fibrose. La terapia di
queste malattie del pericardico è simile a quanto riservato alle
altre tipologie di pericardite e di versamento. Il trattamento radioterapico a scopo terapeutico può causare anche altri tipi di
danno cardiaco. Il più grave è la cardiomiopatia, ma il danno
può interessare anche il circolo coronarico e le valvole cardiache. Questo spiega perché la pericardiectomia per patologie
del pericardio indotte da radiazioni è associata ad un outcome
peggiore rispetto a quella praticata per pericardite costrittiva
secondaria ad altre cause.
Raccomandazioni per la prevenzione e la gestione delle pericarditi da radiazioni
Raccomandazioni
Classea Livellob
Quando possibile, sono raccomandati i
trattamenti radioterapici che limitano il
volume irradiato e la dose di irradiazione
a livello cardiaco.
I
C
La pericardiectomia deve essere presa in
considerazione per la pericardite costrittiva
indotta da radiazioni, anche se gli esiti
post-procedura sono peggiori rispetto a
quando effettuata per la pericardite
costrittiva secondaria ad altre cause, in
ragione della coesistente cardiomiopatia.
IIa
B
a
Ref.c
91,92,
103,106
classe della raccomandazione.
di evidenza.
bibliografica a supporto delle raccomandazioni.
blivello
creferenza
5.8.2 Chilopericardio
Il chilopericardio è un versamento pericardico composto da chilo, il normale contenuto dei vasi linfatici. È un disordine raro
che può essere primitivo, o più spesso, secondario a lesioni del
dotto toracico, che trasporta il chilo dal tratto intestinale al sangue alla giunzione della vena giugulare interna sinistra e succlavia sinistra211. È spesso associato a chilotorace. Le complicanze cardiache sono il tamponamento cardiaco, la pericardite
acuta e la costrizione cronica. Le cause di chilopericardio più
frequenti sono: traumi, interventi chirurgici (in particolare per le
malattie cardiache congenite), linfangiomatosi congenita, radioterapia, trombosi della vena succlavia, infezione (tubercolosi), neoplasie mediastiniche e pancreatite acuta212-214. Il chilopericardio di origine primitiva è meno comune e sostanzialmente la diagnosi è per esclusione. La TC con e senza mezzo
di contrasto o combinata con linfangiografia/linfoscintigrafia
(eseguita raramente) sono le metodiche da utilizzare per identificare lesioni o ostruzione del dotto toracico.
Il chilopericardio non deve essere confuso con la pericardite da colesterolo che presenta un liquido chiaro, con cristalli di
colesterolo; di solito è secondaria a pericardite tubercolare, pericardite reumatoide e traumi. La concentrazione di colesterolo del liquido pericardico è uguale o superiore a quanto riscontrato nel sangue. La pericardiocentesi è raramente efficace e la
pericardiectomia radicale associata al trattamento della causa
sottostante rappresenta la terapia ottimale215,216.
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
Raccomandazioni per la diagnosi e la gestione del chilopericardio
Raccomandazioni
Il chilopericardio viene diagnosticato in
presenza di versamento pericardico di
aspetto opalescente e lattiginoso, con
un livello di trigliceridi >500 mg/dl,
rapporto colesterolo/trigliceridi <1, esami
colturali negativi e predominanza di
linfociti (conta dei linfociti tra poche
centinaia a diverse migliaia per millilitro).
Classea Livellob
I
Ref.c
C
Il drenaggio pericardico e la nutrizione
parenterale devono essere presi in
considerazione nel versamento pericardico
sintomatico o di entità severa non controllato
dovuto a chilopericardio.
IIa
C
La terapia chirurgica deve essere presa in
considerazione in caso di chilopericardio
quando la terapia conservativa non è
efficace nel ridurre l’entità del versamento
e quando viene identificato il decorso
del dotto toracico.
IIa
C
La terapia con octreotide (100 μg s.c. x 3/die
per 2 settimane) può essere presa in
considerazione in caso di chilopericardio
(si presume che il farmaco agisca
riducendo la produzione del chilo).
IIb
C
s.c., per via sottocutanea.
classe della raccomandazione.
b
livello di evidenza.
c
referenza bibliografica a supporto delle raccomandazioni.
a
5.8.3 Pericardite e versamento pericardico correlati
ai farmaci
Le malattie del pericardio secondarie all’esposizione a medicamenti sono rare (Tabella 1). Il danno pericardico è stato anche
associato all’inalazione di fumi di polimeri, alla “malattia da siero” da emoderivati o antisieri non autologhi, a veleni (scorpione, pesci), reazione da corpo estraneo per applicazione diretta
dell’agente irritante sul pericardio (es. talco, silicato di magnesio), siliconi, tetracicline, sclerosanti, amianto e ferro (β-talassemia)1. La gestione di queste malattie del pericardio si basa
nel bloccare l’esposizione all’agente eziologico e al trattamento sintomatico.
L’uso di eparina e farmaci anticoagulanti è spesso percepito come possibile fattore di rischio nel favorire l’insorgenza o progressione del versamento pericardico in senso emorragico fino al tamponamento cardiaco, ma un’analisi multivariata di quasi 500 casi consecutivi di pericardite acuta non
ha confermato tale associazione9. Allo stesso modo, in un
altro studio condotto su 274 pazienti affetti da pericardite
acuta o miopericardite, l’uso di eparina o altri anticoagulanti non è stato associato ad un aumentato rischio di tamponamento cardiaco7. In presenza di versamento pericardico di
natura iatrogena, la terapia anticoagulante può invece essere un fattore di rischio per tamponamento e possibili complicanze127.
5.8.4 Versamento pericardico nelle malattie
del metabolismo e del sistema endocrino
Tra le patologie del sistema endocrino, l’ipotiroidismo rappresenta la causa che più frequentemente può presentare un coinvolgimento del pericardio. Il versamento pericardico può verificarsi in circa il 5-30% dei pazienti con ipotiroidismo, anche se
al riguardo vi sono pochi dati recenti in letteratura218,219. Il versamento può essere di entità severa, ma il tamponamento si
verifica raramente. L’ipotiroidismo viene diagnosticato da un
elevato livello sierico di ormone tireotropo (TSH) e clinicamente è caratterizzato da bradicardia e basso voltaggio del complesso QRS all’ECG.
5.8.5 Coinvolgimento pericardico nell’ipertensione
arteriosa polmonare
Il versamento pericardico nel contesto dell’ipertensione arteriosa polmonare (PAH) è comune (25-30%). In genere è di lieve entità, raramente può causare compromissione emodinamica. L’insorgenza del versamento pericardico nella PAH sembra
essere secondario all’insufficienza ventricolare destra e al conseguente aumento delle pressioni di riempimento delle cavità
cardiache destre, all’insorgenza di ipertensione atriale e aumento della pressione nelle vene di tebesio e del seno coronarico. Questi processi comportano anche una maggiore filtrazione e ostruzione linfatica e conseguente comparsa di versamento pericardico220.
La diagnosi di tamponamento cardiaco in un paziente con
grave PAH rappresenta ancora una sfida. Determinare il significato emodinamico del versamento pericardico nella PAH richiede una maggiore attenzione perché le alte pressioni delle
cavità cardiache di destra possono mascherare molti dei tipici
segni clinici ed ecocardiografici di tamponamento. Vi è un incremento delle pressioni delle camere cardiache di destra e
non è comune la riduzione pressoria nella cavità destra. Al
contrario, la pressione atriale sinistra è tipicamente inferiore
nella PAH e quindi è più evidente il collasso diastolico precoce dell’atrio sinistro. Possono essere anche presenti elevata interdipendenza ventricolare, così come una diminuzione del
riempimento del ventricolo sinistro nella fase iniziale dell’inspirazione.
La presenza di versamento pericardico è correlata con la
malattia del tessuto connettivo, ridotto test del cammino dei 6
min e ad alti valori di peptide natriuretico cerebrale. Anche una
piccola quantità di liquido pericardico in un paziente con PAH
è indicativa di una prognosi sfavorevole. Il versamento pericardico nella PAH sembra infatti essere un marcatore di comorbilità, quali malattia del tessuto connettivo o alta pressione venosa; se presenti, questi due fattori comportano una prognosi
peggiore220.
5.8.6 Cisti pericardiche
Le cisti pericardiche sono rare anomalie mediastiniche, hanno
una incidenza di 1 su 100 000 pazienti131,221 ed alla radiografia del torace, quando presenti, vengono descritte come diverticoli o formazioni cistiche. Esse rappresentano il 6% delle
masse mediastiniche e il 33% delle cisti mediastiniche. Devono essere distinte dalle altre formazioni cistiche che possono
essere riscontrate nel mediastino, come le cisti di origine broncogena (34%), enterica (12%), del timo o di altre sedi
(21%)131,221. Le cisti pericardiche si trovano spesso in uno degli angoli cardiofrenici131,206,221. A differenza dei diverticoli, le
cisti di norma non comunicano con lo spazio pericardico. Le cisti possono essere uni- o multi-loculate. Le cisti infiammatorie
comprendono le pseudocisti ed i versamenti pericardici incapsulati o saccati, causati da malattie reumatiche, infezioni batteriche, traumi o interventi chirurgici cardiaci. Le cisti da echinococco di solito originano dalla rottura di cisti idatidee del fegato e dei polmoni. La diagnosi differenziale comprende il verG ITAL CARDIOL | VOL 16 | DICEMBRE 2015
733
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
samento pericardico saccato di origine sconosciuta e le masse
del pericardio di natura neoplastica. Il procedimento diagnostico include l’ecocardiografia, la TC ed eventualmente la RMC
al fine di definirne le dimensioni, la densità ed i rapporti con
le strutture circostanti131,221. Le cisti pericardiche sono per lo
più asintomatiche e vengono diagnosticate accidentalmente;
in casi minori possono provocare dolore toracico, dispnea o
cardiopalmo, per effetto della compressione esercitata a livello cardiaco. Il trattamento iniziale delle cisti sintomatiche congenite e infiammatorie consiste nell’aspirazione percutanea206,222 eventualmente con sclerosi etanolica222. Se la diagnosi non è ben definita dalle indagini strumentali o se la cisti
si riforma dopo il drenaggio percutaneo, può essere necessaria la resezione chirurgica. Per le cisti da echinococco è stata
proposta l’aspirazione percutanea e l’instillazione di etanolo o
nitrato d’argento dopo pretrattamento con albendazolo (800
mg/die per 4 settimane)1.
6. ASPETTI CORRELATI ALL’ETÀ E AL SESSO
NELLE MALATTIE DEL PERICARDIO
6.1 Età pediatrica
La pericardite è presente in circa il 5% dei bambini che si presentano con dolore toracico al pronto soccorso pediatrico223. I
bambini possono essere colpiti dalle stesse sindromi che colpiscono gli adulti17. I criteri diagnostici sono gli stessi e il rischio
di recidiva è simile (15-30%). L’eziologia è simile a quella degli
adulti, con maggiore frequenza di PPS, secondaria in particolare ad interventi di correzione del difetto interatriale18. Rispetto
agli adulti, i bambini hanno spesso un quadro clinico infiam-
Raccomandazioni per la terapia della pericardite acuta e ricorrente nei bambini
Raccomandazioni
Classea Livellob
I FANS somministrati ad alte dosi sono
raccomandati come terapia di prima linea
per la pericardite acuta nei bambini, fino
a completa risoluzione dei sintomi (vedi
Tabella 9 online per i dosaggi).
I
C
La colchicina deve essere presa in
considerazione come trattamento
aggiuntivo alla terapia con FANS in caso
di pericardite acuta recidivante anche nei
bambini, a basso dosaggio: <5 anni:
0.5 mg /die; >5 anni: 1.0-1.5 mg/die
in due-tre somministrazioni.
IIa
C
I farmaci anti-IL1 possono essere presi in
considerazione nei bambini con pericardite
acuta recidivante, in particolare nelle
pericarditi corticosteroide-dipendenti.
IIb
C
L’aspirina non è raccomandata nei bambini
a causa del rischio associato di sindrome
di Reye e di epatotossicità.
III
C
I corticosteroidi non sono raccomandati a
causa della gravità dei loro effetti collaterali,
in particolare nei bambini in fase di
accrescimento, a meno che non vi siano
indicazioni specifiche, come le malattie
autoimmuni.
III
C
FANS, farmaci antinfiammatori non steroidei; IL, interleuchina.
classe della raccomandazione.
b
livello di evidenza.
c
referenza bibliografica a supporto delle raccomandazioni.
a
734
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
Ref.c
matorio più marcato, con febbre, coinvolgimento pleuropolmonare, PCR elevata, e meno frequente ANA-positività. Ciò
può implicare l’attivazione di vie infiammatorie con liberazione
di IL-119.
Nessuno studio randomizzato controllato è stato finora eseguito nei bambini. I FANS rimangono il trattamento di scelta, e
devono essere somministrati a dosi elevate (Tabella 7 online). La
maggior parte dei pediatri preferiscono evitare l’uso dell’aspirina. La colchicina è efficace e riduce della metà il numero delle recidive19). L’impiego di corticosteroidi deve essere limitato
nei bambini ancora di più che negli adulti, a causa degli effetti collaterali (strie rubre e ritardo di crescita), che sono più deleteri in ambito pediatrico; pertanto, i corticosteroidei devono
essere somministrati alla dose minima efficace. In ambito pediatrico, la severa restrizione all’attività fisica è una condizione
fastidiosa per i bambini e può peggiorare ulteriormente la qualità di vita degli stessi e quella della famiglia. L’anakinra (recettore anti-IL-1) è una nuova opzione terapeutica in ambito pediatrico, soprattutto nei casi di pericardite corticosteroide-dipendente20-23.
La prognosi a lungo termine delle malattie del pericardio
nei bambini è buona; tuttavia, la qualità della vita può essere
seriamente compromessa a causa delle ripetute recidive, della
dipendenza ai glucocorticoidi e grave restrizione fisica19.
6.2 Gravidanza, allattamento e questioni relative
alla funzione riproduttiva
La forma più comune di coinvolgimento pericardico in gravidanza è l’idropericardio, di solito come un versamento lieve benigno dal terzo trimestre, che si riscontra in circa il 40% delle
donne, spesso occasionalmente. Il versamento è di solito asintomatico e l’esame clinico e l’ECG sono generalmente normali. In alcuni casi si sono documentati una pressione arteriosa lievemente elevata e/o alterazioni aspecifiche del tratto ST-T24,25.
La malattia più comune che richiede una terapia medica è la
pericardite acuta; la diagnosi è effettuata utilizzando i criteri
abituali. Nessuna eziologia specifica è di solito identificata. Al
giorno d’oggi gli outcome delle gravidanze in queste donne,
quando seguite da gruppi multidisciplinari dedicati, sono simili a quelli attesi nella popolazione generale25.
Uno schema di trattamento proposto per la pericardite durante la gravidanza è descritto nella Tabella 8 online25-27. La
gravidanza nelle donne con pericardite recidivante deve essere pianificata in una fase di quiescenza di malattia25-27. I FANS
classici (ibuprofene, indometacina) possono essere considerati durante il primo e il secondo trimestre25-27; la maggior parte degli esperti preferisce le alte dosi di aspirina, dal momento che essa è regolarmente utilizzata nella sindrome da anticorpi antifosfolipidi in gravidanza ed è moderatamente efficace nella prevenzione della preeclampsia nelle pazienti ostetriche ad alto rischio224,225. Dopo la ventesima settimana gestazionale, tutti i FANS (eccetto l’aspirina a dosi ≤100 mg/die) possono causare costrizione del dotto arterioso e compromettere
la funzione renale fetale e devono essere sospesi in ogni caso
alla trentaduesima settimana gestazionale224,225. La dose più
bassa efficace di prednisone può essere utilizzata durante la
gravidanza e l’allattamento al seno (con la supplementazione
di calcio e vitamina D)25-27. Il paracetamolo è consentito durante la gravidanza e l’allattamento al seno, così come lo sono gli antistaminici anti-H2 o gli inibitori di pompa protonica226. Durante la gravidanza, la riduzione dei dosaggi delle te-
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
rapie dovrebbe essere estremamente cauta. Il parto vaginale
normale è possibile e deve essere considerato in assenza di
controindicazioni25-27. Ibuprofene, indometacina, naprossene e
prednisone possono essere considerati in donne che allattano.
Dopo l’interruzione dell’allattamento al seno, dovrebbe essere pensato una graduale riduzione del dosaggio del prednisone, eventualmente con ripresa della colchicina. La colchicina è
considerata controindicata durante la gravidanza e l’allattamento, anche se nessun evento avverso è stato riportato durante la gravidanza o sullo sviluppo fetale e del bambino in
donne con FMF trattate con colchicina durante la gravidanza
e l’allattamento227-229.
6.3 Paziente anziano
Nella maggior parte delle linee guida non è stata discussa
l’applicabilità delle raccomandazioni nei pazienti anziani con
comorbilità multiple230. Nessuna pubblicazione si è specificamente indirizzata alle malattie del pericardio negli anziani ed esistono quindi solo pareri di esperti. L’aderenza alla
terapia e la compliance possono essere problematiche negli
anziani a causa di decadimento cognitivo, ipovisione, ipoacusia e i costi delle terapie stesse, ma il più forte predittore di non adesione alla terapia è il numero di farmaci da assumere230. L’indometacina non è indicata, la dose di colchicina deve essere dimezzata e particolare attenzione deve essere data alla valutazione di insufficienza renale e interazioni tra farmaci.
7. TECNICHE INTERVENTISTICHE E CHIRURGIA
L’eziologia delle malattie del pericardio rimane ignota in molti
casi, perché non tutte le strutture hanno a disposizione tutti i
possibili strumenti diagnostici. Il “gold standard” rimane chirurgico attraverso l’approccio sottoxifoideo, permettendo così
la raccolta di campioni di liquidi, la biopsia e il drenaggio pericardico. Le tecniche interventistiche206 comprendono l’uso
combinato di tecniche di imaging attraverso la pericardioscopia
in combinazione con metodi diagnostici molecolari, istologici
e immunoistologici per valutare l’eziologia e la patogenesi delle malattie del pericardico e dell’epicardio133 e la possibilità di
intervenire terapeuticamente mediante instillazione di farmaci
nel sacco pericardico63,204.
7.1. Pericardiocentesi e drenaggio pericardico
Per il drenaggio pericardico e la biopsia, l’approccio chirurgico
rimane il “gold standard”. L’approccio classico è attraverso
un’incisione sottoxifoidea. In questo modo, è facile prelevare
campioni di liquido e eseguire una biopsia pericardica. L’operazione è completata lasciando posto in sede un piccolo drenaggio per evacuare il restante versamento. Questa tecnica che
utilizza un approccio sottoxifoideo è semplice per un team di
specialisti quali il chirurgo toracico o il cardiochirurgo, e se
l’équipe chirurgica lavora a stretto contatto con il team cardiologico. Nella pratica clinica, il liquido pericardico è spesso aspirato tramite la pericardiocentesi.
La pericardiocentesi deve essere guidata mediante fluoroscopia o ecocardiografia206 in anestesia locale. Non devono essere praticate procedure alla cieca per evitare il rischio di lacerazione del cuore o di altri organi, tranne che in situazioni molto rare di immediato pericolo di vita per il paziente. Un team
esperto deve effettuare la pericardiocentesi in una struttura attrezzata che permetta il monitoraggio radiografico, ecocardiografico, emodinamico ed ECG.
Per la pericardiocentesi eco-guidata, l’accesso ideale è il
punto sulla superficie del corpo in cui il versamento è più vicino al trasduttore e la raccolta di liquido è massima. La traiettoria dell’ago è definita dall’angolazione del trasduttore
portatile e deve evitare strutture vitali come il fegato, il miocardio, il polmone e l’arteria mammaria interna (3-5 cm di
distanza dalla linea parasternale) e il fascio vascolare al margine inferiore di ogni costola. Il punto d’inserzione previsto
è segnato sulla pelle e la direzione del fascio di ultrasuoni è
accuratamente annotata (vedi materiale supplementare online). Un’altra tecnica è l’approccio eco-guidato della procedura seguito dal monitoraggio ecocardiografico della procedura.
Per le pericardiocentesi guidate fluoroscopicamente, un ago
rivestito di polytef, con una siringa riempita di soluzione salina,
è avanzato sotto moderata aspirazione fino a quando viene
raggiunto il sacco pericardico206. Quando si utilizza il percorso
più comune sottoxifoideo per la pericardiocentesi, un ago introduttore Tuohy-17 a punta smussata è avanzato verso la spalla sinistra, con un’inclinazione di 30 gradi, evitando così le arterie coronarie, pericardiche e mammarie interne. Il punto di
vista angiografico laterale fornisce la migliore visualizzazione
dell’ago e la sua relazione con il diaframma e il pericardio. L’ago
è avvicinato lentamente in direzione dell’ombra cardiaca e dell’alone epicardico, sotto moderata aspirazione e con l’iniezione
di piccole quantità di mezzo di contrasto diluito fino a quando
il fluido pericardico viene aspirato. Se viene liberamente aspirato del liquido emorragico, pochi millilitri di mezzo di contrasto possono essere iniettati sotto guida fluoroscopica per verificare la corretta posizione dell’ago. Un morbido filo guida a
punta J è quindi introdotto e dopo la dilatazione è scambiato
con un catetere “pigtail” multi-foro, attraverso il quale l’evacuazione del fluido avviene monitorando la pressione intrapericardica206.
La pericardiocentesi deve essere eseguita da operatori
esperti e comporta un rischio di complicanze variabile intorno
al 4-10% a seconda del tipo di monitoraggio, delle competenze dell’operatore e della situazione (emergenza rispetto a urgenza o elezione)183,206. Le complicanze più comuni comprendono le aritmie, la puntura delle arterie coronarie o delle camere cardiache, l’emotorace, il pneumotorace, il pneumopericardio e il danno epatico (Tabella 9 online).
La pericardiocentesi può avere dei limiti o pericoli addizionali quando il versamento pericardico non è libero o quando è
localizzato in sede laterale o posteriore, oppure è di dimensioni <10 mm. In questi casi, un approccio chirurgico potrebbe essere più sicuro, sempre secondo le competenze locali e della
disponibilità.
7.2 Pericardioscopia
La pericardioscopia permette la visualizzazione del sacco pericardico con il suo epicardio e i foglietti pericardici. La visione
macroscopica mostra protrusioni, aree emorragiche e di neovascolarizzazione in caso di versamenti pericardici maligni, che
spesso sono emorragici, al contrario dei versamenti di altra natura (virali o autoimmuni)133,206.
La pericardioscopia consente al medico che la esegue di
effettuare biopsie mirate dell’epicardio e del pericardio, eviG ITAL CARDIOL | VOL 16 | DICEMBRE 2015
735
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
tando i vasi epicardici e consentendo di aumentare la probabilità di ottenere diagnosi specifiche di malattia. Per ragioni di
sicurezza, è importante avere un secondo filo in sede. Il filo di
sicurezza permette un rapido scambio con un catetere “pigtail” e consente l’autotrasfusione in caso di sanguinamento rilevante. Scegliendo il sito di biopsia possono essere evitate
aree bianche di fibrina meno rilevanti e invece essere selezionate macchie scure di infiammazione, malignità o aree di imbibizione emorragica, che possono essere identificate meglio
in modalità luce blu. La biopsia pericardica può anche essere
fatta sotto il solo controllo radiologico. Le fauci aperte del biotomo sono avanzate delicatamente fino a raggiungere la silhouette del sacco pericardico. Vengono quindi chiuse per prelevare il campione bioptico. Sarebbe opportuno prelevare da 7
a 10 campioni per ridurre l’errore di campionamento. La migliore resa diagnostica dalle biopsie pericardiche può essere
ottenuta tramite acquisizioni multiple di tessuto guidate pericardioscopicamente.
Questa tecnica è piuttosto difficoltosa ed è possibile effettuarla solo in un numero limitato di centri di riferimento di terzo livello esperti. La pericardioscopia può essere considerata come un metodo diagnostico per l’ispezione del pericardio e dell’epicardio in centri con esperienza. Essa permette l’acquisizione sicura del tessuto pericardico in malattie di origine ignota.
7.3 Analisi del liquido pericardico,
biopsia del pericardico e dell’epicardio
Versamenti sieroematici o emorragici possono essere rilevati in
condizioni maligne, così come dopo una pericardiotomia o in
caso di patologie reumatologiche o post-traumatiche oppure
possono essere causati da lesioni iatrogene durante la pericardiocentesi ma anche in forme idiopatiche o in forme virali. Nei casi di sepsi, tubercolosi o in pazienti HIV-positivi le colture batteriche possono essere diagnostiche. L’esame citologico su liquido pericardico può discriminare tra versamenti
maligni e non maligni, il che è importante per i versamenti in
pazienti oncologici dopo radioterapia del mediastino. Il discriminante tra effusioni maligne e reattive è il più elevato livello di marcatori tumorali nei versamenti pericardici neoplastici133,206.
La citologia, la valutazione delle colture batteriche del liquido pericardico e l’esame immunoistologico/istologico dei reperti bioptici e le analisi molecolari (reazione polimerasica a catena per agenti microbici di fluidi e tessuti) permettono una
diagnosi eziologica definitiva in molti casi, il che consente un ulteriore trattamento133.
7.4 Trattamento intrapericardico
Nei pazienti con un versamento di entità severa di origine sconosciuta, il drenaggio pericardico prolungato può permettere
un successivo trattamento intrapericardico. In caso di versamento pericardico neoplastico, più frequentemente causato da
carcinoma bronchiale o cancro della mammella, terapie con
iniezione intrapericardica di cisplatino o thiothepa sono state
proposte in combinazione con il trattamento antineoplastico
sistemico, che deve essere stabilito in collaborazione con l’oncologo204.
Nei versamenti autoreattivi e linfocitari possono essere considerati trattamenti specifici con triamcinolone cristalloide intrapericardico (300 mg/m2 superficie corporea)64. Pericarditi virali possono essere escluse mediante reazione polimerasica a
736
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
catena su campioni di liquido e di tessuto, ma nella pratica clinica tali ricerche di solito non sono eseguite nei casi non complicati.
In caso di versamento pericardico uremico, la terapia intrapericardica con triamcinolone può essere presa in considerazione, oltre all’emodialisi o dialisi peritoneale intensificate e all’evacuazione del liquido64,65.
In rari casi di versamento ricorrente, la pericardiotomia a
palloncino è un’opzione che consente una finestra transitoria
pericardico-(pleuro)-addominale per il drenaggio. Questo approccio deve essere evitato in versamenti neoplastici o purulenti.
7.5 Accesso pericardico per elettrofisiologia
Riportato per la prima volta nel 1996231, l’accesso pericardico
è stato utilizzato per la mappatura e l’ablazione dei substrati
epicardici di tachiaritmie ventricolari con una maggiore probabilità di successo e di evitare un intervento chirurgico232,233 (si
veda materiale supplementare online e Tabella 9 online per le
complicanze della procedura).
7.6. La chirurgia per le malattie del pericardio
7.6.1 Finestra pericardica
Una finestra pericardica è una procedura chirurgica cardiaca
per creare una comunicazione o una “finestra” dallo spazio pericardico alla cavità pleurica. Lo scopo della finestra è quello di
consentire il drenaggio di un versamento pericardico (di solito
maligno) dallo spazio circostante il cuore alla cavità toracica in
modo da prevenire grandi versamenti pericardici e il tamponamento cardiaco.
La finestra è di solito eseguita da un cardiochirurgo, ma
può essere creata una finestra pericardica da toracoscopia video-assistita o da pericardiotomia a palloncino con un intervento percutaneo. L’indicazione principale è rappresentata
da grandi versamenti ricorrenti o da tamponamento cardiaco quando un’operazione più complessa come la pericardiectomia è ad alto rischio o l’aspettativa di vita dei pazienti
è ridotta (es. nella malattia pericardica neoplastica) e l’intervento è palliativo. I risultati di una finestra pericardica sono
meno definitivi, in quanto la comunicazione può chiudersi e
versamenti ricorrenti, soprattutto saccati, sono comuni e possono richiedere interventi supplementari rispetto alla pericardiectomia che è un’operazione più complessa ma completa105.
7.6.2 Pericardiectomia
Nella pericardite costrittiva il trattamento è la pericardiectomia.
Dovrebbe essere rimosso quanto più possibile del pericardio
con i foglietti costrittivi e l’epicardio, ma facendo attenzione a
preservare i nervi frenici bilateralmente103-105. L’accesso è possibile solo mediante sternotomia. Pertanto, la toracotomia sinistra antero-laterale deve essere evitata poiché consente solo
una resezione parziale.
È anche necessaria per liberare l’intero atrio destro, la vena
cava superiore e soprattutto la vena cava inferiore e la parte inferiore del ventricolo destro adiacente al diaframma, per quanto possibile103-105. Solo quando il foglietto costrittivo è aderente e calcificato, può essere necessario lasciare un paio di isole
di pericardio. Per evitare il sanguinamento, il bypass cardiopolmonare deve essere eseguito solo in casi di lesioni chirurgiche
cardiache coesistenti, ma esso può essere necessario come
LINEE GUIDA ESC PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO
stand-by, in caso di insorgenza di lesioni emorragiche durante
la procedura. Applicando questi principi, la controversia sul tipo di operazione (completa o radicale o solo pericardiectomia
anteriore) non è un problema. Nella pericardite costrittiva ricorrente, l’operazione deve essere ripetuta al più presto possibile, ideale sarebbe durante il primo anno postoperatorio. Rari
pazienti con pericardite recidivante possono anche beneficiare
della pericardiectomia33.
8. PROSPETTIVE E QUESTIONI IRRISOLTE
Nonostante una grande quantità di nuovi dati e i primi studi
clinici che consentono alla gestione clinica di essere sulla strada della medicina basata sull’evidenza, ci sono diverse questioni
che richiedono ulteriori ricerche e chiarimenti. Le principali questioni irrisolte riguardano:
1. Fisiopatologia e fattori di rischio per la pericardite recidivante: cosa è realmente la “pericardite idiopatica recidivante”?
2. Come è possibile prevenire la pericardite oltre che con la
colchicina?
3. La graduale riduzione del dosaggio dei farmaci è utile per
i pazienti con pericardite?
4. Qual è la migliore durata del trattamento per i pazienti con
malattie del pericardio?
5. Nuove e individualizzate terapie per le pericarditi ricorrenti refrattarie: sono davvero disponibili e utili?
6. La restrizione dell’esercizio fisico è davvero necessaria per
i pazienti con pericardite acuta e ricorrente?
7. Dato l’elevato rischio di pericardite costrittiva in pericardite infettiva (tubercolare e purulenta) e l’effetto promettente della fibrinolisi intrapericardica riportata in casi clinici e piccoli studi, la fibrinolisi intrapericardica nella pericardite essudativa è davvero sicura ed efficace? E quando dovrebbe essere presa in considerazione nella gestione clinica dei pazienti?
8. Quali interventi sono necessari per ridurre l’elevata mortalità delle pericarditi tubercolari trattate con farmaci antitubercolari?
9. Che cosa è in realtà la pericardite con miocardite?
10. Quali sono gli outcome a lungo termine dei pazienti con
miopericardite e perimiocardite?
11. Eziologia e fisiopatologia del versamento pericardico isolato: che cosa è il “versamento pericardico idiopatico”?
12. Sono necessari la diagnosi e il trattamento per tutti i casi
di versamento pericardico da moderato a grave?
13. Quali sono le indicazioni per le tecniche diagnostiche invasive e il loro rendimento diagnostico nella pratica clinica?
14. Qual è il ruolo, il valore e l’applicazione delle terapie intrapericardiche?
15. La pericardiectomia è davvero utile e indicata nei casi di
pericardite recidivante refrattaria?
16. Quali sono le cause e i fattori di rischio per la pericardite
costrittiva?
17. Qual è il momento migliore per le terapie chirurgiche nelle malattie del pericardio?
La ricerca di base e clinica in corso è giustificata e necessaria per affrontare tutti questi quesiti e fornire ulteriori strumenti
diagnostici e terapeutici per la gestione individualizzata di ciascun paziente e per migliorare la prognosi.
9. COSA FARE E COSA NON FARE: MESSAGGI DALLE
LINEE GUIDA SULLE MALATTIE DEL PERICARDIO
Classea Livellob
Gestione della pericardite acuta e ricorrente
Il ricovero ospedaliero è raccomandato per i pazienti
ad alto rischioc con pericardite acuta.
I
B
L’uso della colchicina (0.5 mg bid o 0.5 mg/die nei
pazienti con peso <70 kg o intolleranti ai dosaggi
più elevati) è raccomandato come terapia di prima
linea per la pericardite acuta in aggiunta alla terapia
con aspirina/FANS (3 mesi) e per le pericarditi
ricorrenti (6 mesi).
I
A
I corticosteroidi non sono raccomandati come terapia
di prima linea per la pericardite acuta.
III
C
Il dosaggio della PCR deve essere preso in
considerazione per guidare la durata del trattamento
e per valutare la risposta alla terapia.
IIa
C
La pericardiocentesi o la chirurgia cardiaca sono
indicate nei casi di tamponamento cardiaco o per
il versamento pericardico da moderato a grave
sintomatico, non responsivo alla terapia medica
e per il sospetto di eziologia batterica o neoplastica.
I
C
Si raccomanda il triage dei pazienti con versamento
pericardico (si veda Figura 3).
I
C
Si raccomanda di mirare la terapia del versamento
pericardico all’eziologia.
I
C
La TC e/o la RMC sono indicate come tecniche
di imaging di secondo livello (dopo la radiografia
del torace e l’ecocardiografia) per valutare
le calcificazioni (TC), lo spessore del pericardio, il
grado e l’estensione del coinvolgimento pericardico.
I
C
Il cateterismo cardiaco è indicato quando le tecniche
diagnostiche non invasive non consentono una
diagnosi definitiva di costrizione.
I
C
Il cardine del trattamento della pericardite costrittiva
cronica è la pericardiectomia.
I
C
In tutti i casi di sospetta malattia del pericardio,
una prima valutazione diagnostica è raccomandata
con auscultazione, ECG, ecocardiografia transtoracica,
radiografia del torace ed esami del sangue di routine,
comprensivi di marcatori di infiammazione (PCR, VES),
conta leucocitaria, funzionalità renale ed epatica e
enzimi miocardici (troponina, CK).
I
C
La TC e/o la RMC sono esami di secondo livello per il
procedimento diagnostico delle pericarditi.
I
C
Ulteriori test sono indicati nei pazienti ad alto rischioc
sulla base delle condizioni cliniche.
I
C
Nei pazienti che vivono in aree endemiche,
è raccomandata la terapia empirica antitubercolare
per il versamento pericardico essudativo, dopo avere
escluso le altre cause.
I
C
Nei pazienti che vivono in aree non endemiche, non è
raccomandata la terapia empirica antitubercolare
quando le indagini sistematiche non riescono a definire
una diagnosi di pericardite tubercolare.
III
C
La terapia standard antitubercolare della durata di
6 mesi è raccomandata per la prevenzione della
pericardite costrittiva tubercolare.
I
C
Raccomandazioni per la gestione
e la terapia del versamento pericardico
Raccomandazioni per la diagnosi e la terapia
della pericardite costrittiva
Raccomandazioni per il procedimento diagnostico
delle malattie del pericardio
Gestione della pericardite tubercolare
e del versamento
(continua)
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
737
TASK FORCE PER LA DIAGNOSI E IL TRATTAMENTO DELLE MALATTIE DEL PERICARDIO DELL’ESC
(segue)
10. ADDENDA ONLINE
Classea Livellob
La pericardiectomia è raccomandata se le condizioni
del paziente non migliorano o peggiorano dopo
4-8 settimane di terapia antitubercolare.
I
C
I
B
La biopsia pericardica o epicardica deve essere presa
in considerazione per la conferma di malattia
del pericardio neoplastica.
IIa
B
La ricerca dei marcatori tumorali deve essere presa in
considerazione per distinguere i versamenti di natura
maligna da quelli di natura benigna.
IIa
B
Il trattamento antineoplastico sistemico è raccomandato
nei casi confermati di eziologia neoplastica.
I
B
Il drenaggio pericardico esteso è raccomandato
nei pazienti con sospetto o definito versamento
neoplastico al fine di prevenire la recidiva del
versamento e infondere la terapia intrapericardica.
I
B
L’instillazione intrapericardica di agenti
citostatici/sclerosanti deve essere presa in
considerazione in quanto può prevenire le recidive
nei pazienti con versamento pericardico maligno.
IIa
B
Per le figure e le tabelle online si rimanda al documento
originale disponibile su http://www.escardio.org/static_file/
Escardio/Guidelines/Publications/PERICA/2015%20Percardial%
20Web%20Addenda-ehv318.pdf.
Gestione delle malattie del pericardio neoplastiche
Le analisi citologiche del liquido pericardico sono
raccomandate per la conferma di malattia del
pericardio neoplastica.
CK, creatina chinasi; ECG, elettrocardiogramma; FANS, farmaci antinfiammatori non steroidei; PCR, proteina C-reattiva; RMC, risonanza magnetica cardiaca; TC, tomografia computerizzata; VES, velocità di eritrosedimentazione.
aclasse della raccomandazione.
blivello di evidenza.
ccondizione in cui sia presente almeno uno dei seguenti fattori di rischio:
febbre elevata (>38°C), decorso subacuto senza un chiaro esordio improvviso, versamento pericardico esteso (spazio diastolico echo-free >20 mm),
tamponamento cardiaco, assenza di risposta alla terapia con FANS, miopericardite, immunodepressione, storia di trauma o terapia anticoagulante.
738
G ITAL CARDIOL | VOL 16 | DICEMBRE 2015
11. APPENDICE
Per l’appendice si rimanda al documento originale disponibile su
http://eurheartj.oxfordjournals.org/content/36/42/2921#sec-92.
12. BIBLIOGRAFIA
Per la bibliografia completa si rimanda al documento originale
disponibile su http://eurheartj.oxfordjournals.org/content/36/
42/2921.full-text.pdf.