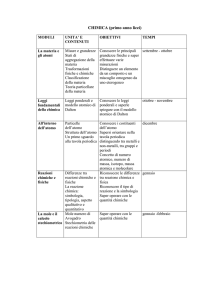
I.I.S.S. “ALESSANDRO VOLTA” - ROMA PROGRAMMA PREVENTIVO DI Chimica e Laboratro - CLASSE Seconda C
ANNO SCOLASTICO 2005 - 2006
MODULO n 1
TITOLO:IL PERINUCLEO: GUSCI
ELETTRONICI E VALENZA.
PREREQUISITI MODULO
Programma del primo anno
OBIETTIVI DEL MODULO
Completare l’esame dei modelli atomici.
Il modello a gusci come strumento adeguato per l’interpretazione dei
fenomeni chimici.
Evidenze sperimentali che hanno condotto alla conoscenza del modello a
gusci.
Concetto secondo il quale la conquista della conoscenza è un processo in
continuo divenire.
Conoscenze
(Sapere):
Competenze
(saper fare) su:
UNITÀ DIDATTICA
Interpretazione delle proprietà degli elementi sulla base del modello
atomico a gusci.
Riconoscimento di metalli mediante saggi alla fiamma.
N-0
La struttura dell’atomo
Contenuti
Indice
Particelle subatomiche
Disposizione spaziale delle particelle
Numero atomico
Peso atomuco
ORE TOTALI: 18
Descrizione
La scoperta dell’elettrone.
Il protone.
La scoperta della radioattività.
Modello planetario dell’atomo: nucleo e
perinucleo.
Il neutrone. Altre particelle subatomiche.
Numero atomico, numero di massa. Isotopi.
Massa atomica.
Qualità macroscopica e quantità microscopica.
La mole. Massa molare.
1
I.I.S.S. “ALESSANDRO VOLTA” - ROMA PROGRAMMA CONSUNTIVO DI Chimica e Laboratro - CLASSE Seconda B
ANNO SCOLASTICO 2005 - 2006
MODULO n 1
TITOLO:IL PERINUCLEO: GUSCI
ELETTRONICI E VALENZA.
PREREQUISITI MODULO
Programma del primo anno
OBIETTIVI DEL MODULO
Completare l’esame dei modelli atomici.
Il modello a gusci come strumento adeguato per l’interpretazione dei
fenomeni chimici.
Evidenze sperimentali che hanno condotto alla conoscenza del modello a
gusci.
Concetto secondo il quale la conquista della conoscenza è un processo in
continuo divenire.
Conoscenze
(Sapere):
Competenze
(saper fare) su:
UNITÀ DIDATTICA
Interpretazione delle proprietà degli elementi sulla base del modello
atomico a gusci.
Riconoscimento di metalli mediante saggi alla fiamma.
N-0
La struttura dell’atomo
Contenuti
Indice
Particelle subatomiche
Disposizione spaziale delle particelle
Numero atomico
Peso atomuco
ORE TOTALI: 18
Descrizione
La scoperta dell’elettrone.
Il protone.
La scoperta della radioattività.
Modello planetario dell’atomo: nucleo e
perinucleo.
Il neutrone. Altre particelle subatomiche.
Numero atomico, numero di massa. Isotopi.
Massa atomica.
Qualità macroscopica e quantità microscopica.
La mole. Massa molare.
2
UNITÀ DIDATTICA
N–1
Titolo Perinucleo: gusci elettronici e valenzaContenuti
Indice
Descrizione
Quantizzazione
Il modello atomico di Bohr.
La luce
Lo spettro elettromagnetico.
Interazione della luce con la materia.
Interazione luce-materia
Eccitazione degli elettroni e salto quantico.
Dal concetto di orbita a quello di orbitale.
Struttura elettronica
Gusci elettronici ed energia di ionizzazione.
Ottetto completo e valenza dell’atomo.
Laboratorio
MODULO n 2
Saggi alla fiamma e alla perla con separazione
quantitativa.
TITOLO: CLASSIFICAZIONE DEGLI ELEMENTI ORE TOTALI: 37
E DEI COMPOSTI
PREREQUISITI MODULO
Le forme in cui l’energia si manifesta e si trasmette.
Cause di attrazione e repulsione tra oggetti: forze.
Concetto di funzione e correlazione tra grandezze.
Caratteristiche macroscopiche degli stati di aggregazione della
materia.
Principali grandezze elettriche e loro relazioni.
Conoscenze
(Sapere):
OBIETTIVI DEL MODULO
Conoscere il sistema periodico quale strumento di interpretazione dei
fenomeni chimici
Competenze
(saper fare) su:
Acquisire i criteri generali per la classificazione e la denominazione dei
composti cimici.
Comprensione di modelli e ipotesi su strutture ed eventi microscopici a
partire da osservazioni a livello macroscopico.
3
UNITÀ DIDATTICA
N-1
Titolo Sistema periodico e classificazione dei composti.
Contenuti
Indice
La tavola periodica
Guscio elettronico esterno e valenza.
Composti binari.
Composti ternari e quaternari
Descrizione
Il sistema periodico.
Criteri di classificazione.
Dimensione degli atomi.
Energia di ionizzazione, affinità elettronica,
elettronegatività.
Struttura elettronica e periodicità.
Valenza.
Acidi, basi, comportamento anfotero.
Caratteristiche degli elementi nei vari gruppi.
Generalità sulla classificazione dei composti.
Ossidi, idruri.
Idrossidi, acidi.
Sali.
Laboratorio
Vari tipi di reazioni.
Video
Le proprietà del sodio e del cloro
UNITÀ DIDATTICA
N-2
Titolo Legami chimici
Contenuti
Indice
Descrizione
I legami
Concetto di legame chimico.
Proprietà macroscopiche delle sostanze e teoria Legame ionico.
dei legami.
Legame covalente.
Legame covalente polare.
Legame covalente dativo.
Legame a idrogeno.
Le forze di Van der Waals.
Geometria molecolare e teoria VSEPR.
Legame metallico.
Laboratorio
Solubilità e miscibilità in solventi polari e non
polari
4
UNITÀ DIDATTICA
N-3
Titolo Le soluzioni
Contenuti
Indice
Lo stato solido
Lo stato liquido
Proprietà colligative
Descrizione
Solidi cristallini e solidi amorfi.
Lo stato liquido: le soluzioni.Concentrazione .
Abbassamento crioscopco ed innalzamento
ebullioscopico.
Osmosi e pressione osmotica.
Elettroliti e non elettroliti.
Laboratorio
Conduttori di prima e seconda specie.
Preparazione di una soluzione a concentrazione
nota.
Video
Le soluzioni.
MODULO n 3
TITOLO: TRASFORMAZIONI
CHIMICHE
ORE TOTALI: 35
PREREQUISITI MODULO
Elementi essenziali di stechiometria: calcolo delle moli, conversioni delle moli in unità di massa,
per i gas, di volume.
Leggi di conservazione della massa, dell’identità atomica, della carica, dell’energia.
Potenze.
Concetti di percentuale e di frazione di enti divisibili.
Modi di esprimere la concentrazione.
Conoscenze
(Sapere):
Competenze
(saper fare) su:
OBIETTIVI DEL MODULO
Interpretare le reazioni chimiche sotto l’aspetto qualitativo
Conoscere i concetti di acido e di base.
Conoscere gli strumenti concettuali per la misura dell’acidità e basicità
delle soluzioni.
Conoscere le reazioni di ossidoriduzione.
Conoscere il calcolo stechiometrico quale strumento per interpretare le
reazioni chimiche sul piano quantitativo.
Saper rapportare la struttura della sostanza alla sua natura acida o basica.
5
UNITÀ DIDATTICA
N-1
Titolo Reazioni chimiche
Contenuti
Indicatore
Descrittore
Classificazione delle reazioni chimiche
Sintesi degli elementi.
Addizione.
Analisi degli elementi costitutivi.
Decomposizione o dissociazione.
Scambio semplice.
Scambio doppio.
Reazioni in forma ionica.
Stechiometria delle reazioni.
Aspetti energetici
L’energia nelle reazioni: esotermiche,
endotermiche.
Energia di attivazione.
Laboratorio
Esempi di reazioni chimiche, con verifiche
sperimentali della legge di
conservazione
della massa e del calore di reazione.
Video
Reazioni chimiche e temperatura
UNITÀ DIDATTICA
N-
2
Indice
Equilibrio chimico
Equilibrio dell’acqua
Acidità e basicità
Misura dell’acidità
Laboratorio
Titolo Reazioni acido-base
Contenuti
Descrizione
Definizione di equilibrio.
Legge di azione di massa.
Prodotto ionico dell’acqua: acidità e basicità.
Definizione di acido e di base.
Carattere acido e basico dei composti.
L’acqua e il pH delle soluzioni.
Forza degli acidi e delle basi.
Reazioni acido-base.
Indicatori.
Titolazioni acido-base.
Forza degli acidi e delle basi e grado di
dissociazione.
Soluzioni di carattere acido, basico e neutro a
concentrazione nota.
Titolazioni acido-base.
6
UNITÀ DIDATTICA
N-3
Titolo Le reazioni di ossido-riduzione.
Contenuti
Indice
Ruolo regli elettroni nelle reazioni redox
Concentrazione ionica.
Laboratorio
UNITÀ DIDATTICA
Descrizione
Reazioni di ossidoriduzione.
Numero di ossidazione.
Ossidazione e riduzione.
Reazioni di ossidoriduzione in forma ionica.
Normalità de equivalenti nelle reazioni di
ossidoriduzione.
Potenziali redox
N-4
Titolo Conversione di energia chimica in energia elettrica e di
energia elettrica in energia chimica.
Contenuti
Indice
Descrizione
Energia elettrica prodotta da reazioni chimiche Conversione di energia chimica in energia
elettrica.
Semireazioni : coppie ossidoriduttive.
Potenziali ossidoriduttivi.
Forza elettromotrice (f.e.m.) delle pile.
Vari tipi di pile.
Reazioni chimiche prodotte mediante l’uso di Conversione di energia elettrica in energia
energia elettrica.
chimica.
Elettrolisi.
Applicazioni dell’elettrolisi.
La corrosione.
Reazioni spontanee ed energia.
La pila..
Laboratorio
Video
Metodologie
X Lezioni frontali
X Lezioni interattive
X Esperienze in laboratorio
Roma,
30 settembre
La pila elettrochimica:.
La chimica in natura
Strumenti
Verifiche
X Libro di testo
X Interrogazioni orali
X Appunti
X Interrogazioni scritte
X Sussidi audiovisivi
X Relazioni
2005
I professori
7
I.I.S.S. “ALESSANDRO VOLTA” - ROMA PROGRAMMA PREVENTIVO DI Chimica e Laboratro - CLASSE Seconda ……..
ANNO SCOLASTICO 2004 - 2005
ALLEGATO AI CRITERI DIDATTICI
MODULO n 1
TITOLO:IL PERINUCLEO: GUSCI
ELETTRONICI E VALENZA.
PREREQUISITI MODULO
Programma del primo anno
OBIETTIVI DEL MODULO
Completare l’esame dei modelli atomici.
Il modello a gusci come strumento adeguato per l’interpretazione dei
fenomeni chimici.
Evidenze sperimentali che hanno condotto alla conoscenza del modello a
gusci.
Concetto secondo il quale la conquista della conoscenza è un processo in
continuo divenire.
Conoscenze
(Sapere):
Competenze
(saper fare) su:
UNITÀ DIDATTICA
Interpretazione delle proprietà degli elementi sulla base del modello
atomico a gusci.
Riconoscimento di metalli mediante saggi alla fiamma.
N–0
La struttura dell’atomo
Contenuti
Indice
Particelle subatomiche
Disposizione spaziale delle particelle
Numero atomico
Peso atomuco
ORE TOTALI: 18
Descrizione
La scoperta dell’elettrone.
Il protone.
La scoperta della radioattività.
Modello planetario dell’atomo: nucleo e
perinucleo.
Il neutrone. Altre particelle subatomiche.
Numero atomico, numero di massa. Isotopi.
Massa atomica.
Qualità macroscopica e quantità microscopica.
La mole. Massa molare.
8
9