GLI ANIMALI DIPENDONO DA BATTERI E PIANTE
PER L’AZOTO (ciclo dell’azoto)
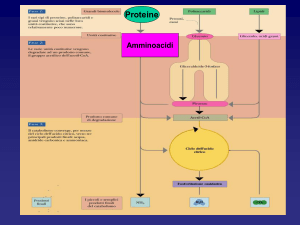
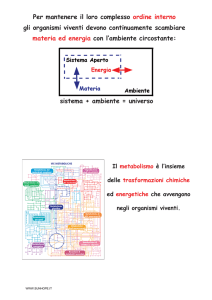
METABOLISMO
delle
PROTEINE
I S
I.
Soltanto
lt t alcuni
l
ib
batteri
tt i anaerobi,
bi simbionti
i bi ti nelle
ll radici
di i d
delle
ll
leguminose, sono in grado di fissare (ridurre) l’N2
atmosferico con produzione di ammoniaca
II. altri batteri ossidano NH3 a nitrito (NO2– ) e quindi a nitrato
II. Le piante sono in grado di utilizzare NO3– con
produzione di NH4+, che viene quindi incorporato nei
composti organici azotati (punto d’ingresso Glu e Gln)
III. Gli animali assumono composti organici azotati
(amminoacidi)
AZOTO essenziale per la vita
- Amminoacidi
- Nucleotidi
In natura
-N2 atmosferico (N
(N.B.
B N{N triplo legame
legame, molta energia per
scinderlo)
- ione nitrato NO3– presente nel suolo
Nei sistemi biologici sono presenti le forme ridotte
- ione ammonio NH4+ libero
- gruppo amminico (-NH3+) e gruppo ammidico (-NH-C=O )
presenti in composti organici
WWW.SUNHOPE.IT
Fonte primaria di azoto:
amminoacidi forniti dalle proteine
p
alimentari
Funzioni degli
g L-D-amminoacidi
Substrati p
per la sintesi proteica
p
20 a.a - con codone
21 a.a. selenocisteina
riconoscimento via tRNA
seril-tRNA + seleniofosfato J Se-cisteinil tRNA
subiscono modificazione post-sintetica
post sintetica
esempi: amminoacidi fosforilati; acido Jcarbossiglutammico
Componenti di peptidi
glutatione (GSH) JGlu-Cys-Gly
Glu Cys Gly
Intermedi metabolici
ornitina
Fonte energetica
a.a. glucogenici, a.a. chetogenici
Trasporto di azoto
glutammina alanina
glutammina,
Precursori per la biosintesi degli altri composti
contenti
t ti azoto
t
composti derivati
amminoacidi precursori
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Eme
glicina (+ succinil CoA)
Nucleotidi
glutammina, glicina, acido aspartico
Carnitina
lisina,, metionina
Creatina
arginina, glicina, metionina
Ammine biogene
,
istidina (J istamina)
triptofano (J serotonina)
Ti
Tiroxina,
i
adrenalina
d
li
ti i
tirosina
Taurina (nei sali biliari)
cisteina
Niacina
triptofano
CLASSIFICAZIONE NUTRIZIONALE
AMMINOACIDI ESSENZIALI :
devono necessariamente essere introdotti p
preformati con la dieta
valina
leucina
i l
isoleucina
i
metionina
fenilalanina
triptofano
istidina
lisina
treonina
AMMINOACIDI NON ESSENZIALI
i. semi-indispensabili risparmiano i precursori essenziali
tirosina (sintetizzata da fenilalanina)
cisteina (sintetizzata da metionina)
condizionatamente non essenziali
glicina, serina, prolina, glutammina, arginina
possono non essere sufficienti in alcuni stati particolari quali infezioni,
traumi bambini prematuri
traumi,
prematuri,
non essenziali
alanina aspartato
alanina,
aspartato, asparagina
asparagina, glutammato
Le reazioni di transaminazione, reversibili, permettono
di ridistribuire il gruppo NH3 fra gli amminoacidi
Vanno comunque integrati con la dieta e l’apporto
l apporto deve essere
bilanciato in quanto:
- Il pool di amminoacidi non è totalmente riutilizzabile
- NH3 principalmente prodotto di rifiuto, anche se vi è un
riutilizzo limitato a riformare amminoacidi
WWW.SUNHOPE.IT
I.
DIGESTIONE PROTEINE - STOMACO
pH acido: denatura le proteine
p
p
alimentari
pH acido: autoattivazione del
PEPSINOGENO J PEPSINA + peptidi
Il processo prosegue in modo autocatalitico
Pepsina: endopeptidasi poco specifica ma preferisce
rompere il legame che coinvolge il gruppo
carbossilico di Tyr
Tyr, Phe
Phe, Trp
proteine alimentari + pepsina J grandi peptidi
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
digestione
g
LUME
SANGUE
Cl–
HCO3–
Enzimi digestivi secreti come zimogeni inattivi attivati
tti ti tramite
t
it proteolisi
t li i nell llume iintestinale
t ti l
Cl–
Cl–
HCO3–
H+
WWW.SUNHOPE.IT
H+
CO2 + H2O
pompa
H+/K+
metabolismo
ATPasi
K+
membrana
baso-laterale
Cl–
K+
membrana
apicale
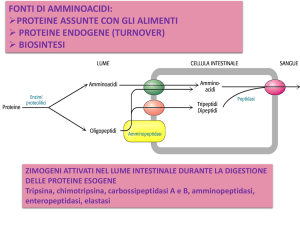
II LUME INTESTINALE tramite ENZIMI PANCREATICI
Zimogeni secreti dal pancreas esocrino
Enterochinasi: legata alla membrana apicale degli enterociti
TRIPSINOGENO + enterochinasi J TRIPSINA + esapeptidi
IV . ENTEROCITA
I peptidi
possono entrare nell
nell’enterocita
enterocita dove sono
scissi da amminopeptidasi citosoliche.
CHIMOTRIPSINOGENO + tripsina J CHIMOTRIPSINA +2 dipeptidi
PROELASTASI + tripsina J ELASTASI
PROCARBOSSIPEPTIDASI A e B + tripsina J CARBOSSIPEPTIDASI
endopeptidasi
TRIPSINA - scinde legame COO- di a.a. basici (Arg, Lys)
CHIMOTRIPSINA - scinde legame COO- di a.a. idrofobici (Phe, Tyr, Trp)
ASSORBIMENTO:
tramite numerosi trasportatori specifici per classi di
a.a. (neutri, dibasici,..), in genere cotrasportatori con
Na+ o H+
ELASTASI - scinde legame COO- di piccoli aa neutri (Gly, Ala, Val)
ENTEROCITI metabolizzano glutammina (loro principale
Esopeptidasi (rilasciano a.a. liberi e oligopeptidi di 2-8 residui)
fonte energetica), Glu, Asp, Arg per risparmiare glucosio ed acidi
grassi per gli altri tessuti
CARBOSSIPEPTIDASI A - a.a. aromatici
CARBOSSIPEPTIDASI B - a.a basici (Lys, Arg)
Circa 1% delle proteine sono parzialmente idrolizzate e
frammenti peptidici possono essere assorbiti come tali tramite
III. MUCOSA INTESTINALE
enzimi ancorati alla membrana dell’enterocita
- AMINOPEPTIDASI
- DIPEPTIDASI
PRODOTTI DELLA DIGESTIONE
AMMINOACIDI LIBERI, DI- e TRiPEPTIDI
WWW.SUNHOPE.IT
9 Trasportatore (es H+/PepT1 che importa anche antibiotici
beta lattamici)
9 Captazione transcellulare per endocitosi - e quindi esporto
tramite esocitosi
9 Captazione paracellulare tra le cellule
cellule, con una permeabilità
non specifica (in particolare in presenza di una mucosa
danneggiata)
bilancio di azoto o bilancio proteico: dipende dalla somma
delle velocità di entrata ed uscita dal pool di amminoacidi liberi
a
PROTEINE ALIMENTARI
POOL AA
METABOLISMO DELLE PROTEINE
b
d
PROTEINE CORPOREE
c
POOL DI DERIVATI
flusso in entrata = dieta + degradazione proteica (a + b)
rimozione a.a. = sintesi proteica + ossidazione (c + d)
a+b=c+d
a+b>d+c
costante
mantenimento nell’adulto
bilancio positivo
p
accrescimento; masse muscolari; gestazione
a + b < d + c bilancio negativo
g
insufficiente apporto energia e/o proteine; malattia
Aminoacidi e proteine sono in rapporto dinamico
UOMO ADULTO: proteine corporee circa 12 Kg
Proteine
della dieta
digestione
degradaz
zione
sintes
si
proteine corporee
Amminoacidi
N
C
Quota dei derivati non proteici
minoritaria e non si calcola nel
bilancio azotato;
ma quota significativa in
condizioni di privazione di
proteine
ma anche
h come ffonte
t di amminoacidi
i
idi iin condizioni
di i i di stress.
t
Le proteine muscolari non sono una forma di riserva come il glicogeno e i
lipidi ed una loro perdita porta a perdita di proteine funzionali.
Derivati non
proteici
10% tessuti viscerali (fegato, intestino)
p
in condizioni di stress p
per le loro funzioni vitali
non mobilizzate rapidamente
glucosio,
glicogeno
li
NH3
¾
urea
intermedi del
Ciclo
Ci
l di Krebs
K b
CO2 + energia
acidi grassi
trigliceridi
WWW.SUNHOPE.IT
40% nel muscolo di cui 65% miosina ed actina per lavoro muscolare,
30% nelle pelle e nel sangue
lesioni delle pelle ed anemia sono presenti in deficit di proteine alimentari
4 proteine:
miosina, actina, collagene (strutturali) ed emoglobina (trasporto O2)
costituiscono circa la metà di tutte le proteine
SISTEMI DI PROTEOLISI
CONTINUO RICAMBIO PROTEICO
Serve energia sia per la sintesi che per la degradazione:
15-20 % del bilancio energetico
ATP-indipendente LISOSOMIALE
contribuisce per il 15%
E i i attivi
Enzimi
i i a pH
H5
La continua demolizione e sintesi è fondamentale per
¾ degradare e rimpiazzare proteine danneggiate
-proteine extracellulari (via endocitosi)
-proteine di membrana
-organelli danneggiati (es mitocondri)
¾ modificare la quantità relativa di differenti proteine in base alle
necessità nutrizionali e fisiologiche
¾ rapido adattamento metabolico
ATP-dipendente CITOSOLICO
sistema ubiquitina-proteasoma
La regolazione del turnover proteico è influenzata da:
selettivo
l tti
¾ stato nutrizionale (energetico e proteico)
- proteine citosoliche
- proteine regolatorie
- proteine difettose (neo -sintetizzate per errori nella sintesi o per
¾ ormoni (insulina, glucocorticoidi, ormoni tiroidei, ormone della
crescita, citochine)
ORGANISMO
Ricambio giornaliero
1-2% proteine totali
Amminoacidi
70-80% riutilizzati
20-30% metabolizzati
Proteine dalla dieta
Proteine metabolizzate
70-80 grammi/giorno
250 grammi/giorno
g
sbagliato;
g
invecchiate))
ripiegamento
Premio Nobel 2004 Aaron Ciechanover, Avram Hershko and Irwin Rose
L’ubiquitina come suggerisce il nome è una
proteina presente in tutti gli eucarioti
L’ubiquitina si lega alla proteina da degradare in una via
ATP dipendente che utilizza 3 enzimi
E1
E2
E3
+ ATP ¼ E1-Ubiquitina
q
proteina di trasporto dell’ubiquitina
lega l’ubiquitina attivata alla proteina da
degradare
Come si riconosce la proteina da eliminare?
Varie ipotesi
% ricambio
muscolo 30-50%
g
25%
fegato
leucociti
emoglobina
diversa emivita
pochi minuti: proteine regolatorie
300 giorni:
i
i collageno
ll
amminoacido N-terminale destabilizzante
-amminoacido
Arg ~2 min
Tyr, Glu, ~ 10 min
Ile Gln ~ 30 min
oppure stabilizzante
Met. Gly, Ala, Ser, Thr > 20 ore
-particolari
particolari sequenze di distruzione
WWW.SUNHOPE.IT
ATP
La proteina marcata va al proteasoma
Proteine regolatorie per il
riconoscimento e selezione di
protine ubiquitilinate
•
subunità
7D
Proteine degradate dalle subunità
catalitiche E
7E
7E
Attività tipo chimotripsina - a.a. idrofobici
Attività tipo tripsina - a.a.
a a basici
Attività per a.a. acidi
L proteine
Le
i di ffase acuta sono proteine
i presentii nell plasma
l
sanguigno la cui concentrazione aumenta (proteine positive di fase
acuta) o diminuisce (proteine negative di fase acuta) in presenza
di infiammazione. Insieme alla febbre, alla leucocitosi e ad altre
manifestazioni quali tachicardia, ipertensione, brividi, anoressia e
malessere costituiscono la cosiddetta reazione di fase acuta
7D
oligopeptidi di 3-25 a.a.
scissi da proteasi citosoliche
L’attività
L
attività del proteasoma è sotto controllo ormonale
INSULINA inibisce il proteasoma
GLUCOCORTICOIDI attivano il proteasoma
azione coordinata per la mobilizzazione di amminoacidi
muscolari e per la gluconeogenesi epatica
ORMONI TIROIDEI attivano il proteasoma
CITOCHINE attivano il proteasoma
sepsi, febbre, ustioni, cancro,…
Aumento delle proteine della fase acuta ed aumento del
catabolismo proteico delle miofibrille mediato da un
aumento delle citochine TNF-D, IL-1, IL-6
WWW.SUNHOPE.IT
@ Le proteine della fase acuta vengono
sintetizzate dal fegato sotto l’induzione da
parte di citochine e di chemochine.
Le condizioni che portano a un aumento
delle loro concentrazioni plasmatiche sono:
• le infezioni
• i traumi
• gli intervento chirurgici
• le ustioni
• gli infarti di tessuto
• le infiammazioni immumologiche
• le infiammazioni immunologiche (cristalli gottosi)
• il cancro in stadi avanzati
WWW.SUNHOPE.IT
• Al pooll aminoacidico
i
idi
concorrono: aa d
da
proteine della dieta; aa da proteine tessutali;
aa sintetizzati de novo.
novo Il pool è di circa 100g.
100g
• 75% degli aa è usato per biosintesi, il 25% per
altri
lt i composti
ti azotati.
t ti IIn una alimentazione
li
t i
corretta sarebbe sufficiente integrare questo
25% (pari circa a 1g/Kg peso corporeo)
WWW.SUNHOPE.IT
cheto-omologo
o transaminasi
WWW.SUNHOPE.IT
Per essere ossidati devono
perdere il gruppo aminico:
per transaminazione o
p
deaminazione ossidativa.
WWW.SUNHOPE.IT
Tutti gli aa con l’eccezione di lisina e
treonina vanno incontro a
transaminazione, l’accettore è l’ǂchetoglutarato
L’AST,, aspartato
p
aminoTasi. è un
eccezione perché l’accettore non è l’alfachetoglutarato, ma l’ossalacetato che
sarà p
portatore del 2°gruppo
g pp aminico
nella sintesi dell’urea.
L’alanina aminotransferasi (ALT) ex GPT
Lisina e treonina subiscono la deaminazione ossidativa
AST
Ex GOT
Meccanismo d’azione delle aminotransferasi:
Tutte richiedono il piridossalfosfato (vit B6)
l
legato
t con llegame dž-aminico
i i ad
d una lys
l del
d l sito
it
attivo. La reazione è una reazione bimolecolare a
ping pong. Infatti il primo substrato lascia il
gruppo amminico al PDF ed esce come
chetoacido, mentre il secondo chetoacido entra e
lega il gruppo amminico dalla piridossamina
fosfato ed esce come amminoacido.
amminoacido
La K di equilibrio della reazione è quasi 1, così la
reazione può decorrere in tutti e due i sensi,
rispondendo alle diverse necessità della cellula.
WWW.SUNHOPE.IT
Le reazioni di transaminasi assolvono a due compiti:
•
Promuovono l’interconversione degli aa adeguandone le quantità alle
esigenze metaboliche ed ovviando agli eventuali squilibri dietetici.
•
Indirizzanol’eccesso di aa verso il loro utilizzo salvaguardando la quota
richiesta per la biosintesi proteica.
Questo controllo è assicurato da due meccanismi:
1 Induzione
1.
I d i
d
delle
ll transaminasi
i
i epatiche
i h e iintestinali
i li d
da eccesso di proteine
i
dietetiche
2. Scarsa affinità delle transaminasi per gli aa (Km: 1-50mM). Così le
t
transaminasi
i
i sii attivano
tti
solo
l oltre
lt una certa
t soglia
li di concentrazione
t
i
amminoacidica.
Le transaminasi rivestono valore diagnostico in quanto la loro elevata
concentrazione nel plasma è indice di lesione d’organo, in particolare la GOT e
la GPT rispettivamente indicative di danno cardiaco ed epatico.
epatico
WWW.SUNHOPE.IT
Nel loro insieme le reazioni di transaminasi tendono a convogliare il gruppo
amminico verso l’Ĵ-chetoglutarato per formare glutammato, il quale viene restituito
alla sua funzione di collettore di gruppi amminici dalla deaminazione ossidativa
ossidativa, che
ripristina l’Ĵ-chetoglutarato liberando l’NH3. Nelle cellule la GOT esiste in due
isoforme: citosolica e mitocondriale. La forma citosolica facilita la formazione del
glutammato quella mitocondriale dell
glutammato,
dell’ Ĵ
Ĵ-chetoglutarato
chetoglutarato
Valore diagnostico delle
p
amminotransferasi plasmatiche
O (GPT)
la GDeidrogenasi: il gruppo amminico della maggior parte degli aa è indirizzato al glutammato per
mezzo della transaminazione dell’Ĵ-chetoglutarato
dell Ĵ-chetoglutarato, che poi produrrà l’NH3
l NH3
Andamento dell’ALT e della
bilirubina sierica nel monitoraggio
dell’avvelenamento da Amanita
Phalloides
la GDeidrogenasi: il gruppo amminico della maggior parte degli aa è indirizzato al
glutammato per mezzo della transaminazione dell’Į-chetoglutarato, però…
Fattori allosterici:
ATP/ADP, GTP/GDP
Coenzimi NAD/NADH,
NADP/NADPH
La direzione della reazione dipende
p
dalle
esigenze della cellula
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
La reazione è reversibile, nel verso riduttivo usa NADPH. Il verso della
reazione dipende dal rapporto [NAD]/[NAD(P)H. Poiché le transaminasi
citosoliche sono p
più attive di quelle
q
mitocondriali e poiché
p
la glutammato
g
deidrogenasi è solo mitocondriale, Ĵ-chetoglutarato colleziona gruppi ammici a
livello citosolico, mentre il glutammato mitocondriale si libererà dell’ NH3 nel
processo di deaminazione ossidativa.
Deaminazione
• La deaminazione può essere ossidativa e non
ossidativa.
id ti
• La D. Ossidativa è catalizzata dalle amminoacido
ossidasi la più importante è la glutammico
ossidasi,
deidrogenasi (oltre alla L e la D-amminoacido
ossidasi).
NAD
• Glutammato
H2O
NADH
Imminoglutammato
g
Abbiamo definiti i meccanismi che consentono l’eliminazione della
NH3 dallo scheletro carbonioso degli aa. La deamminazione ossidativa del glutammato (a livello epatico) convoglia l’ammoniaca nel
ciclo dell’urea, forma attraverso la quale sarà eliminata.
NH3
Ĵ-chetoglutarato
g
La L e D amminoacido Ossidasi sono FMN e FAD Dipendenti la D interviene su
D aa prodotti dalla flora e assorbiti occasionalmente, la L ha attività
bassissima e scarso rilievo fisiologico
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
Deaminazione non ossidativa
Gli esseri umani usano due meccanismi per
trasportare l’NH3 dai tessuti periferici al fegato
dove si produce l’urea: molti tessuti attraverso la
glutammina (glutammina sintetasi) che funge da
tampone per l’NH3, una forma atossica per l’NH3.
Il secondo meccanismo lo utilizza essenzialmente
il t. muscolare che trnsammina il piruvato (dal
glucosio) ad alanina. l’ala raggiunge il fegato viene
transaminata, si forma piruvato e glutammato. (ciclo
glucosio alanina)
Enzimi inducibili piridossal fosfato dipendenti
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
Alanina e lattato trasportano al fegato il piruvato per sostenere la sintesi del glucosio,
l’ l i costituisce
l’alanina
i i
anche
h il trasportatore atossico
i d
dell’NH3
ll’NH3 d
dall muscolo
l all ffegato
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
L’urea rappresenta il 90% dei composti
urinari contenenti azoto
l’urea migra ai reni per via ematica,
dove viene filtrata e escreta, ma
una parte diffonde all’intestino
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
WWW.SUNHOPE.IT
Aspartato+NH
p
3+3ATP
Urea+Fumarato+2ADP+AMP+2Pi+
PPi+3H20
WWW.SUNHOPE.IT
WWW.SUNHOPE.IT
Da dove proviene ll’NH3
NH3
• Dagli aa,
aa mediante le reazioni di amminotransferasi e
glutammato deidrogenasi.
glutammina. Nei reni dove si forma p
per azione
• Dalla g
della glutaminasi renale. L’escrezione con l’urina
dell’NH3, come NH4+, contribuisce al mantenimento
dell’eq.
q acido-base dell’organismo.
g
Nell’intestino con la
glutaminasi intestinale, che la riceve sia dal plasma che
dalla digestionedelle proteine alimentari.
• Dall
Dall’attività
attività batterica nell’intestino
nell intestino dove la flora batterica
attacca l’urea riassorbita dal circolo ematico (in transito
tra fegato e rene), con l’ureasi, l’intestino la riimmette nel
circolo portale da dove viene rieliminata dal fegato
(UREA)
• Dalle ammine e dalle purine e pirimidine.
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
Il trasporto dell
dell’NH3
NH3
• La produzione di NH3 avviene costantemente in
tutti i distretti dell’organismo, nel sangue il suo
livello è basso (5-50um/L). Questo avviene
essenzialmente per 2 motivi:
• La capacità depurativa del fegato (UREA)
• La liberazione da parte di cellule periferiche
(soprattutto muscolari) di ricorrere
all’eliminazione
all
eliminazione dell’NH3
dell NH3 sotto forma di
Glutammina e Alanina.
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
Destino metabolico dell’ammoniaca
dell ammoniaca
• L’NH3 che
h sii lib
libera d
dalla
ll d
deaminazione
i
i
d
deglili aa e d
deglili
altri composti azotati (es. l’adenilato deaminasi molto
attiva nel muscolo card. e schel.,, libera NH3 da AMP))
deve essere eliminata perché molto tossica,l’organismo
la incorpora subito in composti atossici che
rappresentano una forma di trasporto e di
preeliminazione. Negli organismi uricotelici l’NH3 si
elimina come Urea .
Tre sono i processi di organicazione dell’NH3:
• Formazione del glutammato
• Formazione della glutammina
• Sintesi del carbamilfosfato
WWW.SUNHOPE.IT
•
Il 3° processo di organicazione dell’NH3 è la sintesi del carbamilfosfato. La carbamilP-sintetasi è
attiva solo in presenza di N-acetil-glutammato, dipende da NH3, è intramitocondriale di concerto
con la glutammato deidrogenasi, incorporando l’NH3 man mano che si forma ad opera della
Gl t
Glutammato
t D
Deidrogenasi.
id
i Si fforma carbamil
b il ffosfato
f t anche
h nell citosol,
it
l d
dove non è usato
t per lla
sintesi dell’urea, ma per i nucleotidi pirimidinici. I due E coinvolti nelle due vie sono
rispettivamente l’aspartato transcarbamilasi citosolica e la ornitina transcarbamilasi
mitocondriale. La carbamilfosfato sintetasi citosolica è p
più attiva nei tessuti in accrescimento
(tumori, fegato rigenerante). La sintesi dell’urea è invece solo del fegato.
Un esempio che descrive bene le due attività è fornito dal fegato rigenerante:
Durante la fase rigeneratrice prevale la via n.1, ma appena il fegato è stato riformato
l’attività dell’aspartato transcarbamilasi si riduce mentre aumenta quella dell’Ornitina
Transcarbamilasi.
WWW.SUNHOPE.IT
Ciclo dell’alanina muscolo fegato, forma in cui l’NH3 viene portata in circolo in forma atossica, il
fegato utilizza il piruvato per fare glucosio e incorpora l’NH3 nell’urea. Il muscolo rilascia anche
glutammina, usata dai reni e aa ramificati, usati prevalentemente dal cervello.
La carbamil-P-sintetasi
carbamil P sintetasi Idipende da NH3 ed è attiva solo in presenza di N-acetil-Glu,
N acetil Glu (effettore
allosterico), è intramitocondriale, opero di concerto con la glutammato deidrogenasi. Nel citosol
CPSII, produce CarbamilP a partire da glutammina ed è insensibile all’Nacetil-Glu
CPSI: carbamilfosfato sintetasi NH3 dipendente
CPSII: carbamilfosfato sintetasi glutammina dipendente
•La carbamil-P-sintetasi è attiva solo in presenza di N-acetil-glutammato, dipende da NH3, è
intramitocondriale di concerto con la glutammato deidrogenasi, incorporando l’NH3 man mano che
si forma ad opera della Glutammato Deidrogenasi. Si forma carbamil fosfato anche nel citosol,
d
dove
non è usato
t per la
l sintesi
i t id
dell’urea,
ll’
ma per i nucleotidi
l tidi pirimidinici.
i i idi i i I d
due E coinvolti
i
lti nelle
ll d
due
vie sono rispettivamente l’aspartato transcarbamilasi citosolica e la ornitina transcarbamilasi
mitocondriale. La carbamilfosfato sintetasi citosolica è più attiva nei tessuti in accrescimento
((tumori,, fegato
g
rigenerante).
g
) La sintesi dell’urea è invece solo del fegato.
g
WWW.SUNHOPE.IT
WWW.SUNHOPE.IT
Il ciclo dell'urea richiede un'elevata
quantità di energia (4 ATP per ogni
molecola di urea prodotta).
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
WWW.SUNHOPE.IT
WWW.SUNHOPE.IT
L’NH3 non entra come tale
l nell ciclo
l dell’urea,
d ll’
ma come carbamilfosfato
b
lf f
e come aspartato,
quindi le quantità di carbamilfosfato, nel mitocondrio e di aspartato nel citosol costituiscono
Il primo fattore di regolazione, poi ci sono una regolazione:
La capacità ureogenetica del fegato garantisce un livello di NH3 nel sangue minore di
5μm (0,1mg/100ml). Contribuisce all’uricemia l’assorbimento di NH3 dell’intestino
crasso di derivazione batterica.
e una regolazione:
l i
Il livello di NH3 nel sangue può arrivare a 250 μmoli/l, cui segue stato
confusionale,coma e morte, come ad es per grave insufficienza epatica.
I livelli normali si aggirano tra 2,5-6 μm /l valori più elevati sono indice di alterata
filtrazione glomerulare (glomerulonefrite), o di bassa pressione ematica. Bassi valori di
urea
rea si riscontrano in difetti congeniti dell’
dell’ureagenesi
reagenesi e in gravi
gra i epatopatie si fa diagnosi
per la presenza di ac orotico nelle urine: L’ac. Orotico è un intermedio della biosintesi
delle basi puriniche. (carbamilfosfato citoplasmatico).
WWW.SUNHOPE.IT
WWW.SUNHOPE.IT
CATABOLISMO DELLO SCHELETRO
CARBONIOSO DEGLI AMMINOACIDI
Come riportato in figura gli scheletri carboniosi convergono in sette
composti in grado di entrare direttamente o indirettamente nel ciclo di
Krebs: piruvato,
piruvato acetilCoA,
acetilCoA acetoacetilCoA,
acetoacetilCoA Į -chetoglutarato,
-chetoglutarato succinilCoA,
succinilCoA
fumarato, ossalacetato.
Gli amminoacidi che vengono degradati ad acetilCoA o acetoacetilCoA sono
detti chetogenetici e sono i precursori dei corpi chetonici .
Gli altri sono glucogenetici e possono, una volta convertiti in piruvato ed
ossalacetato, formare glucosio attraverso la gluconeogenesi.
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
Lo scheletro carbonioso degli amminoacidi viene utilizzato nel ciclo di Krebs
per produrre energia.
energia
WWW.SUNHOPE.IT
piruvato, acetilCoA, acetoacetilCoA, Į -chetoglutarato, succinilCoA, fumarato, ossalacetato
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
ESCREZIONE DELL'AZOTO
Solitamente i gruppi amminici in eccesso vengono escreti oppure utilizzati per
sintetizzare composti azotati.
Un importante processo a cui vanno incontro gli amminoacidi è la
d
deamminazione
i
i
ossidativa.
id ti
E
Essa avviene
i
neii mitocondri
it
d i ed
d è catalizzata
t li
t d
dalla
ll
glutammato deidrogenasi, un enzima che allontana il gruppo amminico dal
glutammato e lo sostituisce con l'ossigeno proveniente dall'acqua.
Lo ione ammonio che si viene a formare reagisce col glutammato per formare
glutammina che funge da trasportatore di gruppi amminici al fegato.
glutammina,
fegato L
L'enzima
enzima
che permette questa reazione ATP-dipendente è la glutammina sintetasi.
La g
glutammina entra nel circolo sanguigno
g g
e raggiunge
gg g il fegato
g
dove, all'interno dei
mitocondri epatici, viene riconvertita a glutammato con liberazione dello ione ammonio
NH4 + .
L alanina rappresenta il principale trasportatore di gruppi amminici dal muscolo al
L‘alanina
fegato. Essa viene formata per trasferimento del gruppo amminico dal glutammato
all'acido piruvico o piruvato. Similmente a quanto avviene per la glutamina, una volta
giunta all'interno dei mitocondri epatici,
g
p
, l'alanina libera il p
proprio
p
ione ammonio
generando glutammato e piruvato. Il piruvato è necessario al fegato nel processo
chiamato gluconeogenesi.
Lo ione ammonio NH4 + è tossico per le cellule del corpo ed in particolare per il
cervello. Come abbiamo visto, in sede extraepatica lo ione ammonio viene
neutralizzato tramite il legame con il glutammato o con il piruvato. Nel fegato l'NH4 +
viene incorporato nella molecola atossica dell
dell'urea.
urea. L
L'urea
urea prodotta dal fegato viene
trasportata attraverso il sangue ai reni per l'escrezione urinaria.
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
WWW.SUNHOPE.IT
WWW.SUNHOPE.IT