Svolgono funzioni biologiche di fondamentale importanza e possono essere
divise in 7 gruppi principali:
• proteine strutturali (collagene, cheratine);
• proteine catalitiche (enzimi);
• proteine di trasporto (emoglobina, albumina);
• proteine regolatorie (ormoni);
• proteine di protezione (anticorpi, trombina);
• proteine contrattili (actina, miosina)
• proteine di riserva (ovoalbumina, caseina)
Gli amminoacidi provenienti dai processi degradativi e digestivi
vengono utilizzati principalmente per la sintesi delle proteine o di
altri composti azotati come le basi azotate
L’organismo deve continuamente costruire nuove proteine
non solo durante l’accrescimento ma anche in età adulta (turnover); per far ciò
c’è bisogno di nuovo materiale proteico proveniente dall’esterno per rifornire il
“pool” di amminoacidi corporeo
Fabbisogno proteico
10 -15 % Kcal/die
(Razione Dietetica Raccomandata)
Neonato = 2.2 gr/Kg di p.c./die
Bambino = 1.5 gr/Kg di p.c./die
Adulto = 1.0 gr/Kg di p.c./die
Dieta
AMMINOACIDI
Degradazione delle proteine
Sintesi ex-novo
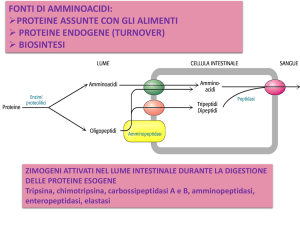
DIGESTIONE ED
ASSORBIMENTO DELLE
PROTEINE
(avviene nel tratto
gastro-intestinale)
L’assorbimento intestinale
*
* Localizzata sulla
membrana
plasmatica degli
enterociti
Dieta
AMMINOACIDI
Sintesi ex-novo
Degradazione delle proteine
La maggior parte delle proteine corporee è
continuamente sintetizzata e degradata; ciò
permette l’eliminazione delle proteine anomale o
non più necessarie (es. proteine regolatorie)
Il turnover delle proteine può durare da poche ore a
decine di giorni
Proteasi intracellulari presenti:
CALPAINE (attivate da Ca2+)
PROTEASI NEUTRA
nel citosol
*PROTEASOMA (ATP-dipendente)
CATEPSINE --------------------à nei lisosomi
SEGNALI BIOCHIMICI PER LA DEGRADAZIONE
DELLE PROTEINE
-
-
-
Ubiquitazione
residuo N-terminale: Phe, Leu, Tyr, Trp, Lis, Arg, Asp
ossidazione di residui aminoacidici (ARG, LIS, PRO)
sequenze PEST, prolina (P), acido glutammico (E),
serina (S) e treonina (T).
Qual è il destino metabolico degli
amminoacidi che si rendono liberi
durante la digestione o il turnover
delle proteine?
Quantità totale di aa
500gr/die
~ 100gr
dieta
~ 400gr
rilasciati dalla degradazione delle proteine
400gr vengono utilizzati per la sintesi
delle proteine
100gr sono metabolizzati
Biosintesi di amminoacidi
ex-novo (variabile)
Gli amminoacidi in eccesso rispetto alle necessità
biosintetiche non possono essere né accumulati né
escreti e vengono utilizzati come fonte di energia
Gli amminoacidi in eccesso rispetto alla richiesta vengono catabolizzati a scopo
energetico o possono essere convertiti in glicogeno o in trigliceridi ed essere così
immagazzinati dall’organismo
Un accentuato catabolismo degli amminoacidi, che si formano per incremento
dell’idrolisi delle proteine tissutali (prevalentemente muscolari), si verifica quando,
esaurite le riserve glucidiche, l’organismo deve ricavare energia da altre fonti tra cui lo
scheletro carbonioso degli aminoacidi (digiuno prolungato). In queste condizioni il
principale destino metabolico dello scheletro carbonioso è la sua conversione in
GLUCOSIO mediante la GLUCONEOGENESI
Il distacco del gruppo a-amminico degli amminoacidi
avviene mediante processi di TRANSAMINAZIONE
seguiti dalla DEAMMINAZIONE OSSIDATIVA
TRANSAMINAZIONE: trasferimento reversibile del gruppo amminico da un
amminoacido ad un a-chetoacido catalizzato dalle TRANSAMINASI
(AMMINOTRANSFERASI)
R1
R2
R2
R1
Tutti gli aa tranne Lisina e Treonina sono suscettibili di transaminazione
Poiché l’accettore del gruppo
amminico è quasi sempre l’achetoglutarato, il nome di una
transaminasi dipende dallo
specifico donatore del gruppo
amminico
1
2
Le transaminasi
catalizzano reazioni
prossime
all’equilibrio la cui
direzione in vivo
dipende dal
rifornimento di
substrato e dalla
rimozione del
prodotto
1 Alanina amminotransferasi (ALT) (Glutammato-Piruvato transaminasi, GPT)
2 Aspartato amminotransferasi (AST) (Glutammato-Ossalacetato transaminasi, GOT)
Il glutammato incanala i gruppi amminici sia nelle vie
biosintetiche (sintesi amminoacidi, nucleotidi e ammine
biogene) sia nella sequenza finale delle reazioni in cui si
formano i prodotti azotati da eliminare (utilizzo dello
scheletro carbonioso)
transaminasi
Il glutammato viene trasportato dal citosol
nei mitocondri dove viene sottoposto a
deamminazione ossidativa.
GlutammatoDH
L’azione combinata delle transaminasi
(o amminotransferasi) e della
glutammato deidrogenasi viene detta
“transdeamminazione”
L’effetto netto di queste due reazioni
è il rilascio di gruppi a-amminici sotto
forma di ammoniaca e la formazione di
a-chetoacidi
Reazione di DEAMMINAZIONE OSSIDATIVA catalizzata dalla Glutammato Deidrogenasi,
presente solo nei mitocondri, costituito da 6 subunità identiche, KM elevata per l’NH3, sottoposto a
regolazione allosterica:
• GTP modulatore negativo
• ADP modulatore positivo
• Utilizza NADPH nella direzione di produzione di Glutammato
Tutte le transaminasi
(amminotransferasi) utilizzano il
coenzima piridossal fosfato
(derivato della vitamina B6)
Sito attivo dell’enzima TRANSAMINASI
anello piridinico sostituito
Il PLP è la forma coenzimatica la cui
formazione è ATP dipendente
Gruppo prostetico legato all’enzima mediante interazioni
non covalenti molto forti e mediante la formazione di una
base di Schiff con un residuo di Lys del sito attivo
Anche se la degradazione degli amminoacidi
avviene prevalentemente nel FEGATO, altri
tessuti possono degradare gli amminoacidi
Esempio: il MUSCOLO utilizza gli amminoacidi
a catena ramificata (Valina, Isoleucina e
Leucina) come fonte di energia nell’esercizio
prolungato e nel digiuno
ma……….
non possiede gli enzimi del Ciclo dell’UREA
Ciclo del Glucosio-Alanina
(fegato/muscolo)
Nel tessuto muscolare, la via di
trasporto dell'ammoniaca è particolare.
A seguito della glicolisi si forma un
quantitativo elevato di piruvato. Questo
chetoacido accetta un gruppo amminico
dal glutammato mediante l'intervento
dell'enzima alanina amminotransferasi
(ALT) con la conseguente sintesi
dell'alanina. L'alanina così formata si
dirige dal muscolo al fegato
trasportando con sé il gruppo amminico.
Nel fegato tale gruppo viene
allontanato e si forma nuovamente
piruvato che entra nella gluconeogenesi
per formare il glucosio. Per questo
motivo questo particolare processo di
eliminazione dello ione ammonio viene
definito ciclo glucosio-alanina
(ALT)
(Fegato/Muscolo)
Ciclo del Glucosio-Alanina
Ciclo Del Glucosio-Lattato (Ciclo di Cori)
ELIMINAZIONE
DELL’AZOTO
Ammoniaca (animali ammoniotelici)
Urea
(animali ureotelici)
Acido urico (animali uricotelici)
Ciclo dell’UREA
L’eccesso di ammoniaca
deve essere eliminata
dall’organismo.
Nella maggioranza dei
vertebrati terrestri e nei
mammiferi l’azoto viene
eliminato sotto forma di
u r e a c h e v i e n e
sintetizzata nel fegato e
dopo essere stata
riversata in circolo,
raggiunge i reni e viene
escreta con le urine
Trasporto dell’ammoniaca prodotta a livello dei tessuti al fegato
Regione periportale
GluDH
ALT
La glutammina rappresenta
la principale forma di trasporto
dell’ammoniaca (circa il 50%)
Di norma è presente nel siero
a concentrazioni molto più
elevate di quelle degli altri
amminoacidi
L’ammoniaca
è trasportata
dalla
glutammina
nella maggior
parte dei
tessuti, ma
dall’alanina
nel muscolo
Nei tessuti:
glutammato + NH4+ + ATP
Glutammina + ADP + Pi
Nel fegato (regione periportale):
Glutammina + H2O
Glutammato + NH4+
Glutammato + NAD(P)+
α-KG + NAD(P)H + NH4+
(glutammina sintetasi)
(glutamminasi)
(glutammicoDH)
Da dove derivano gli ioni ammonio?
IL CICLO DELL’UREA
L’urea è la forma principale di
eliminazione dei gruppi amminici
provenienti dagli amminoacidi e
costituisce il 90% circa dei
composti urinari contenenti
azoto
Aspartato + NH4+ + HCO3- + 3ATP + H2O
Urea + fumarato + 2ADP + AMP + 2Pi + PPi
Ciclo dell’UREA
• Contributo
mitocondriale
• Contributo
citosolico
OSSALACETATO
L’aspartato è il donatore del
secondo gruppo amminico
per la formazione dell’urea
Ciclo dell’urea: NH3 + HCO3- + aspartato + 3ATP + H2O
----à UREA + fumarato + 2 ADP + 2Pi + AMP + PPi
•
•
•
•
richiede 3 ATP + ione Ammonio + Aspartato
+ bicarbonato
Produce UREA + fumarato + 2ADP + 2 Pi +
AMP + PPi
il FUMARATO entra nel TCA
N.B. costo energetico: 4 ATP consumate,
2,5 ATP prodotte= 1,5 ATP
La velocità del ciclo dell’ UREA è determinata da una regolazione a
lungo termine e da una a breve termine
Regolazione a lungo termine:
i cinque enzimi del ciclo sono sintetizzati
- ad elevata velocità durante i periodi di digiuno o con diete ricche di proteine
- a velocità molto inferiore con diete povere di proteine e ricche di carboidrati
Regolazione a breve termine:
la regolazione allosterica del primo enzima della via metabolica,
la carbamil fosfato sintetasi I (N-acetilglutammato)
Un deficit degli enzimi epatici preposti al CICLO DELL’ UREA (mitocondriali o citosolici) causa
iperammonemia.
Metabolismo dell’ammoniaca
M
e
t
a
b
o
l
i
s
m
o