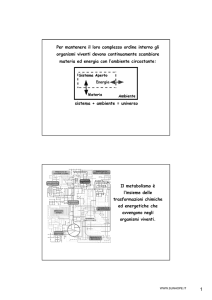
Per mantenere il loro complesso ordine interno
gli organismi viventi devono continuamente scambiare
materia ed energia con l’ambiente circostante:
sistema + ambiente = universo
Il metabolismo è l’insieme
delle trasformazioni chimiche
ed energetiche che avvengono
negli organismi viventi.
WWW.SUNHOPE.IT
Nei diversi organi e tessuti la coordinazione del
metabolismo avviene mediante il sistema neuroendocrino.
All’interno di ciascuna cellula
le varie vie metaboliche
sono regolate a livello
delle reazioni catalizzate
dai singoli enzimi.
O
T
I
L
I
L
WWW.SUNHOPE.IT
Catabolismo (degradazione)
- natura ossidativa
- produce energia (ATP, NADPH)
Anabolismo (biosintesi)
- natura riduttiva
- richiede energia (NADPH, ATP)
WWW.SUNHOPE.IT
WWW.SUNHOPE.IT
Anabolismo e catabolismo di una certa molecola
(es. glucosio) seguono vie in tutto o in parte diverse
- 7 tappe sono catalizzate dagli stessi enzimi
- 3 da enzimi diversi
La regolazione delle due vie è reciprocamente
coordinata per evitare il funzionamento simultaneo
WWW.SUNHOPE.IT
Anabolismo e catabolismo di una certa molecola possono
avvenire in compartimenti cellulari diversi
A-E1ÆB-E2ÆC-E3ÆD-EnÆZ
La regolazione di una via metabolica può riguardare:
- attività enzimatica
modulazione allosterica o covalente (msec o sec)
- livelli dell’enzima
bilancio tra sintesi e degradazione (min o ore)
WWW.SUNHOPE.IT
A-E1ÆB-E2ÆC-E3ÆD-EnÆZ
In una via metabolica la prima reazione irreversibile,
detta tappa limitante, è generalmente un
importante sito di regolazione.
Spesso il prodotto finale di una via inibisce l’enzima
che catalizza la tappa limitante
(retroinibizione o inibizione a feedback).
WWW.SUNHOPE.IT
sistema + ambiente = universo
La Bioenergetica è lo studio quantitativo delle
trasformazioni energetiche associate alle reazioni chimiche.
Queste trasformazioni obbediscono alle leggi della
Termodinamica.
Leggi della Termodinamica
1a Legge (principio di conservazione dell’energia)
L’energia totale dell’universo è costante
2a Legge
Un processo può avvenire spontaneamente solo
se l’entropia dell’universo aumenta
WWW.SUNHOPE.IT
Ad una certa T, lo stato energetico di un sistema chimico
può essere descritto in termini di:
H = entalpia (contenuto termico)
S = entropia (grado di disordine)
G = energia libera di Gibbs
(energia utile a compiere un lavoro)
Le variazioni di G, H, S sono tra loro correlate
dall’equazione ΔG = ΔH - TΔS
ΔG<0
Né ΔH né Δs, ma solo ΔG può permettere di predire
la spontaneità di una reazione.
WWW.SUNHOPE.IT